Lange wurde dem Allgemeinzustand von Patient:innen vor onkologischen Eingriffen wenig Aufmerksamkeit geschenkt. Es galt die Devise, den Tumor so rasch wie möglich nach Diagnosestellung zu entfernen. Dabei wurden erhöhte Risiken für Wundinfektionen, längeren Krankenhausaufenthalt, höhere Gesamtmortalität und eine schlechtere postoperative Lebensqualität bei gebrechlichen oder mangelernährten Patient:innen als unvermeidlich akzeptiert [1–3].
Das Konzept der Prähabilitation fokussiert nun darauf, bereits präoperativ Risikofaktoren wie Mangelernährung, Gebrechlichkeit oder Blutarmut zu identifizieren und im Idealfall zu eliminieren. Ziel ist eine postoperative Risikoreduktion und damit verbunden eine schnellere Rekonvaleszenz der betroffenen Patient:innen [4–6].
Prähabilitation ist jedoch keine Einzelmaßnahme, sondern besteht aus einem Bündel an Interventionen im Bereich Ernährung und Physiotherapie ergänzt durch Empfehlungen zur Nikotin- und Alkoholkarenz sowie eine psychoonkologische Anbindung [4–6]. Zusätzlich werden bei Substratmangel Eisen- und Vitaminsubstitution bei anämischen Patient:innen empfohlen.
Was auf den ersten Blick banal erscheint – regelmäßige, zügige Spaziergänge von ca. 30 Minuten täglich oder hochkalorische Trinknahrung [6-8] – ist in der Praxis oft von großer Bedeutung. Jedoch lässt die derzeitige sehr heterogene Studienlage mit unterschiedlichen Patientenkollektiven, unterschiedlichen Interventionen und unterschiedlichen Outcomeparametern bislang nicht eindeutig erkennen, welche Maßnahmen bei welchem Patientenkollektiv am erfolgversprechendsten sind. [5]
In der aktuellen S3-Leitlinie zum perioperativen Management gastrointestinaler Tumore wird daher auch eine über die allgemeinen Empfehlungen hinausgehende strukturierte, ressourcenaufwändige Prähabilitation als verzichtbar bezeichnet [9]. Dies fußt jedoch vor allem auf der Auffassung, dass Empfehlungen zur Erhaltung und Verbesserung der körperlichen Aktivität, zu ausgewogener Ernährung sowie zum Nikotin-/Alkoholverzicht vor Tumoroperationen heutzutage als Mindeststandard gelten sollten. Gleichzeitig betont die Leitlinie, dass Risikopatient:innen bei der Vorbereitung größerer Operationen partizipativ zu einer individualisierten Prähabilitation zu Hause motiviert werden sollten.[9]
Diese Einschätzung und Empfehlung gehen allerdings an der aktuellen Versorgungsrealität in Deutschland vorbei, in der eine strukturierte, präoperative Beratung und Begleitung der Patient:innen nicht flächendeckend gewährleistet ist.
Wir möchten daher sowohl Screeningtools zur Identifikation von Risikopatient:innen, als auch Prähabilitationsmaßnahmen vorstellen, deren positive Effekte belegt und die unseres Erachtens im klinischen Alltag gut umzusetzen sind. [6–8]
Es ist hervorzuheben, dass weder die in der Leitlinie als Standard formulierte perioperative Beratung und Begleitung noch die Betreuung und Prähabilitation von Risikopatienten ohne fachärztliche, ernährungsmedizinische Beteiligung umzusetzen sind. Diese Anforderungen spiegeln sich auch in dem OPS Code für ernährungsmedizinische Komplexbehandlung wider (OPS Code 8-98j, OPS Version 2025), für dessen Codierung die werktägliche Verfügbarkeit eines Ernährungsteams bestehend aus mind. einer Fachärzt:in mit curricularer Weiterbildung oder Zusatzbezeichnung Ernährungsmedizin sowie einer Ernährungsfachkraft erforderlich ist. In unserem Haus wird der Bereich Prähabilitation daher durch eine Stabsstelle Ernährungsmedizin betreut. Als Minimalausstattung ist in den Kliniken jedoch eine konsiliarische ernährungsmedizinische Mitbetreuung anzustreben.
Screening
Nicht alle Patienten bedürfen einer Prähabilitation. Um jedoch jene sicher zu identifizieren, die davon profitieren könnten, sollten alle Patient:innen vor größeren chirurgischen Eingriffen ein Screening durchlaufen, in dem mindestens der Ernährungszustand analysiert, das Vorliegen einer Sarkopenie untersucht wird, sowie eine Anämiediagnostik erfolgt.
Alter und Körpergewicht alleine sind hierfür unzureichend. So gibt es betagte Patient:innen, die weder mangelernährt noch gebrechlich oder sarkopen sind, während derartige Mangelzustände auch bei Jüngeren oder Übergewichtigen vorliegen können (sog. sarcopenic obesity).
Mangelernährung
Sowohl Inzidenz als auch klinische Bedeutung von Mangelernährung werden oft unterschätzt. Etwa 25–30 % aller hospitalisierten Patient:innen und mehr als die Hälfte der onkologischen Patient:innen in Deutschland sind mangelernährt [10]. Zudem ist Mangelernährung nicht zwangsläufig gleichbedeutend mit Untergewicht, auch übergewichtige Patient:innen können mangelernährt sein.
Zum Nachweis der krankheitsspezifischen Mangelernährung (Info 1) [11] eignet sich das Nutritional Risk Screening, NRS 2002 (Tab. 1), das bereits beim Erstkontakt mit dem Patienten erhoben werden sollte und mit nur einem geringen Zeitaufwand verbunden ist [12].
Info 1: Definition krankheitsspezifische Mangelernährung [11]
Body-Mass-Index (BMI) < 18,5 kg/m2
oder
unbeabsichtigter Gewichtsverlust > 10 % in den letzten 3–6 Monaten
oder
Body-Mass-Index (BMI) < 20 kg/m2 und unbeabsichtigter Gewichtsverlust > 5 %
in den letzten 3–6 Monaten
Tab. 1: Nutritional Risk Screening [12]
|
Vorscreening
|
|
BMI < 20,5 kg/m2?
|
ja
|
nein
|
|
Gewichtsverlust in den letzten drei Monaten?
|
ja
|
nein
|
|
Während der letzten Woche weniger gegessen als normal?
|
ja
|
nein
|
|
leidet der Patient an einer schweren Erkrankung?
|
ja
|
nein
|
|
Wird eine Frage mit ja beantwortet, muss auch das Hauptscreening durchgeführt werden
|
|
|
|
|
Hauptscreening
|
|
Verschlechterung des Ernährungszustandes
|
Punkte
|
|
Keine Verschlechterung
|
0
|
|
Grad 1 (leicht): Gewichtsverlust > 5 % in drei Monaten oder während der letzten Woche weniger gegessen (50-75 %)
|
1
|
|
Grad 2 (mäßig): Gewichtsverlust > 5 % in zwei Monaten oder BMI 18,5-20,5 + reduzierter AZ oder während der letzten Woche weniger als die Hälfte gegessen (25-50 %)
|
2
|
|
Grad 3 (schwer): Gewichtsverlust > 5 % in einem Monat (> 15 %/3 Mo.) oder BMI < 18,5 + reduzierter AZ oder während der letzten Woche sehr wenig gegessen (< 25 %)
|
3
|
|
Schwere der Erkrankung
|
|
|
normaler, gesunder Patient
|
0
|
|
Grad 1 (leicht): z. B. hüftnahe Fraktur, Zirrhose, COPD, Hämodialyse, Tumorerkrankung
|
1
|
|
Grad 2 (mäßig): z. B. große abdominelle OP, Pneumonie, Chemotherapie, hämatologische Tumorerkrankung
|
2
|
|
Grad 3 (schwer): z. B. Schädel-Hirn-Trauma, Polytrauma, Verbrennung, Intensivpatient (APACHE<10)
|
3
|
|
|
|
Lebensalter > 70 Jahre
|
1
|
|
Gesamt
|
0-7
|
|
|
|
Gesamtpunktzahl ≥3: Mangelernährung oder hohes Risiko für Mangelernährung
Ernährungsmedizinisches Assessment und Ernährungstherapie erforderlich
|
|
Info 2: Definition metabolisches Risiko [13]; ein hohes metabolisches Risiko besteht, wenn mind. 1 Kriterium erfüllt ist. SGA: Subjective Global Assessment.
BMI < 18,5kg/m2
oder
Gewichtsverlust > 10–15 % innerhalb von 6 Monaten
oder
Serumalbumin < 30 g/l (Ausschluss Leber und/oder Nierenerkrankung) oder
SGA Grad C
oder
NRS ≥ 5
Dabei kann die Erhebung am einfachsten sichergestellt werden, wenn das NRS im jeweiligen Krankenhausinformationssystem zu einem Pflichtfeld gemacht wird.
Neben dem NRS kann die Bestimmung der Serumalbuminkonzentration im präoperativen Routinelabor einen weiteren Hinweis auf das Vorliegen eines hohen metabolischen Risikos geben (Info-Box 2) [13]. So ist eine Albuminkonzentration im Serum von < 30 g/L ein unabhängiger Prädiktor für postoperative Komplikationen [13, 14].
Bei Vorliegen einer Mangelernährung bzw. eines erhöhten metabolischen Risikos richtet sich das weitere Vorgehen nach dem Ausmaß des Defizits, der Dringlichkeit der Operation und evtl. vorhandener, weiterer Komorbiditäten. Die Abstimmung sollte interdisziplinär zwischen Chirurg:innen und Ernährungsmediziner:innen erfolgen.
Am häufigsten liegt eine leichtgradige Mangelernährung vor, für die sich eine präoperative Ernährungsberatung in Verbindung mit häuslicher Proteinsupplementierung mit Eiweißpulver oder hochkalorischer Trinknahrung für 1–2 Wochen bewährt hat. Bei Diabetikern und Patient:innen mit bereits präoperativ gestörter Glukosetoleranz, sollten Ernährungstherapie und ggfs. antidiabetische Medikation engmaschig überwacht und im Bedarfsfall angepasst werden. In unserer Klinik erfolgt diese Begleitung wöchentlich in der Tagesklinik.
Ausgeprägte Mangelernährung, Schluckstörungen oder ein Passagehindernis im GI-Trakt können hingegen eine stationäre Behandlung mit parenteraler Ernährung vor der Operation erforderlich machen. Bei hochgradiger oder rasch fortschreitender Mangelernährung ist zudem eine langsame, kontrollierte Kaloriensteigerung sowie die bedarfsorientierte Substitution von Mikronährstoffen angezeigt, um das Risiko eines sog. Refeeding Syndroms mit potentiell lebensbedrohlichen Elektrolyt- und Flüssigkeitsverschiebungen zu minimieren [13].
Sarkopenie
Ein weiterer wichtiger und leicht messbarer Indikator ist die Sarkopenie, die als Verlust von Muskelmasse und -kraft sowie damit einhergehenden funktionellen Einschränkungen definiert ist [15].
In der onkologischen Viszeralchirurgie hat sich zur Bestimmung der Sarkopenie der Total Psoas Index (TPI) etabliert [16]. Der TPI setzt die beidseitige Fläche des M. psoas auf Höhe von LWK 3 ins Verhältnis zur Körpergröße (Info-Box 3).
Da vor einer größeren Operation in der Regel eine Computertomographie des Abdomens zur Diagnostik erfolgt, lässt sich in dieser Untersuchung das Vorliegen einer Sarkopenie in wenigen Minuten über den TPI detektieren (Abb. 4). Der TPI kann auch in extern durchgeführten CTs ermittelt werden.
Patienten mit Sarkopenie profitieren von einer präoperativen Bewegungs- und Sporttherapie, die individuell angepasst von Spazierengehen bis hin zu Krafttraining im Fitnessstudio reichen kann [6].
Eine ausführliche Aufklärung zur präoperativen körperlichen Aktivität sowie Informationsmaterialien mit Übungen für zu Hause unterstützen die Anleitung. Die Therapieadhärenz, aber auch der Erfolg der Intervention lassen sich durch digitale Bewegungsmessung (z. B. Schrittzähler), vor allem aber durch regelmäßiges Üben unter professioneller Anleitung erhöhen [17, 18].
Anämie
Eine Anämie (Hämoglobinkonzentration im Serum bei Männern < 13 g/dl; bei Frauen < 12 g/dl) ist ein unabhängiger Risikofaktor für postoperative Morbidität, Mortalität und längere Krankenhausverweildauer [19]. Perioperative Transfusionen sind bei malignen Erkrankungen sogar mit schlechterer Prognose und erhöhtem Metastasierungsrisiko assoziiert [20].
Info 3: Total Psoas Index (TPI) als ein Maß für Sarkopenie [16].
TPA: total psoas area: beidseitige Fläche des M. psoas auf Höhe LWK 3 in mm2.
Normalwerte: Frauen: > 385 mm2/m2, Männer: > 545mm2/m2.

Nach § 4.2 der Richtlinie Hämotherapie der Bundesärztekammer ist zu prüfen, ob auch andere Maßnahmen als Transfusionen geeignet sind, chronische oder akute Mangelzustände zu beheben. Daher soll im Sinne des Patient-Blood-Management präoperativ so früh als möglich eine Anämieabklärung und, sofern möglich, auch eine Therapie erfolgen [21].
Da bis zu einem Drittel der Anämien viszeralonkologischer Patient:innen durch Eisenmangel bedingt sind, sollte beim Nachweis einer Anämie grundsätzlich der Eisenstatus (Eisen, Ferritin, Transferrinsättigung) erhoben werden. Bei Eisenmangelanämie besteht die Indikation zur präoperativen Eisensubstitution. Idealerweise erfolgt diese intravenös, um eine rasche, präoperative Stabilisierung des Hb zu erreichen.
Die damit verbundene Reduktion des Transfusionsrisikos ist sowohl medizinisch als auch aus Gründen der Kosteneffizienz zu begrüßen. Gleichzeitig kann die Unterlassung des sog. Patient-Blood-Management einen Behandlungsfehler darstellen und dadurch potentiell haftungsrelevant sein [22].
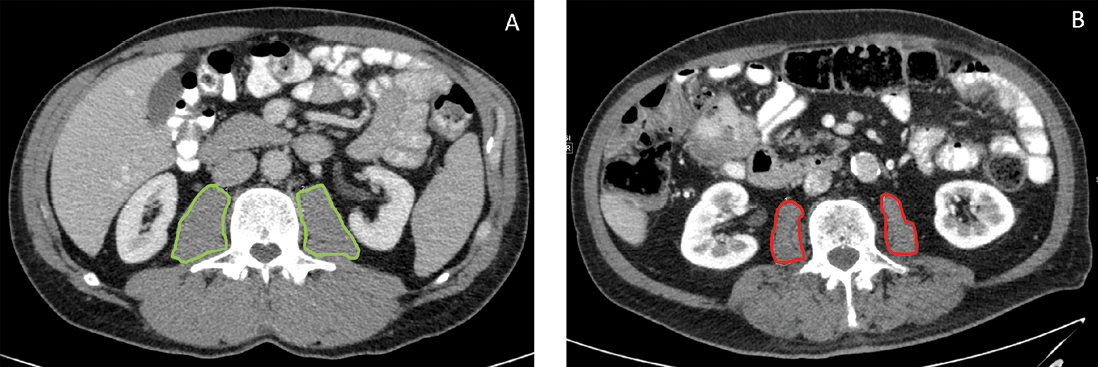
Abb. 1: TPI-Messung im CT. A: Patient ohne Sarkopenie mit normalem TPI. B: Sarkopener Patient mit erniedrigtem TPI
Praktisches Vorgehen
In unserer Klinik werden alle Patient:innen bei der Erstvorstellung vor onkologischen Operationen sowie vor anderen größeren chirurgischen Eingriffen auf Mangelernährung, Sarkopenie und Anämie gescreent. Die Erhebung von NRS und TPI erfolgt dabei mit sehr geringem zeitlichem Aufwand. Das Anämiescreening und die Bestimmung des Serumalbumins erfolgen im Rahmen des Routinelabors und verursachen somit keine relevanten Zusatzkosten.
Beim Vorliegen eines der genannten Risikofaktoren erfolgt die Vorstellung der Patient:innen in unserer Stabstelle für Ernährungsmedizin zum weiteren Assessment. Anschließend wird interdisziplinär über notwendige Prähabilitationsmaßnahmen und die dafür erforderliche Behandlungsdauer entschieden.
Bei Patient:innen, die eine neoadjuvante Therapie vor der Operation benötigen, erfolgt die Betreuung bereits während der Neoadjuvanz und wird bis zur Operation fortgeführt.
Im Gegensatz dazu stehen Risikopatienten, bei denen keine neoadjuvante Therapie geplant ist, mitunter einer Prähabilitation zunächst ablehnend gegenüber, meist aus Sorge um einen onkologischen Nachteil durch den Aufschub der Operation. Die Mehrzahl der Patient:innen lässt sich jedoch durch eine ausführliche Aufklärung von den Vorteilen der Prähabilitation überzeugen.
Während das Screening durch die Chirurg:innen erfolgt, werden die Patient:innen in der Prähabilitationsphase in enger Absprache mit den Chirurg:innen vollständig von den Ernährungsmediziner:innen betreut – entweder konsiliarisch oder in einem multimodalen Programm in der Tagesklinik.
Zusammenfassung
Prähabilitation ermöglicht bei viszeralchirurgischen Risikopatient:innen eine Reduktion der perioperativen Risiken. Prähabilitation bedarf Zeit und die positiven Effekte der Prähabilitation sind umso größer, je länger die Maßnahmen erfolgen. Um ausreichend Zeit für die erforderlichen Interventionen zu haben, sollte das Screening so früh wie möglich, am besten bei der Erstvorstellung, erfolgen.
Im klinischen Alltag haben sich Mangelernährung, Sarkopenie und Anämie als Risikofaktoren etabliert, die nicht nur mit geringem Zeit- und Kostenaufwand erhoben werden können, sondern auch ideale Angriffspunkte für prähabilitative Maßnahmen bieten.
Bei den meisten Patienten kann eine deutliche Verbesserung der Mangelzustände bereits nach wenigen Wochen erreicht werden. Diese Zeit sollte man auch investieren, zumal gezeigt werden konnte, dass eine onkologische Operation um bis zu 3–6 Wochen verschoben werden kann, ohne dass hieraus ein Nachteil in Bezug auf die Prognose erwächst [23].
Nicht zu unterschätzen ist auch der psychologische Effekt der Prähabilitation: So bietet die präoperative Vorbereitung motivierten Patient:innen die Möglichkeit, ihren Krankheitsverlauf aktiv zu beeinflussen. Dabei konnten wir beobachten, dass sich auch die Einbindung der Angehörigen positiv auf die Therapieadhärenz insbesondere bei der körperlichen Aktivität und der Umsetzung der Ernährungsempfehlungen auswirkt.
Prähabilitation erscheint auf dem ersten Blick als Banalität hat sich aber zu einem der wichtigsten Faktoren der multimodalen Behandlung vor großen viszeralchirurgischen Operationen entwickelt. So muss man – politisch inkorrekt aber dennoch treffend formuliert – fordern: „Prehabilitation first“.
Literatur
[1] Studley HO. Percentage of weight loss: basic indicator of surgical risk in patients with chronic peptic ulcer. JAMA 1936;106:458-460.
[2] Lobo DN, Gianotti L, Adiamah A, et al. Perioperative nutrition: Recommendations from the ESPEN expert group. Clinical Nutrition 2020;39:3211-3227.
[3] Ryan AM, Power DG, Daly L, et al., Cancer-Associated Malnutrition, Cachexia and Sarcopenia: The Skeleton in the Hospital Closet 40 Years Later. Proc Nutr Soc 2016;75:199-211. doi: 10.1017/S002966511500419X.
[4] Daniels, S L, Lee MJ, George J et al. Prehabilitation in Elective Abdominal Cancer Surgery in Older Patients: Systematic Review and Meta-Analysis. BJS Open 2020;4:1022-1041. doi: 10.1002/bjs5.50347
[5] McIsaac DI, Prehabilitation in adult patients undergoing surgery: an umbrella review of systematic reviews. Br J Anaesth 2022;128:244-257doi: 10.1016/j.bja.2021.11.014
[6] Waterland JL, McCourt O, Edbrooke L, et al. Efficacy of Prehabilitation Including Exercise on Postoperative Outcomes Following Abdominal Cancer Surgery: A Systematic Review and Meta-Analysis. Front. Surg. 2021;8:628848. doi: 10.3389/fsurg.2021.628848
[7] Berardi G, Cucchetti A, Colasanti M, et al. Prehabilitation With Exercise and Nutrition to Reduce Morbidity of Major Hepatectomy in Patients With Sarcopenia The PREHEP Randomized Clinical Trial. JAMA Surg. 2025;160:1068-1075. doi: 10.1001/jamasurg.2025.3102.
[8] Molenaar CJL, Minnella EM, Coca-Martinez M, et al. Effect of Multimodal Prehabilitation on Reducing Postoperative Complications and Enhancing Functional Capacity Following Colorectal Cancer Surgery: The PREHAB Randomized Clinical Trial. JAMA Surg. 2023;158:572-581. doi: 10.1001/jamasurg.2023.0198.
[9] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Perioperatives Management bei gastrointestinalen Tumoren (POMGAT), Langversion 1.0, 2023, AWMF-Registernummer: 088-010OL https://www.leitlinienprogramm-onkologie.de/leitlinien/perioperatives-management-bei-gastrointestinalen-tumoren-pomgat/; Zugriff am 28.11.2025
[10] Pirlich M, Schütz T, Norman K, et al. The German hospital malnutrition study. Clin Nutr. 2006;25:563-72. doi: 10.1016/j.clnu.2006.03.005. Epub 2006 May 15.
[11] Cederholm T, Barazzoni R, Austin P et al. ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr. 2017;36:49-64. doi: 10.1016/j.clnu.2016.09.004.
[12] Kondrup J, Rasmussen HH, Hamberg O et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003;22:321-36. doi: 10.1016/s0261-5614(02)00214-5.
[13] Loftus TJ, Brown MP, Slish JH et al. Serum Levels of Prealbumin and Albumin for Preoperative Risk Stratification. Nutr Clin Pract. 2019;34:340-348. doi: 10.1002/ncp.10271.
[14] Weimann A, Bezmarevic M, Braga M, et al. ESPEN guideline on clinical nutrition in surgery – Update 2025. Clin Nutr. 2025;53:222-261. doi: 10.1016/j.clnu.2025.08.029.
[15] Spira, D, Norman K, Nikolov J et al. Prevalence and Definition of Sarcopenia in Community Dwelling Older People: Data from the Berlin Aging Study II (BASE-II). Z Gerontol Geriatr. 2016;49:94-9. doi: 10.1007/s00391-015-0886-z.
[16] Richards SJG, Sajith C. Senadeera SC, Frizelle FA. Sarcopenia, as Assessed by Psoas Cross-Sectional Area, Is Predictive of Adverse Postoperative Outcomes in Patients Undergoing Colorectal Cancer Surgery. Dis Colon Rectum 2020;63:807-815. doi: 10.1097/DCR.0000000000001633.
[17] Amélie Cambriel A, Tsai A, Choisy B, et al. Immune Modulation by Personalized vs Standard Prehabilitation Before Major Surgery. A Randomized Clinical Trial. JAMA Surg. 2025;12:e254917. doi: 10.1001/jamasurg.2025.4917.
[18] Boden I, Skinner EH, Browning L, et al. Preoperative physiotherapy for the prevention of respiratory complications after upper abdominal surgery: pragmatic, double blinded, multicentre randomised controlled trial. BMJ 2018;24:360:j5916. doi: 10.1136/bmj.j5916.
[19] Baron DM, Hochrieser H, Posch M et al. Preoperative anaemia is associated with poor clinical outcome in non-cardiac surgery patients. Br J Anaesth. 2014;113:416-23. doi: 10.1093/bja/aeu098.
[20] Tai YH, Wu HL, Mandell MS et al. The association of allogeneic blood transfusion and the recurrence of hepatic cancer after surgical resection. Anaesthesia 2020;75:464-471 doi: 10.1111/anae.14862.
[21] Richtlinie zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Richtlinie Hämotherapie) https://www.wbbaek.de/richtlinien-leitlinien/haemotherapie-transfusionsmedizin/richtlinie/ Zugriff am 07.12.2025
[22] Ärzteblatt, Deutscher Ärzteverlag GmbH, Redaktion Deutsches. „Neue Behandlungsmodelle: Patient Blood Management“. Deutsches Ärzteblatt, 30. April 2021. https://www.aerzteblatt.de/archiv/218906/Neue-Behandlungsmodelle-Patient-Blood-Management.
[23] Kucejko RJ, Holleran TJ, Stein DE.et al. How Soon Should Patients With Colon Cancer Undergo Definitive Resection? Dis Colon Rectum 2020;63:172–182 doi: 10.1097/DCR.0000000000001525

Korrespondierende Autorin: Prof. Dr. med. Natascha Nüssler
Klinik für Allgemein-, Viszeralchirurgie und Koloproktologie
München Klinik Neuperlach
natascha.nuessler@muenchen-klinik.de

Dr. med. Eva-Maria Jacob
Stabsstelle Ernährungsmedizin
München Klinik Neuperlach
Chirurgie
Nüssler N, Jacob EM: Prähabilitation – vom theoretischen Ideal zur praktischen Umsetzung. Passion Chirurgie.
2026 Januar/Februar; 16(01/02):
Artikel 03_03.
www.bdc.de