PRAXISCHECK: WIE KOMPETENZBASIERTE WEITERBILDUNG ENTSTAND UND IN ANDEREN LÄNDERN GEHANDHABT WIRD.
Die Qualität der chirurgischen Weiterbildung stellt grundsätzlich einen wesentlichen Faktor für die die Patientensicherheit dar [1–4]. Auch in Deutschland wird das Thema aktuell wieder diskutiert. Der Deutsche Ärztetag hat bereits 2007 eine Weiterbildungsreform für Deutschland beschlossen. Anders als bei den bisherigen Reformen sollte es hier jedoch nicht nur zu einer Anpassung der bisherigen Weiterbildungskataloge, sondern auch zu einer Änderung der Struktur hin zu kompetenzbasierten Inhalten kommen. Das wirft bei vielen erfahrenen KollegInnen die Frage auf, warum so etwas nötig ist, wenn die bisherige Weiterbildung sie doch zu den FachärztInnen gemacht hat, die heute eine gute Versorgung gewährleisten. Die umfangreichen Veränderungen des Gesundheitssystems in den letzten Jahrzehnten wirken sich jedoch auch auf die Weiterbildung aus. So beeinflussen der nicht abnehmende Kostendruck der Kliniken, die Begrenzung der Arbeitszeit durch das Arbeitszeitschutzgesetz, der stetig ansteigende Administrationsaufwand, die Erwartungen der jüngeren Generationen an eine ausgewogenere Work-Life-Balance und der relative Ärztemangel nicht nur den Klinikalltag, sondern ganz zwangsläufig auch die Weiterbildung der nachfolgenden Ärztegenerationen [5–9]. Innerhalb der letzten Jahre sind wesentliche Defizite der bisherigen Weiterbildung evident und durch Umfragen und Verbandsarbeit Teil der öffentlichen Diskussion geworden [9, 10].
Mittlerweile verhandeln die Landesärztekammern aber mittlerweile bereits detailliert über die neuen Musterweiterbildungsordnungen. Sobald dieser Prozess abgeschlossen ist, werden die neuen Verordnungen mit entsprechend angepassten Weiterbildungsordnungen und Logbüchern in den jeweiligen Landesbezirken Gültigkeit erlangen.
|
Vorwort
Liebe Kolleginnen und Kollegen,
das Thema „Weiterbildung in der Chirurgie“ ist seit Jahren ein Dauerbrenner. Viele haben dazu Ideen, manche reformatorischen Eifer, aber alle, wirklich alle haben dazu eine Meinung. Unstrittig ist, das Lehre und Ausbildung sich grundsätzlich und fortwährend an aktuelle Entwicklungen anpassen müssen. Doch wie man Neues begrüßt, und Bewährtes nicht vergisst, bleibt heiß umkämpft. Die neue Weiterbildungsordnung (WO) stellt in diesem Kontext eine kleine Revolution dar. Kompetenzen erwerben, statt Operationen zu zählen ist das neue Motto, doch daran scheiden sich immer noch die Geister. Ma tempi passati – die Weiterbildungsordnung ist beschlossen, da kann man nicht mehr dran rütteln. Grund genug sich mit dem Thema der kompetenzbasierten WO genauer zu beschäftigen. Denn die Umsetzung in der Praxis, d. h. also in jedem unserer Krankenhäuser, wird über Erfolg und Misserfolg entscheiden. Das Thema geht uns alle an!
Spannende, erhellende Lektüre wünschen
Prof. Dr. med. C. J. Krones und Prof. Dr. med. D. Vallböhmer
|
Bekannt ist schon jetzt, dass die neue Weiterbildungsordnung eine kompetenzbasierte Struktur erhalten wird. Doch entgegen der allgemeinen Annahme, dass anstelle der tradierten „Operations-Zahlen“ nun nur noch „Kompetenzen in Operationen“ bescheinigt werden, handelt es sich bei kompetenzbasierter Weiterbildung um weitaus mehr. Denn eine kompetenzbasierte Weiterbildung richtet sich auch nach klar definierten Werten, die strukturiert vermittelt, geübt und kontrolliert werden. Diese Werte basieren auf den Anforderungen für ein patientenorientiertes Gesundheitssystem. Ziel dieser Struktur ist es aber nicht nur zu wissen, was AssistenzärztInnen bis zur Facharztprüfung geleistet haben, sondern was sie tatsächlich können, um damit eine sichere und gute medizinische Versorgung der Gesellschaft in der Zukunft zu gewährleisten.
Um dieses Konzept der kompetenzbasierten Weiterbildung besser zu verstehen ist es hilfreich die Ursprünge, die Hintergründe und die Entstehungsgeschichte dieser Lehr- und Lernstruktur zu betrachten. Dazu lohnt ein Blick über die Grenzen, denn in vielen anderen Ländern wird eine kompetenzbasierte Weiterbildung schon seit Jahren gelebt.
Ursprung der kompetenzbasierten Weiterbildung
Bevor die Chirurgie ein Teil der medizinischen Profession wurde, wurden chirurgische Eingriffe von Barbieren durchgeführt [11]. Die Vermittlung der chirurgischen Kunst verlief dabei ähnlich einer Handwerkslehre: Die jungen ÄrztInnen begleiten ihre „MeisterInnen“, um sie bei ihrer „Kunst“ – der Chirurgie – zu beobachten. Im nächsten Schritt assistierten sie, um schließlich in der Folge mehr und mehr Eingriffe selbstständig durchzuführen. Das bekannte Zitat „See one, do one, teach one“ beschreibt verkürzt diese tradierte Vermittlung chirurgischer Fähigkeiten im Rahmen einer allein auf Erfahrung und Zeit basierten Weiterbildung.
Die Herausforderungen an ChirurgInnen haben sich im letzten Jahrhundert jedoch stark gewandelt. Durch die Globalisierung, den zunehmenden Wohlstand und die schnelle und ungefilterte Menge an Informationsmöglichkeiten durch das Internet sind die Ansprüche der PatientInnen an Gesundheit gestiegen, und auch das Patientengut hat sich stark gewandelt [12–17]. Bereits Anfang der 1990er proklamierten ÄrztInnen in Kanada ihre Besorgnis über diesen Wandel, und kritisierten insbesondere die fehlende Anpassung des medizinischen Weiterbildungssystems an die sich ändernden Rahmenbedingungen. Zusätzlich wurden im späten 20. Jahrhundert Stimmen laut, die mehr PatientInnensicherheit in der Chirurgie forderten [18–20]. Das Fehlen eines unabhängigen Bewertungssystems und einer fundierten Qualitätssicherung wurden angeprangert. Durch die veränderten Ansprüche sahen ÄrztInnen außerdem ihre berufliche Selbstregulierung bedroht [19]. Daraus ergab sich der Wunsch, Initiativen zur Reform der chirurgischen Weiterbildung zu entwickeln [18].
So war Kanada das erste Land, welches ein neues, kompetenzbasiertes Curriculum und damit eine grundsätzliche Umstrukturierung der Weiterbildung einführte. Der grundlegende Unterschied war die Abkehr von einem System, das sich auf den Lehrprozess konzentrierte, hin zu einem System, das sich auf das Ergebnis und damit auf die Bedürfnisse und Wünsche der EmpfängerInnen – im chirurgischen Kontext also der PatientInnen – konzentrierte [21].
In Kanada wurde dazu ein Ausschuss von ÄrztInnen gebildet, der sich durch Beratung von ExpertInnen, Gesundheitsorganisationen, systematischen Literaturrecherchen und Patientenfokusgruppen aufwändig mit gesellschaftlichen Nachfragen und Bedürfnissen auseinandersetzte. Basierend auf den Ergebnissen wurden danach neue Ziele für das ärztliche Handeln definiert. Heute ist dies als CanMEDS-Framework bekannt [22]. Die hier definierten Werte und Standards (entsprechend den CanMEDS-Rollen) bilden bis heute die Grundlage und die Standards für die kompetenzbasierte Weiterbildung in vielen Ländern.
Frank und Danoff (2007) fassen die kompetenzbasierte Weiterbildung so zusammen: „Man beginne mit dem Ziel im Sinn und konzentriere sich auf die Kompetenzen, die von den AbsolventInnen der medizinischen Weiterbildung benötigt werden, um die Bedürfnisse derer, denen sie dienen, zu erfüllen und die im Gesundheitswesen gewünschten Ergebnisse zu erzielen“ [23].
Das CanMEDS framework
Kompetenzbasierte Weiterbildung basiert auf Informationen, Bedürfnissen und Erwartungen von PatientInnen an ihre ÄrztInnen. Die auf Basis dieser Erkenntnisse definierten Werte und Standards bilden die Grundlage für messbare Ergebnisse und Lernziele.
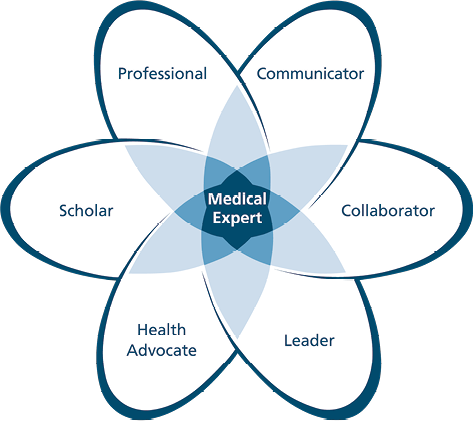
Abb. 1: Die ärztlichen Rollen des CanMEDS framework (mit freundlicher Genehmigung des Royal College of Physicians and Surgeons of Canada).
Das CanMEDS framework [22] definiert sieben Rollen, die ÄrztInnen erfüllen sollten.
- Kommunikator: Befähigung, die Symptome und Bedürfnisse der PatientInnen zu erurieren, um die Grundlage für eine gemeinsame Entscheidungsfindung („shared decision making“) und eine patientenzentrierte Versorgung zu schaffen.
- Kollaborator: Sicherstellung, dass die Gesundheitsberufe gemeinsam für eine sichere, qualitativ hochwertige, patientenzentrierte Versorgung arbeiten.
- Führungskraft: Verantwortung, die notwendigen Bedingungen und Visionen zu schaffen, um eine wertvolle PatientInnenversorgung gewährleisten zu können: in der Klinik, Administration und Lehre.
- Gesundheitsfürsprecher: Engagement für die Verbesserung der Gesundheit von PatientInnen und Gesellschaft; Förderung von Prävention, Gesundheit und Qualitätsverbesserung.
- Lehrender und Lernender: Verpflichtung zu kontinuierlichem eigenen Lernen und Weiterbildung von anderen, sowie Sichern und Evaluieren von medizinischer Evidenz.
- Professionalität: Sicherstellung von ethischer klinischer Praxis, hohen Standards im persönlichen Verhalten und Würde gegenüber dem ärztlichen Beruf und der Gesellschaft.
- Medizinischer/e Experte/in: Verknüpfung der oben definierten Rollen, Nutzung des Wissens, der klinischen Fähigkeiten und Werte, um eine sichere, qualitativ hochwertige patientenzentrierte Versorgung für PatientInnen und die Gesellschaft insgesamt zu gewährleisten.
Von der Theorie zur Praxis
Die Definition neuer Werte und Ziele allein führte allerdings natürlich nicht zu einer spürbaren Veränderung in eine ergebnisorientierte chirurgische Weiterbildung im klinischen Alltag. Um die Umsetzung sicherzustellen, mussten neue Methoden und Formen der Fakultätsentwicklung, der Akkreditierung von Weiterbildungsprogrammen sowie neue Lehrpläne, Weiterbildungsressourcen und Qualitätskontrollen eingeführt werden [24]. Als Konsequenz wurde in vielen Ländern das System der Weiterbildung, die Kriterien der Weiterbildungsbefugnis für Krankenhäuser und ÄrztInnen und die genutzten Ressourcen zum Wissenstransfer angepasst (Abbildung 2). Die neu definierten Werte und die starke Orientierung am Ergebnis spiegelten sich dabei in jeder Anpassung des Systems wider. So orientierte sich die Weiterbildungsbefugnis nun nicht mehr ausschließlich an den Operationszahlen oder der Größe des Krankenhauses, sondern auf die Durchführung, die erreichten Ergebnisse und die Qualität der Weiterbildung. Einen großen Anteil der Systemveränderung machte dabei die kontinuierliche Qualitätskontrolle und -verbesserung der Weiterbildung aus, die auch die Überprüfung der Weiterzubildenden und der Weiterbildenden beinhaltete. Eine Ausbildung der Weiterbildenden, die regelmäßige Evaluation des Lernfortschritts des Weiterzubildenden und die Qualitätsprüfung der Weiterbildung sind essentieller Teil des Systems einer kompetenzbasierten Weiterbildung.
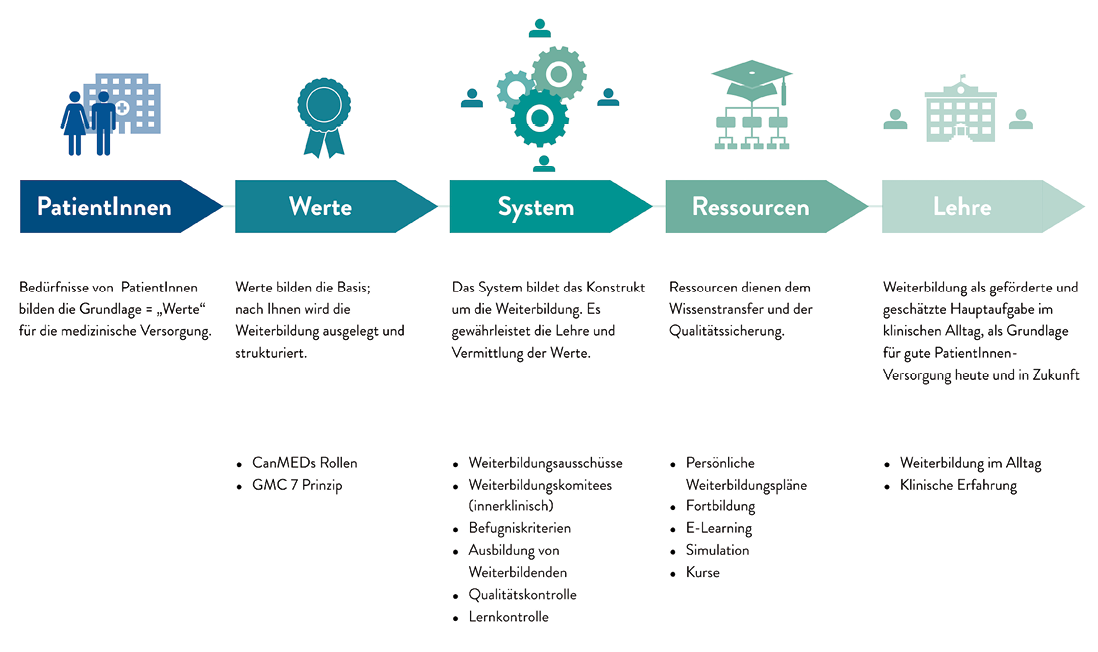
Abb. 2: Grundlagen der kompetenzbasierten Weiterbildung und Beispiele zum Praxisbezug
Neben der Systemanpassung machten die Länder auch Ressourcen verfügbar, um den Transfer von definierten Wissenszielen in die Praxis zu erreichen. Hierunter fallen Weiterbildungspläne, die individuell gemeinsam mit dem Weiterbildenden festgelegt werden, und eine geregelte Fortbildung, welche definierte Lernziele, Kurse und Simulationen beinhaltet. Auch diese Maßnahmen folgen dem Ziel die Endergebnisse der Weiterbildung zu verbessern, und zeitgleich eine optimale Patientenversorgung zu bieten.
Ein Teil der kompetenzbasierten Weiterbildung bleibt wie früher auch die persönliche Weiterbildung in der Klinik und am Operationstisch. Diese erreicht jedoch durch die vorstehende Struktur mehr Unterstützung, klarer definierte, detailliertere Ziele, transparentere Verantwortlichkeit und am Ende auch mehr Wert, sowohl für die Weiterzubildenden als auch für die Weiterbildendenden.
Die Grundannahmen der kompetenzbasierten Weiterbildung stehen in enger Abhängigkeit zueinander. Veränderungen in einem Einzelbereich, machen meist Anpassungen in einem anderen Bereich notwendig, ohne die eine Verbesserung des Gesamtprozesses ergebnislos verläuft. Zum Beispiel verlangt die Verbesserung der Weiterbilder-Weiterzubildender-Beziehung auch Maßnahmen in der Ausbildung des Weiterbildenden, die wiederum von den bereitgestellten Ressourcen abhängen. Die Grundlagen bilden also ein interdependentes Netzwerk. Der Wechsel von der „Lehrlingsausbildung“ hin zu einer ergebnisorientierten Weiterbildung ist somit ein echter Wandel in der chirurgischen Weiterbildung.
Was ist eine Kompetenz
Viele Länder haben die CanMEDs-Rollen leicht modifiziert übernommen. Dazu gehören z.B. Australien, Neuseeland, die Niederlande, die Schweiz und auch Norwegen. Andere Länder definieren eigene Werte, die sich in den Grundzügen aber stark ähneln (Großbritannien, USA). Eine Kompetenz bezieht sich dabei immer auf eine klinische ärztliche Aufgabe und die Erfüllung von definierten Zielen in Verhalten, Wissen und Fähigkeiten. Die Ziele in Verhalten, Wissen und Fähigkeiten spiegeln die Anforderungen der Werte wider (Abbildung 2). Viele Länder (Kanada, Niederlande, Großbritannien, Neuseeland, Australien, Schweiz) haben eine Einzel-Kompetenz als „Entrusted Professional Acitivity“ (EPA) definiert. Eine EPA entspricht einem ärztlichen Handlungsbereich, den man einem Arzt bzw. einer Ärztin anvertrauen kann, sobald er/sie in diesem Bereich eine ausreichende Kompetenz bewiesen hat. Die Kompetenz für diesen Handlungsbereich beschreibt bezogen auf die Werte der Weiterbildung Erreichtes in Verhalten, Wissen und Fähigkeiten. So ist z.B. in Kanada für die „EPA: Behandlung von Radiusfrakturen“ neben der chirurgischen Durchführung der Operation auch die Aufklärung über die Operation und ihre Behandlungsalternativen (CanMEDs-Rolle: Kommunikator), die Durchführung der WHO-Checkliste in Zusammenarbeit mit der Anästhesie (CanMEDs-Rolle: Kollaborateur) und die Übernahme der Verantwortung (CanMEDs-Rolle: Führungskraft) als kompetent zu demonstrieren [25].
Bescheinigung von Kompetenzen
In Deutschland wird wiederholt die Sorge diskutiert, dass durch die Bescheinigung eines Weiterzubildenden als „kompetent“ eine rechtliche Haftungssituation für den Weiterbildenden entsteht. Hinsichtlich der Anerkennung dieser Kompetenz zeigen sich international Unterschiede: So werden in Kanada, Großbritannien, Australien und Neuseeland Kompetenzen anhand von kleinen, innerklinischen Zwischenprüfungen – so genannten „Workplace-based Assessments“ (WBPA) attestiert. Durch unterschiedliche Prüfungsmethoden („Direkte Observation einer Procedure“, „Mini-klinische Evaluations Übung“) wird der aktuelle Stand der Weiterbildendung und Kompetenz in einem strukturierten Bewertungsbogens eingeordnet. In diesen Ländern sind minimal zwei WBPAs als „kompetent“ zu bewerten, um die individuelle Kompetenz zu erreichen.
Die Niederlande, Frankreich und Norwegen bestätigen Kompetenzen im Rahmen eines gemeinsamen Beschlusses des klinikinternen Weiterbildungskomitees. Diese Komitees tagen in regelmäßigen Abständen (wöchentlich bis monatlich) und diskutieren den individuellen Lernfortschritt. Im Konsens wird dann eine Kompetenz der Weiterzubildenden beschlossen.
Erfahrungen aus anderen Ländern
Eine weitere Anpassung richtet in den Niederlanden die chirurgische Weiterbildung mittlerweile fast ausschließlich an den oben beschriebenen EPAs aus, die dabei auch zeitgleich absolviert werden können. Neben „Pflicht-EPAs“ wie „Hüfte – Basis“ können die Weiterzubildenden je nach individuellem Fortschritt schon in ihrer Weiterbildungszeit zusätzliche EPAs durchführen. Dadurch ist einerseits bereits eine Spezialisierung in einem Bereich möglich – „Hüfte – Fortgeschritten“ bis zu „Hüfte – Spezialisiert“. Aber auch die EPAs in den Bereichen „Qualitätsverbesserung“ oder „Forschung“ können ausgewählt werden. Diese Struktur soll der Erfahrung, der Lerngeschwindigkeit und dem Ambitionsniveau der einzelnen Weiterzubildenden besser gerecht werden, und die einzelnen Stärken und Schwächen besser einbeziehen [26]. Das Konzept zielt darauf ab, die chirurgische Weiterbildung „so lange wie nötig, aber auch so kurz wie möglich zu halten“ [26]. Durch die klar definierten Ziele steigen Individualität und Transparenz der Kompetenzen.
Großbritannien hat 2003 das elektronische Logbuch eingeführt, in dem zeitnah chirurgische Eingriffe dokumentiert und von dem assistierenden Weiterbildenden bestätigt werden müssen. Die strukturierte Auswertung der Logbucheingriffe hat umfangreiche Daten über die Lernkurven von Weiterzubildenden in der Chirurgie geliefert: Brown et al. (2017) zeigten hiermit, dass die Weiterzubildenden 10 bis 84 (Median 38,9) Operationen an Leistenhernien durchführten bis sie hinreichende „Kompetenz“ erreichten [27]. Abdelrahman et al. (2016) demonstrierten ähnliche Zahlen (11 bis 108 Leistenhernien, Median 41) [28]. Eine erste Expertise bei Hüftendoprothesen wird zwischen 37 und 63 Eingriffen erreicht (Median 51) [29]. Die Vergleiche von Operationszahlen zu Kompetenzen unterstreichen also, dass Lernkurven und damit der Lernerfolg unter Weiterzubildenden individuell stark variieren. Kompetenzbasierte Weiterbildung würdigt dieses Faktum durch den starken Fokus auf das Ergebnis und das Leistungsziel.
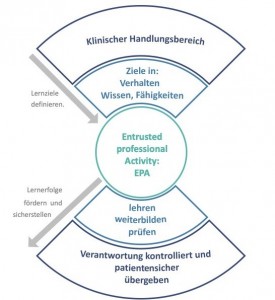
Abb. 3: Kompetenz am Beispiel einer Entrusted Professional Activity.
Kompetenzbasierte Weiterbildung in Deutschland
Es bleibt derzeit abzuwarten, wie die Implementierung der kompetenzbasierten Weiterbildung in Deutschland durch die Landesärztekammern im Detail aussehen wird. Die nachfolgende praktische Umsetzung ist aber mit noch mehr Spannung zu erwarten. Ein Lehrsystem, das sich einerseits aktuell in Kliniken abspielt, die unter finanziellem Druck stehen, und das andererseits gerade „Anfängeroperationen“ immer weiter in den ambulanten Sektor verlegt, in dem die Therapie aber einem Facharztstandard unterliegt, könnte sich mit der Reform schwer zu tun. Das aktuelle System, die Qualitätskontrolle der Weiterbildung aber auch die Unterstützung und Wertschätzung der Weiterzubildenden sind aktuell sehr different zu den Ländern, in denen kompetenzbasierte Weiterbildung praktiziert wird. Die aktuell vorherrschend nur sehr grobe Weiterbildungsstruktur bietet aber andererseits den Raum und eine Chance, um die reichhaltigen Erfahrungen anderer Länder zur inhaltlichen Reform zu nutzen und die Weiterbildung in Deutschland dadurch voranzubringen.
Denn eines sollte uns dabei immer bewusst sein: Der/Die Chirurg/in ist der eine zentrale Faktor bei jeder Patientenbehandlung. Die ChirurgInnen die wir heute weiterbilden sind somit die Schlüsselpersonen der Gesundheitsversorgung von morgen. Die chirurgische Weiterbildung zu verbessern sollte daher ein Hauptziel aller zum Wohle aller sein.
Referenzen
[1] Temple J (2011) Time for Training. A review of the impact of the European Working Time Directive on the quality of training. London: Medical Education England, 2010.
[2] Aitken RJ (2012) Lost opportunity cost of surgical training in the Australian private sector. ANZ Journal of Surgery 82:145–150. https://doi.org/10.1111/j.1445-2197.2011.05968.x
[3] George BC, Bohnen JD, Williams RG, et al (2017) Readiness of US General Surgery Residents for Independent Practice. Ann Surg 266:582–594. https://doi.org/10.1097/SLA.0000000000002414
[4] Mattar SG, Alseidi AA, Jones DB, et al (2013) General surgery residency inadequately prepares trainees for fellowship: results of a survey of fellowship program directors. Ann Surg 258:440–449. https://doi.org/10.1097/SLA.0b013e3182a191ca
[5] Höhl R (2015) Dringende Reform der Weiterbildung nötig. In: AerzteZeitung.de. https://www.aerztezeitung.de/Wirtschaft/Dringende-Reform-der-Weiterbildung-noetig-250061.html Accessed 3 Jul 2020
[6] Klein F (2015) Die internistische Weiterbildung fällt durch. In: AerzteZeitung.de. https://www.aerztezeitung.de/Wirtschaft/Die-internistische-Weiterbildung-faellt-durch-246702.html. Accessed 19 Jul 2020
[7] Ludwig J (2020) Quality of orthopaedic surgical training in Germany: the need for urgent change? University of Oxford
[8] Bündnis Junge Ärzte (2016) Vereinbarkeit von Familie und Karriere – wo bleibt der Wandel in den Köpfen? Der Ophthalmologe 113:639–640. https://doi.org/10.1007/s00347-016-0319-4
[9] Arnold H (2014) Positionspapier des „Bündnis JUNGE ÄRZTE“ zur Arbeitsverdichtung im deutschen Gesundheitssystem. Der Urologe 53:1820–1821. https://doi.org/10.1007/s00120-014-3692-0
[10] Merschin D, Münzberg M, Stange R, et al (2014) Der klinische Alltag in Orthopädie und Unfallchirurgie – Ergebnisse einer nationalen Umfrage unter Assistenzärzten in O und U. Z Orthop Unfall 152:440–445. https://doi.org/10.1055/s-0034-1382869
[11] Thorwald J (1972) Das Jahrhundert der Chirurgen Knaur Taschenbücher. Knaur, Ulm, Germany
[12] Murray TJ (1995) Medical education and society. CMAJ 153:1433–1436
[13] Kizer KW (2001) Establishing Health Care Performance Standards in an Era of Consumerism. JAMA 286:1213–1217. https://doi.org/10.1001/jama.286.10.1213
[14] Spencer J, Jordan R (2001) Educational outcomes and leadership to meet the needs of modern health care. Qual Health Care 10:ii38–ii45. https://doi.org/10.1136/qhc.0100038..
[15] Lewis F (2001) Costs, Competence, and Consumerism: Challenges to Medicine in the New Millennium. The Journal of Trauma: Injury, Infection, and Critical Care 50:185–194
[16] Lanier DC, Roland M, Burstin H, Knottnerus JA (2003) Doctor performance and public accountability. The Lancet 362:1404–1408. https://doi.org/10.1016/S0140-6736(03)14638-7
[17] Zelenock GB, Zambricki CS (2001) The Health Care Crisis: Impact on Surgery in the Community Hospital Setting. Arch Surg 136:585–591. https://doi.org/10.1001/archsurg.136.5.585
[18] Thomas W (2006) Teaching and Assessing Surgical Competence. Ann R Coll Surg Engl 88:429–432. https://doi.org/10.1308/003588406X116927
[19] Fischer JE (2005) Surgeons: employees or professionals? Am J Surg 190:1–3. https://doi.org/10.1016/j.amjsurg.2005.03.023
[20] Wolfe JH (1998) General surgical training–improvements and problems. Vascular Advisory Committee of the Vascular Surgical Society of Great Britain and Ireland. Ann R Coll Surg Engl 80:112–116
[21] Leung W-C (2002) Competency based medical training: review. BMJ : British Medical Journal 325:693
[22] Royal College of Physicians and Surgeons of Canada. (2019) The Royal College of Physicians and Surgeons of Canada :: CanMEDS Framework. http://www.royalcollege.ca/rcsite/canmeds/canmeds-framework-e. Accessed 24 Jun 2019
[23] Frank JR, Danoff D (2007) The CanMEDS initiative: implementing an outcomes-based framework of physician competencies. Med Teach 29:642–647. https://doi.org/10.1080/01421590701746983
[24] Canter R, Kelly A (2007) A new curriculum for surgical training within the United kingdom: the first stages of implementation. J Surg Educ 64:20–26
[25] NZOA NZOA (2018) New Zealand Orthopaedic Association (Royal Australasian College of Surgeons) DOPS and PBA Assessment Forms.pdf. https://nzoa.org.nz/system/files/NZOA%20DOPS%20and%20PBA%20Assessment%20Forms.pdf. Accessed 19 Mar 2019
[26] Federatie Medisch Specialisten (2019) INDIVIDUALISING POSTGRADUATE MEDICAL TRAINING using ENTRUSTABLE PROFESSIONAL ACTIVITIES and SUMMATIVE ENTRUSTMENT DECISIONS. https://www.medischevervolgopleidingen.nl/sites/default/files/flyer_amee_2017_online.pdf. Accessed 25 Aug 2019
[27] Brown C, Abdelrahman T, Patel N, et al (2017) Operative learning curve trajectory in a cohort of surgical trainees. British Journal of Surgery 104:1405–1411. https://doi.org/10.1002/bjs.10584
[28] Abdelrahman, T, Long J, Egan R, Lewis WG (2016) Operative Experience vs. Competence: A Curriculum Concordance and Learning Curve Analysis. Journal of Surgical Education 73:694–698. https://doi.org/10.1016/j.jsurg.2016.01.011
[29] Hopkins L, Robinson DBT, Brown C, et al (2019) Trauma and Orthopedic Surgery Curriculum Concordance: An Operative Learning Curve Trajectory Perspective. Journal of Surgical Education. https://doi.org/10.1016/j.jsurg.2019.05.009
Ludwig, J: Kompetenzbasierte Weiterbildung: Ursprünge, Inhalte und Erfahrungen. Passion Chirurgie. 2020 September, 10(09): Artikel 05_01.
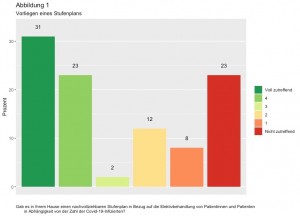

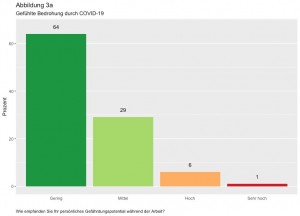
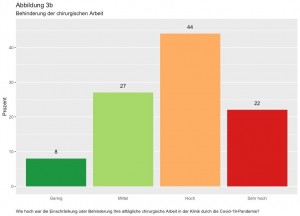











 Deutsches Beratungszentrum für Hygiene: Hygieneanforderungen in der ambulanten Praxis. Passion Chirurgie. 2020 Oktober, 10(10): Artikel 04_04.
Deutsches Beratungszentrum für Hygiene: Hygieneanforderungen in der ambulanten Praxis. Passion Chirurgie. 2020 Oktober, 10(10): Artikel 04_04.

 Brunner S, Brennfleck F, Schlitt H: Was gibt`s Neues in der Lebertransplantation? Passion Chirurgie. 2020 Oktober, 10(10): Artikel 03_02.
Brunner S, Brennfleck F, Schlitt H: Was gibt`s Neues in der Lebertransplantation? Passion Chirurgie. 2020 Oktober, 10(10): Artikel 03_02.