01.06.2016 Allgemeinchirurgie
Netzwerke Diabetischer Fuß – die Entwicklung in zehn Jahren mit Selektivverträgen

Das Problem
Das Diabetische Fußsyndrom (DFS) ist eine schwerwiegende, häufige und zunehmende Konsequenz der Volkskrankheit Diabetes. Es ist mit viel Leid für die Betroffenen und hohem Ressourcenverbrauch für das Gesundheitssystem verbunden. Zwei Eigenschaften machen es einzigartig: Die Zahl unterschiedlicher Berufsgruppen, die an einem Betroffenen gemeinsam aber zeitversetzt agieren und die Entfremdung der Betroffenen gegenüber ihren Füßen, was ihnen die Steuerung ihrer Versorgung zusätzlich erschwert. Hierfür verantwortlich ist der Verlust des schützenden Schmerzempfindens im Rahmen der peripheren Polyneuropathie.
Sieben bis zehn Prozent der Bevölkerung sind von Diabetes mellitus betroffen, etwa vier Prozent davon erleiden pro Jahr ein aktives Diabetisches Fußsyndrom. Ca. eine Mio. der derzeit in Deutschland lebenden Menschen wird im Laufe des Lebens ein aktives Diabetisches Fußsyndrom erleiden. Die Versorgung in einem eingespielten, arbeitsteilig angelegten Netzwerk hat sich als besonders effektiv gezeigt.
Die Folgen der demografischen und medizinischen Entwicklung
Auf das Diabetische Fußsyndrom entfällt ein Großteil der Ausgaben für die Diabetesversorgung [1–3]. Insbesondere die Folgekosten für Majoramputationen stehen im Vordergrund [4]. Mit der Zunahme der Zahl jüngerer Menschen mit Diabetes und dem höheren Alter [5], welches sie erreichen, nehmen Folgeerkrankungen wie Nervenschäden, Durchblutungsstörungen und in der Folge das Diabetische Fußsyndrom erheblich zu. Weltweit wird der Entwicklung der Versorgung von Menschen mit DFS ein hoher Stellenwert eingeräumt [6]. Genaue Zahlen zur Entwicklung in Deutschland fehlen. Dem will die Regierung mit einem Vorhaben zur Diabetes Surveillance entgegnen [7].
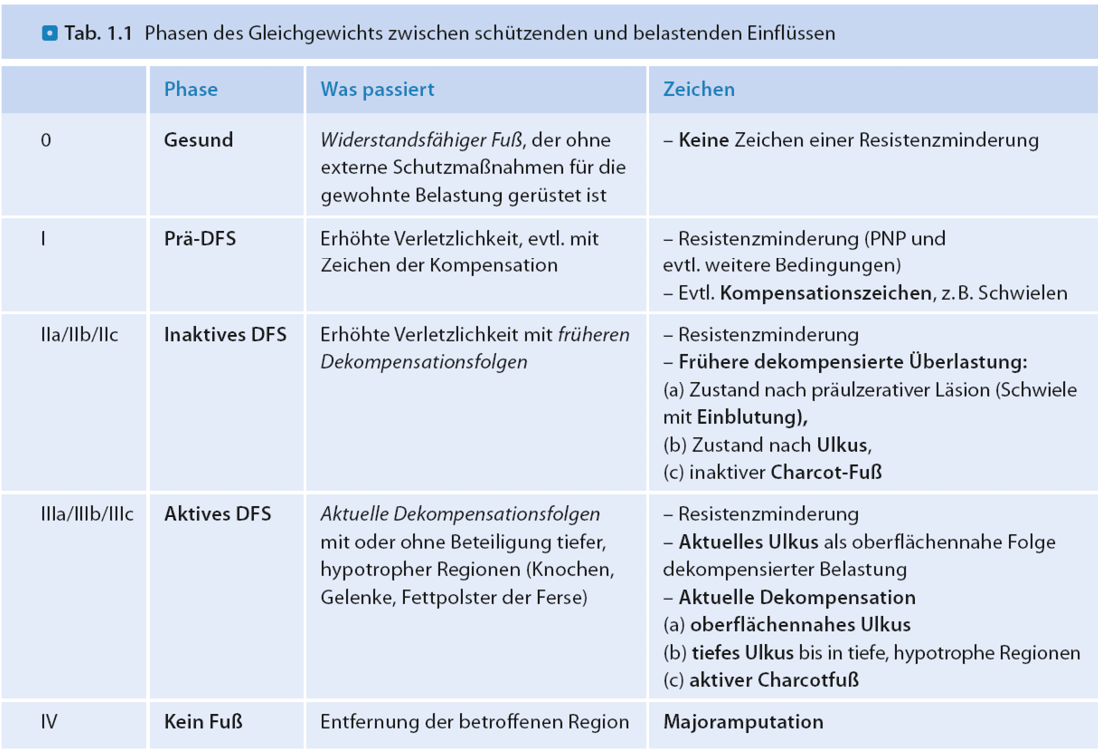
Das Diabetische Fußsyndrom führt in ca. 1,5 Prozent der Erkrankungsfälle zum Tod [8] und in ein bis zwölf Prozent der Fälle zur Amputation oberhalb des Knöchels [9–11]. Die Hälfte der Betroffenen sind nach einer solchen Amputation nicht mehr selbständig gehfähig [12, 13]. Einmal eingetreten bleibt das Krankheitsbild lebenslang bestehen und wechselt zwischen aktiven und inaktiven Phasen. Die aktiven Phasen zeigen sich durch schlecht heilende Wunden oder den sogenannten diabetogenen Charcotfuß und enden wünschenswerterweise mit Wiedererreichen der Belastungsstabilität des Fußes. In 30 bis 50 Prozent dauert die aktive Erkrankungsphase mehr als sechs Monate an. Die Zahl der Reaktivierungen nach Wiedererreichen der Belastungsstabilität liegt bei 30 bis 50 Prozent im Folgejahr nach Beginn der inaktiven Phase.
Abb. 1: Phasen des Diabetischen Fußsyndroms nach Hochlenert, Engels und Morbach [17]
Vorgeschichte und Entwicklung der Versorgung
Die Behandlung des DFS wird seit den 1980er Jahren durch die Diabetologie koordiniert. Dies hat, initiiert durch die AG Fuß der deutschen Diabetesgesellschaft in den letzten zehn Jahren zur weitgehend flächendeckenden Implementierung von zertifizierten Behandlungseinrichtungen für das DFS geführt, die in der Regel von Diabetologen geleitet werden [14]. Neben der Verbesserung der Verfahren zur interventionellen und operativen Therapie der arteriellen Durchblutungsstörung der unteren Extremität haben die strukturierten Konzepte zur Amputationsvermeidung durch den Aufbau von regionalen Netzwerken die Versorgungsrealität der betroffenen Patienten deutlich verbessert [15]. Der interdisziplinäre und interprofessionelle Ansatz hat aber auch zu einer neuen Sichtweise in der Strategie der Behandlung der einzelnen Läsionsmuster geführt. Die Implementierung einer Dokumentationsstruktur der Behandlungen (DFS-Register) [16] ermöglichte durch die Interpretation der Behandlungsdaten die Entwicklung einer Systematik anhand der Lokalisation der einzelnen Läsionsorte mit ihren pathobiomechanischen Phänomenen und prognostischen Faktoren. Durch die Frage „warum genau da?“ konnte eine überschaubare Anzahl an „Entitäten“ beschrieben werden, die über die Lokalisation der Wunde den therapeutischen Ansatz definiert [17, 18]. Hierbei wurde der Fokus auf pathobiomechanische Phänomene gesetzt. Die wesentliche Bedingung für die Entstehung einer Fußwunde bei Menschen mit Diabetes ist die Neuropathie mit Verlust des schützenden Schmerzempfindens.
Analysen des DFS-Registers [19] zeigten, dass von knapp 60.000 dokumentierten Behandlungsfällen 57,8 Prozent aller Ulzera an den Zehen auftraten. Die Zehenbeeren bleiben, geschützt durch Leistenhaut und Fettpolster, von Läsionen ausgespart. 28,9 Prozent aller Fußulzera entstehen an Zehen in Bereichen, die physiologisch nicht belastet werden.
Äußere druckumverteilende Maßnahmen durch Hilfsmittel sind vom Trageverhalten des Betroffenen abhängig und der notwendige lückenlose Einsatz bei fehlendem schützenden Schmerzempfinden regelhaft nicht gewährleistet. Das Ergebnis sind häufige Rezidive. Oft entwickelt sich daraus eine meist schwierige Patienten-Therapeutenbeziehung, die leicht in Schuldzuweisungen gegenüber den Patienten mündet.
Die Behandlung von Läsionen der Zehenkuppen durch Hyperflexion der Interphalangealgelenke und deren Korrektur durch eine Tenotomie ist bei flexiblen Fehlstellungen und ausreichender arterieller Perfusion ein risikoarmes und auch bei älteren Menschen gut ambulant durchführbares Verfahren.
| Gesamtzahl der Patienten, die 2014 innerhalb der Selektivverträge behandelt wurden | ||||||||
| Jahr | Gesamt | Berlin | Düsseldorf | Essen | Euregio | Hamburg | Köln | Niederrhein-Ruhr |
| 2014 | 17.615 | 1.460 | 3.898 | 1.182 | 990 | 2.400 | 5.350 | 2.335 |
 In einer eigenen Untersuchung von 138 Patienten mit Diabetischem Fußsyndrom bei Polyneuropathie, davon 90 Männer (65,2 Prozent) und 48 Frauen (34,8 Prozent) im mittleren Alter von 65,1 Jahren wurden insgesamt 291 Zehen mittels Tenotomie der Flexor hallucis longus – oder Flexor digitorum longus -Sehne operiert. Sie waren entweder akut von apikalen Zehenläsionen betroffen (92,1 Prozent) oder zeigten ein erhöhtes Ulkusrisiko (7,9 Prozent). Die mediane Zeit bis zum Wundschluss betrug postoperativ 13 Tage (die mittlere 32, SD 53 Tage). Die mittlere Wundheilungszeit war bei höheren Wagnerstadien länger: Wagner 1-2: 14 Tage, Wagner über 2: 37 Tage. Von nosokomialen Infektionen waren 3,1 Prozent der operierten Zehen betroffen. In der Ein-Jahres-Nachsorge waren 92,4 Prozent der untersuchten Patienten an der operierten Zehe ohne pathologischen Befund. Rezidive des DFS traten meist in den ersten sechs Monaten postoperativ auf. Im ersten postoperativen Jahr blieben 68,1 Prozent der Patienten in Remission. 93,7 Prozent der Patienten mit Wagner 0 und 72,2 Prozent der Betroffenen mit Wagner-Grad 3 waren im gesamten Nachbeobachtungszeitraum frei von Lokalrezidiven. Von Transferläsionen waren 13 % der Patienten innerhalb der ersten 1,5 bis 8,5 Monate betroffen [20].
In einer eigenen Untersuchung von 138 Patienten mit Diabetischem Fußsyndrom bei Polyneuropathie, davon 90 Männer (65,2 Prozent) und 48 Frauen (34,8 Prozent) im mittleren Alter von 65,1 Jahren wurden insgesamt 291 Zehen mittels Tenotomie der Flexor hallucis longus – oder Flexor digitorum longus -Sehne operiert. Sie waren entweder akut von apikalen Zehenläsionen betroffen (92,1 Prozent) oder zeigten ein erhöhtes Ulkusrisiko (7,9 Prozent). Die mediane Zeit bis zum Wundschluss betrug postoperativ 13 Tage (die mittlere 32, SD 53 Tage). Die mittlere Wundheilungszeit war bei höheren Wagnerstadien länger: Wagner 1-2: 14 Tage, Wagner über 2: 37 Tage. Von nosokomialen Infektionen waren 3,1 Prozent der operierten Zehen betroffen. In der Ein-Jahres-Nachsorge waren 92,4 Prozent der untersuchten Patienten an der operierten Zehe ohne pathologischen Befund. Rezidive des DFS traten meist in den ersten sechs Monaten postoperativ auf. Im ersten postoperativen Jahr blieben 68,1 Prozent der Patienten in Remission. 93,7 Prozent der Patienten mit Wagner 0 und 72,2 Prozent der Betroffenen mit Wagner-Grad 3 waren im gesamten Nachbeobachtungszeitraum frei von Lokalrezidiven. Von Transferläsionen waren 13 % der Patienten innerhalb der ersten 1,5 bis 8,5 Monate betroffen [20].
Die Entwicklung der operativen Fächer hat sich in den vergangenen 20 Jahren rasant entwickelt, zum Beispiel in der bariatrischen Chirurgie. Auch hier ist ein interdisziplinärer und interprofessioneller Ansatz mit dem nachhaltigen Erfolg der Therapie verknüpft.
Die Übertragung operativer Entlastungskonzepte der Fußchirurgie auf Menschen mit Neuropathie ist zwischen den beteiligten Disziplinen (Diabetologie/Chirurgie) allerdings immer noch fast völlig unterbunden [21].
Ergebnisse und Ausblick
In den Regionen Nordrhein, Hamburg und Berlin wurden seit 2002 insgesamt sieben Netzwerke zur spezialisierten Versorgung von Menschen mit Diabetischem Fuß (DFS) aufgebaut. Sie realisieren ein arbeitsteiliges Wirken von Diabetologen, Chirurgen, Fachangestellten der Alten- und Krankenpflege, Orthopädieschuhmachern und -Technikern sowie Podologen. Eine umfassende Qualitätssicherung mit neuen Ausbildungsformen und Schaffung maximaler Transparenz begleitete die Netzentwicklung. Gestützt durch eine besondere Vergütung führten sie Aufmerksamkeitskampagnen durch, bildeten Pflegedienste und Hausärzte aus und stellten Zweitmeinungen vor Majoramputationen zur Verfügung. Sie ergänzen die Disease-Management-Programme (DMP Diabetes). Insgesamt sind 101 ärztliche Einrichtungen beteiligt. Sie haben 2014 insgesamt 17.615 Patienten versorgt.
Zur Evaluation wurden die Abrechnungsdaten der größten Krankenkasse dieser Regionen (AOK Rheinland-Hamburg) auf den zeitlichen Verlauf der Rate von Amputationen bei Diabetikern überhaupt sowie auf den Verlauf der Amputationsrate der einzelnen betroffenen Diabetiker untersucht.
Daten von 2,9 Mio. Versicherten in den Jahren 2007 bis 2013 wurden untersucht. Für jede Region wurden Diabetiker, ihr Alter, Geschlecht und die Amputationen mittels log-linearer Poisson-Regression analysiert.
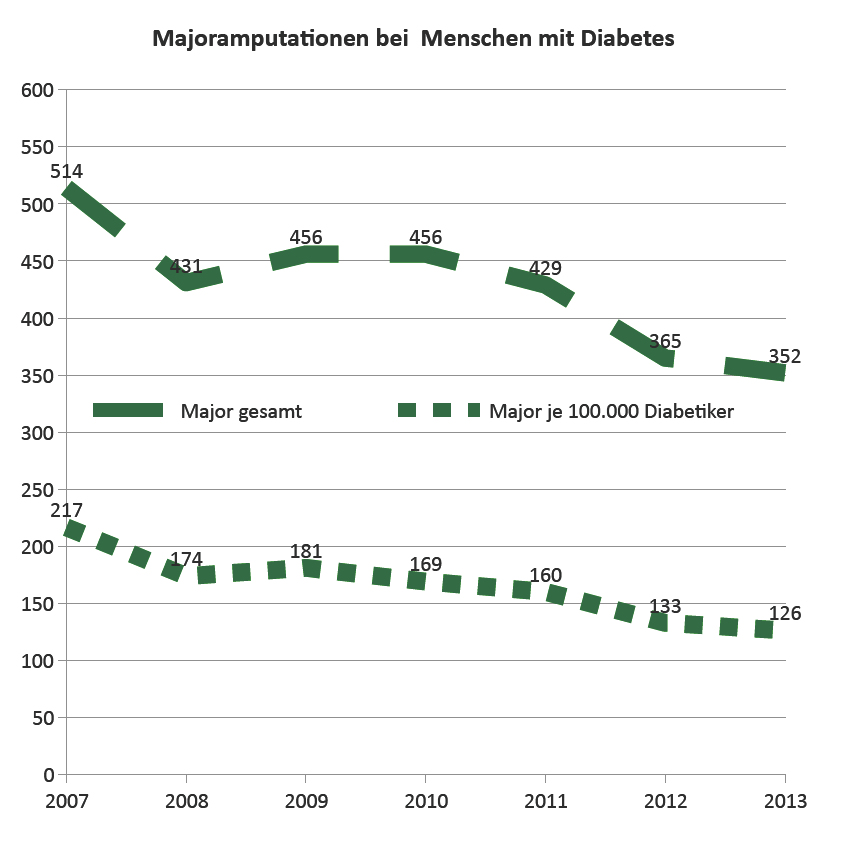
Die Rate der Diabetiker, die Majoramputationen benötigten, sank signifikant um 9,5 % / Jahr (p < 0,0001) von 217 auf 126 / 100.000 Patienten/Jahr. Die Rate der Diabetiker mit Amputationen jeder Art sank von 504 auf 419 / 100.000 Patienten/Jahr (p= 0,0038).
Die Ergebnisse zeigen eine deutliche Reduktion der Notwendigkeit von Amputationen bei Menschen mit Diabetes zeitgleich mit der Verbreitung des DMPs und der Netzwerke Diabetischer Fuß.
Am Ende des Beobachtungszeitraumes war die Rate der Menschen mit Diabetes, bei denen Amputationen vorgenommen wurden, noch immer hoch. Die weitere Verbreitung und Entwicklung einer organisierten, spezialisierten interdisziplinären Versorgung wird daher dringend benötigt [22].
Ziele der Behandlung sind das Überleben des Menschen mit DFS und der Erhalt der Mobilität. Der Vermeidung von Amputationen, auch Minoramputationen, kommt dabei eine wesentliche Bedeutung zu.
Der Schwerpunkt chirurgischer Expertise im interdisziplinären Team ist zwingend notwendig für eine Fokussierung auf die vielfältigen chirurgischen Möglichkeiten der „inneren Druckentlastung“ zur Behandlung von Läsionen von Menschen mit Neuropathie. Ihre flächendeckende Zugänglichkeit und die Würdigung der Notwendigkeit einer spezialisierten Ausbildung sind entscheidende Strukturelemente zur Verbesserung der Amputationssituation in Deutschland. Die spezialisierte Versorgung wird durch ein angemessenes Vergütungskonzept innerhalb einer Sondervertragssituation ermöglicht.
Zur Verbreitung und Diskussion dieser Themen haben die Autoren einen Blog eingerichtet und freuen sich über Ihren Beitrag.
| Amazon-Link: Das Diabetische Fußsyndrom |
Literatur
[1] Ramsey, S.D., et al., Incidence, outcomes, and cost of foot ulcers in patients with diabetes. Diabetes Care, 1999. 22(3): p. 382-7.
[2] Koster, I., et al., Direct costs of diabetes mellitus in Germany – CoDiM 2000-2007. Exp Clin Endocrinol Diabetes, 2011. 119(6): p. 377-85.
[3] Hauner, H., [The costs of diabetes mellitus and its complications in Germany.]. Dtsch Med Wochenschr, 2006. 131 Suppl 8: p. S240-2.
[4] Apelqvist, J., et al., Long-term costs for foot ulcers in diabetic patients in a multidisciplinary setting. Foot Ankle Int, 1995. 16(7): p. 388-94.
[5] Bildung, B.f.P. and S. Bundesamt, Fernere Lebenserwartung im Alter von 60 Jahren, 10. 11. und 12. kordinierte Bevölkerungsvorausberechnung. 2012.
[6] Jeffcoate, W. and K. Bakker, World Diabetes Day: footing the bill. Lancet, 2005. 365 (9470): p. 1527.
[7] (RKI), R.K.I. Aufbau einer Nationalen Diabetes-Surveillance am Robert Koch-Institut. 2016 [cited 2016 19.04.2016]; Available from: http://www.rki.de/DE/Content/Gesundheitsmonitoring/Themen/Chronische_Erkrankungen/Diabetes/FP_Diabetes_Surveillance.html.
[8] Hochlenert, D., G. Engels, and S. Hinzmann, Todesursachen bei Patienten mit diabetischem Fußsyndrom. Diabetes und Stoffwechsel, 2005. 14: p. 136.
[9] Hochlenert, D., Qualitätsbericht des Netzwerkes Diabetischer Fuß Köln und Umgebung 2009. 2010: http://www.fussnetz-koeln.de/webroot/upload/files/Qualitaetsbericht_2009.pdf.
[10] Hochlenert, D., G. Engels, and L. Altenhofen, Integrierte Versorgung: Ergebnisse des Netzwerks Diabetischer Fuß Köln und Umgebung. Dtsch Arztebl, 2006. 103(24): p. A 1680-3.
[11] Kersken, J. and R. Lobmann, Interdisziplinäre Behandlung zeigt positive Auswirkungen. Orthopädieschuhtechnik, 2011. Sonderheft Diabetes 2011: p. 20-3.
[12] Nehler, M.R., et al., Functional outcome in a contemporary series of major lower extremity amputations. J Vasc Surg, 2003. 38(1): p. 7-14.
[13] Peters, E.J., et al., Functional status of persons with diabetes-related lower-extremity amputations. Diabetes Care, 2001. 24(10): p. 1799-804.
[14] Lobmann, R., Achwerdow, O., Brunck-Loch, S., Engels, G., Trocha, A., Groene, C., Kersken, J.: The diabetic foot in Germany 2005-2012: Analysis of quality in specialized diabetic foot care centers, Wound Medicine 4, 2014.
[15] Hochlenert, D., G. Engels, and L. Altenhofen, Integrierte Versorgung: Ergebnisse des Netzwerks Diabetischer Fuß Köln und Umgebung. Dtsch Arztebl, 2006. 103(24): p. A 1680-3.
[16] Risse, A., et al., Aufbau und Methoden des DFS-Registers. Der Diabetologe, 2015. 2: p. 114-122.
[17] Hochlenert, D., G. Engels, and S. Morbach, Das Entitätenkonzept des DFS. Der Diabetologe, 2015. 2: p. 2015 · 11:130–137.
[18] Hochlenert D, Engels G, Morbach S (2014) das Diabetische Fußsyndrom – Über die Entität zur Therapie. Springer Verlag, Berlin Heidelberg New York.
[19] Jecht, M., Hochlenert, D., Engels, G., Morbach, S., Trocha, A., Risse, A. Charakteristika von Menschen mit einem diabetischen Fußsyndrom. Diabetologe 11:138-143 (2015).
[20] Klein, A. Die Tenotomie der Flexor-hallucis-longus-Sehne und Flexor-digitorum-longus-Sehne zur Behandlung von Zehenkuppenläsionen bei Patienten mit Diabetischem Fußsyndrom. Dissertation Universität zu Köln (2012).
[21] Hochlenert, D. Keine Angst vor kleiner Chirurgie am neuropathischen Fuß. Chirurgenmagazin 1.2015:40-43 (2015).
[22] May, M., Hahn, S., Tonn, C., Engels, G., Hochlenert, D.: Decrease in(Major)Amputations in Diabetics: A Secondary Data Analysis by AOK Rheinland/Hamburg. Journal of Diabetes Research 2016, http://dx.doi.org/10.1155/2016/6247045.
Engels G. / Hochlenert D. Netzwerke Diabetischer Fuß – die Entwicklung in zehn Jahren mit Selektivverträgen. Passion Chirurgie. 2016 Juni, 6(06): Artikel 02_02.
Weitere aktuelle Artikel
22.01.2020 Allgemeinchirurgie
CME-Artikel: Akut entzündliche Krankheitsbilder in der Abdominalchirurgie
Für Mitglieder des BDC ist der CME-Kurs zum Artikel, erschienen in der PASSION CHIRURGIE, kostenfrei und wurde mit 2 CME-Punkten zertifziert.
05.12.2019 Allgemeinchirurgie
Geschlechterunterschiede bei Darmkrebs
Etwa 60.000 Menschen erkranken jedes Jahr in Deutschland neu an Darmkrebs, auch immer jüngere Menschen sind betroffen. Neue Forschungsergebnisse zeigen nun weitreichende Geschlechterunterschiede bei dieser Tumorerkrankung. Dabei unterscheiden sich bei Mann und Frau nicht nur in Teilen die Wirkung von Chemo- und Immuntherapie, sondern auch Erkrankungshäufigkeit und -alter.
09.07.2019 Akademie aktuell
Hospitation HERNIENSCHULE: 1 Tag, 7 Patienten, 5 Techniken
In der Havelklinik in Berlin ist ein Gast mit im OP: Dr. med. Andreas Straßmüller hospitiert bei Dr. med. Ralph Lorenz. Sieben Patienten mit Leistenhernien stehen auf dem OP-Plan. Straßmüller ist Facharzt für Viszeralchirurgie aus Augsburg und nimmt an der HERNIENSCHULE teil.