Die Adipositas- und metabolische Chirurgie gilt als junge Entwicklung in der Chirurgie. Der Dammbruch datiert in das Jahr 1992, als das erste Magenband minimal-invasiv implantiert wurde. Die Durchführung des ersten laparoskopischen Roux-Y-Magen-Bypass (RYGB) durch Alan Wittgrove erfolgte 1994 [1], die Etablierung des Schlauchmagens (SG) vom First-stage- (Michel Gagner) zum Stand-alone-Verfahren im Jahr 2012 [2] – mittlerweile setzt sich langsam der durch Robert Rutledge 1997 eingeführte Mini gastric bypass und One anastomosis gastric bypass (MGB/OAGB) weltweit als dritthäufigster Primäreingriff durch [3]. Diese drei Verfahren haben sich in den letzten Jahren als Standardverfahren etabliert und sind auch in Deutschland die am häufigsten durchgeführten Eingriffe. 2017 wurden hierzulande 3.655 SG (48,6 %), 2.220 RYGB (29,5 %) und 1.044 MGB/OAGB (13,9 %), durchgeführt (StuDoQ|MBE – Studien-, Dokumentations- und Qualitätszentrum Metabolische und Bariatrische Erkrankungen).
Hat sich die Zahl der übergewichtigen und adipösen Menschen seit 1980 weltweit verdoppelt und die Zahl der an Diabetes mellitus erkrankten Menschen vervierfacht, steigt analog die Zahl der adipositaschirurgischen Eingriffe. Wurden 1997 weltweit noch 40.000 adipositaschirurgische Eingriffe durchgeführt [4], so waren es 2016 bereits 685.874 [5].
Historischer Rückblick: Probleme der Malnutrition führten recht schnell zur Feststellung, dass Adipositaschirurgie immer Magenchirurgie ist
Victor Henriksson beobachtete erstmals 1952 eine Gewichtsabnahme bei Patienten mit massiver Dünndarmresektion und berichtete über den ersten Einsatz des Dünndarm-Bypasses in der Adipositastherapie. Die Probleme der Malnutrition führten recht schnell zu der Feststellung, dass Adipositaschirurgie immer Magenchirurgie ist [6, 7]. Anfang der 1960er-Jahre entwickelten Edward E. Mason und Chikashi Ito auf der Basis negativer Erfahrungen mit dem Dünndarm-Bypass den Magen-Bypass [8]. Aufgrund von Ulzerationen und Mangelzuständen führte Mason die Gastroplastik als Alternative zum Magen-Bypass ein, der erste restriktive Eingriff entstand. Die Einführung der minimalinvasiven Chirurgie führte zur Renaissance des Magen-Bypass.
Alan Wittgrove (USA) publizierte 1994 erstmals den laparoskopischen Magen-Bypass, damals noch mit einem alimentären Schenkel von 75 Zentimeter und einem biliopankreatischen Schenkel von zehn bis 12 Zentimeter [1]. Der laparoskopische Roux-Y-Magen-Bypass verbesserte die Frühergebnisse aufgrund einer Reduktion der postoperativen Komplikationen Platzbauch und Lungenembolie. Nicola Scopinaro (Italien) war der Erste, der die biliopankreatische Diversion (BPD) mit dem Zweck der induzierten Malabsorption in Europa einführte [9]. Eine Fortentwicklung in die Richtung kombinierter restriktiver und malabsorptiver Eingriffe war die biliopankreatische Diversion mit Duodenal-Switch in Nordamerika. Die Schlauchmagenbildung entstand aus diesem Verfahren und zeigte im Stufenkonzept eine erfolgreiche Gewichtsabnahme als alleiniges Verfahren [7]. In der Entwicklung ist sie aktuell die am häufigsten durchgeführte Operation weltweit.
Jeder adipositaschirurgische Eingriff hat Vor- und Nachteile sowie Kurz- und Langzeitkomplikationen
Parallel zu diesen Entwicklungen führte Robert Rutledge (USA) 1997 den Mini-Gastric-Bypass ein [3]. Dieser unterscheidet sich grundsätzlich von dem von Edward Mason im Jahr 1967 beschriebenen Omega-Loop-Magen-Bypass. Der kurze horizontale Pouch, der mit einer Schlinge anastomosiert war, führte zu schwerstem Gallereflux in den Ösophagus. Aus diesem Grund gilt der Mason-Bypass heute als obsolet. Um Verwirrung zu vermeiden, sollten die alten Bezeichnungen Omega-Loop-Magen-Bypass und BII-Magen-Bypass nicht mehr verwendet werden. Trotz anfänglich starker Kritik weltweit hat sich der MGB/OAGB aufgrund seiner vielen Vorteile mittlerweile als eines der Standardverfahren etabliert.
Die Geschichte der Adipositaschirurgie zeigt unterschiedliche vielversprechenden Verfahren. Die Historie demonstriert aber auch die Notwendigkeit für Variationen und Weiterentwicklungen. Jeder adipositaschirurgische Eingriff hat Vor- und Nachteile sowie Kurz- und Langzeitkomplikationen. Die Verfahrenswahl soll deshalb individuell den medizinischen, psychosozialen und allgemeinen Lebensumständen des Patienten angepasst werden (S3-Leitlinie Chirurgie der Adipositas und metabolischer Erkrankungen Version 2.3 [Februar 2018] AWMF-Register Nr. 088-001 [Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften]). Ein lebenslanges Follow-up der operierten Patienten muss bei allen adipositaschirurgischen Eingriffen erfolgen, um die chronische Krankheit Adipositas regelmäßig zu kontrollieren und die Komorbiditäten, die Lebensqualität der Patienten sowie mögliche Langzeitfolgen der Operation zu evaluieren.
Die wissenschaftliche Evidenz für die heutigen Standardverfahren SG, RYGB und MGB/OAGB nimmt beständig zu
Dieses Jahr konnten zudem zwei wichtige prospektive Vergleichsstudien, welche die Eingriffe RYGB und SG bis zu einem Fünfjahres-Follow-up (FU) gegenüberstellen, publiziert werden. Ralph Peterli et al. (Schweiz) zeigten in ihrem SM-BOSS Trial [10] und Paulina Salminen et al. (Finnland) in ihrem SLEEVEPASS Trial [11] die Vor- und Nachteile des jeweiligen Verfahrens. Beide Studien hatten den Gewichtsverlust als primären Endpunkt ausgedrückt als prozentualer Excess weight loss (EWL %) (SLEEVEPASS, n = 240) und prozentualer excess BMI loss (EBMIL %) (SM-BOSS, n = 217). Das Fünfjahres-FU betrug 80,4 Prozent (SLEEVEPASS) und 94,5 Prozent (SM-BOSS). Der mittlere BMI betrug 45,9 ± 6 kg/m2 (SLEEVEPASS) und 43,9 kg/m2 (SM-BOSS). Fünf Jahre postoperativ zeigte sich ein EBMIL von 61,1 Prozent in der SG- und 68,3 Prozent in der RYGB-Gruppe (p = 0,22) in der Schweizer Gruppe sowie eine EWL von 49 Prozent nach SG und 57 Prozent nach RYGB in der finnischen Gruppe. Im SLEEVEPASS Trial zeigte sich mit 57 Prozent statistisch signifikant ein größerer EWL fünf Jahre postoperativ. Diese Signifikanz ist klinisch aber nicht relevant, da die Differenz von neun im Konfidenzintervall lag. Somit sind die beiden Operationsverfahren SG und RYGB in Bezug auf den Gewichtsverlust fünf Jahre postoperativ als gleichwertig anzusehen.
Die sekundären Endpoints im SLEEVEPASS Trial waren die Besserung der Komorbiditäten, die Besserung der Lebensqualität sowie Morbidität und Mortalität. Fünf Jahre postoperativ zeigte sich kein Unterschied in der Diabetesremission (p > 0,99). Eine komplette Diabetes-mellitus-Typ-2(DM2)-Remission zeigte sich nach fünf Jahren bei 12 Prozent der SG-Patienten und 25 Prozent der RYGB-Patienten. Eine Remission der Dyslipidämie zeigte sich bei 20 Prozent der SG-Patienten und 40 Prozent der RYGB-Patienten. Die Besserung der LDL-C-Werte (p = 0,02) und der arteriellen Hypertonie (29 % SG vs. 51 % RYGB, p = 0,02) waren statistisch signifikant stärker in der RYGB-Gruppe im Vergleich zur SG-Gruppe. Die Lebensqualität (Moorehead-Ardelt Quality of Life) zeigte sich bei beiden Verfahren fünf Jahre postoperativ signifikant verbessert (p < 0,001), aber ohne einen statistischen Unterschied zwischen den Verfahren (p = 0,7). Es zeigte sich kein statistischer Unterschied in der 30-Tages-Morbidität in Bezug auf die Major-Komplikationen (Clavien-Dindo IIIb). Ebenso zeigte sich kein statistischer Unterschied in Bezug auf die Minor- und Major-Langzeitkomplikationen im Langzeitverlauf (SG 19 % vs. RYGB 26 %, p = 0,19). Die 30-Tages-Minor-Morbidität (Clavien-Dindo I–IIIa) war in der RYGB-Gruppe statistisch höher (SG 7,4 vs. RYGB 17,1 %, p = 0,02). Die Mortalität lag bei null Prozent.
Mit ansteigender Zahl von Schlauchmagenoperationen werden die Revisionseingriffe zunehmen
Die sekundären Endpoints im SM-BOSS Trial waren die Besserung der Komorbiditäten und die Komplikationen. Fünf Jahre postoperativ zeigte sich eine signifikante Besserung der gastroösophagealen Refluxkrankheit (GERD) in der RYGB-Gruppe (p = 0,002) und eine signifikante Verschlechterung in der SG-Gruppe (p = 0,006). In der RYGB-Gruppe zeigte sich ebenso eine statistisch signifikante Besserung der Cholesterol/HDL-C Ratio (p = 0,02) und des LDL-C (p = 0,008). Die Lebensqualität zeigte sich in beiden Gruppen signifikant verbessert, ohne statistischen Unterschied zwischen den beiden Gruppen (GIQLI Score p = 0,42 und BAROS Score p = 0,2). Die perioperative Morbidität war in beiden Gruppen ohne signifikanten Unterschied (p = 0,66), ebenso die Spätkomplikationen (SG 14,9 % vs. RYGB 17,3 %) waren statistisch ohne signifikanten Unterschied (p = 0,77). Die Rate an Re-Operationen betrug 15,8 Prozent in der SG-Gruppe (Umwandlung in RYGB n = 9, Trokarhernie n = 1, unzureichende Gewichtsabnahme n = 5) und 22,1 Prozent in der RYGB-Gruppe (Ileus n = 2, innere Hernie n = 9, Trokarhernie n = 1, Dumping n = 3, diagnostische Laparoskopie mit Gastroskopie des Restmagens n = 1, unzureichende Gewichtsabnahme n = 2) (Abb. 1). Da in der RYGB-Gruppe bei nicht allen Patienten die Defekte des Mesenteriums verschlossen wurden (Supplement 2: Verschluss des Mesenteriums bei zirkulärer Anastomose, kein Verschluss des Mesenteriums bei linearer Anastomose), bleibt offen, ob die inneren Hernien vermehrt bei den Patienten ohne Verschluss des Mesenteriums aufgetreten sind.
Diskutiert wird somit aktuell die Gleichwertigkeit der SG im Vergleich zum RYGB. Die Vorteile des RYGB liegen eindeutig in der Refluxtherapie und der Besserung der LDL-C-Werte. Da das LDL einer der Risikofaktoren für kardiovaskuläre Erkrankungen darstellt, ist der Vorteil des RYGB bei Patienten mit kardiovaskulären Erkrankungen nachvollziehbar. Die Rate an Re-Operationen im Langzeitverlauf aufgrund von inneren Hernien und Dumping-Syndrom darf hierbei nicht unterschätzt werden. Die Zukunft wird zudem auch aufzeigen, ob die Rate an Re-Operationen nach SG aufgrund von Reflux und unzureichender Gewichtszunahme ansteigen wird. Die Arbeiten von Felsenreich et al. [12] mit einer Konversionsrate der SG von 36 Prozent und die Arbeit von Arman et al. [13] mit einer Konversionsrate von 25 Prozent in den ersten zehn Jahren postoperativ zeigen, dass in Zukunft mit ansteigender Zahl der Schlauchmagenoperationen auch, die Zahl der Revisionsoperationen zunehmen wird. Zudem muss man bedenken, dass die Patienten der prospektiven Studien SM-BOSS und SLEEVEPASS einen mittleren BMI von nur 43,9 kg/m2 und 45,9 kg/m2 aufweisen. Da der mittlere BMI in Deutschland bei der Primäroperation bei 49,4 kg/m2 (männlich 50,4 kg/m2, weiblich 49 kg/m2, Quelle: StuDoQ|MBE 2015 – 2017, n = 16.212) liegt, gilt kritisch zu hinterfragen, ob die Studienergebnisse auf unser Patientengut übertragbar sind.
Vorteile des MGB/OAGB sind die niedrige perioperative Morbidität, die geringe Konversionsrate und die simple Reversibilität
Der MGB/OAGB ist mittlerweile von der International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO) akzeptiert, auch die wissenschaftliche Evidenz nimmt zu [14] (Abb. 2). In einer von uns durchgeführten systematischen Literaturanalyse (35 Publikationen eingeschlossen) konnten wir zeigen, dass der MGB/OAGB kurzfristig Vorteile hinsichtlich der Gewichtsreduktion und der antidiabetischen Wirkung im Vergleich zum RYGB und SG aufweist. Die perioperative Morbidität (3,2 – 10,8 %) und Mortalität (0 – 0,9 %) sind zudem gering [15]. Prospektiv randomisierte Studien, die den MGB mit den Standardeingriffen SG und RYGB vergleichen, sind indes rar. Zu unterstreichen ist, dass aktuell fast nur drittgradige Evidenz in Bezug auf den MGB/OAGB existiert. Die Zukunft wird hier sicher mehr Aufschluss geben [15]. Trotzdem es ein junges Verfahren ist, existieren Langzeitdaten mit bis zu einem Follow-up von zehn Jahren für den MGB/OAGB.
Alkhalifah et al. wiesen bei 1.731 Patienten nach, dass ein, fünf und zehn Jahre postoperativ (FU-Rate 89,3 %, 52,1 % und 43,6 %) der total weight loss 32,7, 32,2 und 29,1 Prozent betrug. Die Daten wurden retrospektiv gematcht mit RYGB- und SG-Patienten; hier war der Gewichtsverlust zwei bis sechs Jahre postoperativ statistisch signifikant am größten nach MGB/OAGB. Die Effektivität des MGB/OAGB wird zudem durch die niedrige Rate an Revisionsoperationen (OAGB 4 % vs. RNYGB 5,1 % vs. SG 5,2 %) unterstrichen [16]. Somit scheinen aktuell die Vorteile des Verfahrens in der niedrigen perioperativen Morbidität, der geringen Konversionsrate und letztendlich auch der simplen Reversibilität zu liegen. Die Daten des StuDoQ|MBE von 2017 bestätigen die niedrige Rate an registrierten Revisionsoperationen nach MGB (MGB 0,1 % vs. RNYGB 0,6 % vs. SG 4,5 %) [15].
Metabolische Chirurgie: Nicht nur Gewichtsverlust, sondern auch eine allen konservativen Therapien weit überlegene Besserung Adipositas-assoziierter Erkrankungen
Einen großen Wendepunkt in der Anerkennung und der Indikationsstellung der einstmals bariatrischen Chirurgie (griechisch βαρος: Schwere, Gewicht), also der Chirurgie des Übergewichts, brachte im Jahr 2016 die finale Umsetzung der metabolischen Chirurgie in den amerikanischen und letztlich auch in der deutschen Leitlinie (S3-Leitlinie Chirurgie der Adipositas und metabolischer Erkrankungen Version 2.3 [Februar 2018] AWMF-Register Nr. 088-001). Die Tatsache, dass die Adipositaschirurgie nicht nur mit einem Gewichtsverlust, sondern auch mit einer allen medikamentösen und konservativen Therapien weit überlegenen Verbesserung der Adipositas-assoziierten Erkrankungen einhergeht, unterstreicht die Stärke der Adipositas- und metabolischen Chirurgie zur Therapie der chronischen Erkrankung Adipositas und ihrer assoziierten Erkrankungen [17].
Den Grundstein für die Entwicklung der metabolischen Chirurgie legten Henry Buchwald und Walter Pories in den 1990er Jahren. Buchwald belegte mit seinem POSCH Trial (Program on the Surgical Control of the Hyperlipidemias) nicht nur den positiven Effekt des ilealen Bypass auf die Hyperlipidämie, sondern auch eine Reduktion der Morbidität hinsichtlich einer bestehenden koronaren Herzerkrankung. Pories hingegen beschrieb als erster die Normalisierung des Glukosemetabolismus nach Magen-Bypass bei Patienten mit DM2 [18].
Die prospektiv randomisierten Studien von Phil Schauer (USA) [19] und Gertrude Mingrone (Italien) [20] wiesen die imponierende Wirkung der adipositaschirurgischen Eingriffe auf den DM2 und das signifikant bessere Outcome der Operationen im Vergleich zur intensivierten konservativen Therapie nach. Die Arbeiten zeigen eine deutliche Überlegenheit der metabolischen Chirurgie hinsichtlich der Blutzuckerkontrolle, des mittelfristigen Gewichtsverlusts und der Lebensqualität gegenüber konservativen Therapieprogrammen.
Seit 2016 gilt die Adipositaschirurgie als Therapie der Wahl bei Diabetikern mit Adipositas Grad III, immer häufiger auch bei Grad I und II
Somit wurde 2016 auf der 2nd Diabetes Surgery Summit (DSS-II), einer internationalen Konsensuskonferenz mit 48 internationalen und führenden Diabetologen, Endokrinologen, Gastroenterologen, Ernährungsmedizinern und Chirurgen ein revolutionierendes Statement entwickelt. Basierend auf der wissenschaftlichen Evidenz, dass die Adipositas- und metabolische Chirurgie eine exzellente Kontrolle des Glukosestoffwechsels erreicht, ist die Chirurgie die Therapie der Wahl bei Diabetikern mit Adipositas Grad III und bei Patienten mit einer Adipositas Grad II und I, wenn die diabetesspezifischen individuellen Zielwerte nicht durch Lifestyle-Veränderungen und optimale medikamentöse Therapie kontrolliert werden können [21]. Die diabetesspezifischen individuellen Zielwerte sind neben der Erhaltung bzw. Wiederherstellung der Lebensqualität, die Behandlungszufriedenheit, die Reduktion des Risikos für kardiale, zerebrovaskuläre und sonstige makroangiopathische Folgekomplikationen, die Vermeidung und Behandlung mikrovaskulärer Folgekomplikationen (Erblindung, Dialyse, Neuropathie), die Vermeidung und Behandlung des diabetischen Fußsyndroms, die Vermeidung und Behandlung von Symptomen durch die Verbesserung der Stoffwechseleinstellung, die Behandlung und Besserung von Begleitkrankheiten und natürlich die Reduktion von Morbidität und Mortalität. Zur Prävention von Folgekomplikationen wird empfohlen einen HbA1c-Wert von 6,5 bis 7,5 Prozent unter Berücksichtigung der individualisierten Therapieziele anzustreben (Nationale Versorgungsleitlinie Therapie des Typ-2-Diabetes, AWMF-Register Nr.: nvl-001g).
Prospektive Studien sollten zukünftig die Standardeingriffe SG, RYGB und MGB mit nicht-operierten Patienten hinsichtlich der Reduktion harter Endpunkte vergleichen
Die deutsche S3-Leitlinie Chirurgie der Adipositas und metabolischer Erkrankungen hat die internationalen Empfehlungen umsetzen können. Grundlegend ist, dass zur Stellung der Operationsindikation bei diesen Patienten der Nachweis einer ausgeschöpften konservativen Therapie im Sinne der Adipositaschirurgie nicht erforderlich ist, da als Behandlungsziel die Besserung der glykämischen Stoffwechsellage im Vordergrund steht. Zur Indikationsstellung bei Adipositas Grad I und II muss ein Diabetologe hinzugezogen werden und metabolische Eingriffe sollen nur an einem Zentrum mit besonderer Expertise vorgenommen werden (Kompetenz-, Referenz- und Exzellenzzentrum).
Bis sich die metabolische Chirurgie in Deutschland durchsetzt, wird es noch ein paar Akzeptanzjahre brauchen, sie ist jedoch bereits jetzt eine effektive Primärprävention zur Vermeidung von Folgekomplikationen des DM2. In Zukunft sollten aus diesem Grund prospektive Studien angelegt werden, welche die heutigen Standardeingriffe SG, RYGB und MGB mit nicht-operierten Patienten in Bezug auf die Reduktion der harten Endpunkte Erblindung, Dialyse und Amputation vergleichen. Das Verhindern und Aufschieben der diabetischen Retinopathie, diabetischen Nephropathie, diabetischen Neuropathie und die Vermeidung von Herz-Kreislauferkrankungen, zuvorderst Herzinfarkt und Apoplex, kann als Revolution in der Medizin gewertet werden.
Die biliopankreatische Schlinge: Signifikant höherer Gewichtsverlust nach Long BPL-limb RYGB
Der biliopankreatische Schenkel (biliopancreatic limb – BPL) nimmt immer mehr an Bedeutung zu. Es gilt die Rolle des BPL hinsichtlich der Gewichtsabnahme und des metabolischen Impacts zu erörtern. Neergard et al. hatten schon 2014 in einer prospektiv randomisierten Studie das Outcome der Patienten untersucht, die einem Standard-RYGB (alimentäre Schlinge [alimentary limb AL] 150 cm, BPL 60 cm) und einem Long BPL-limb RYGB (AL 60 cm, BPL 200 cm) unterzogen wurden. Das Fünfjahres-FU betrug 85 Prozent. Der Gewichtsverlust war statistisch signifikant besser nach Long BPL-limb RYGB. Nach sieben Jahren betrug der Excess BMI loss (EBMIL) 78,4 Prozent in der Long BPL-limb-Gruppe im Vergleich zu 67,1 Prozent in der Standard-RYGB-Gruppe (p < 0,001). Die additive Gabe von Supplementen war statistisch signifikant höher in der Long BPL-limb-RYGB-Gruppe (p < 0,001), vor allem die Supplementation von Vitamin D und Eisen. Die Parameter Vitamin D, Eisen, Ferritin, Hämoglobin und Parathormon waren signifikant niedriger in der Long BPL-limb-Gruppe. Im Hinblick auf die Remission der Komorbiditäten DM2, arterielle Hypertonie, Schlafapnoe, Gelenkbeschwerden und Reflux zeigte sich kein statistisch signifikanter Unterschied zwischen den beiden Gruppen. Die Stuhlfrequenz nach Long BPL-limb war erhöht [22]. Eine prospektiv randomisierte Studie der Arbeitsgruppe Inabnet et al. konnte bei einem Vergleich des Standard-RYGB (AL 100 cm, BPL 50 cm) mit einem Long BPL-limb RYGB (AL 150 cm, BPL 100 cm) postoperativ eine höhere Rate an inneren Hernien 12 Monate nachweisen (p = 0,029) [23]. Es stellt sich die Frage, ob der Long BPL-limb RYGB oder der MGB/OAGB die besseren Langzeitergebnisse hat.
Klinikintern führen wir den MGB adaptiert an den präoperativen BMI mit einem BPL zwischen 150 und 200 Zentimeter durch
Die Ausschaltung des biliopankreatischen Schenkels führt auch nach MGB/OAGB zu einer bekannten Malnutrition (Albuminämie < 30 g/l) (0,1 – 1,3 %), Eisenmangelanämie (3,9 – 12,7 %), und zu einem Vitamin-D-Mangel (32 %) [15]. Über die obligate Substitution und regelmäßige postoperative Kontrollen müssen diese Patienten aus diesem Grund zwingend aufgeklärt werden. Der biliopankreatische Schenkel sollte beim MGB/OAGB beginnend vom Treitz-Band gemessen, 150 bis 200 Zentimeter lang sein [24] (Abb. 3).
Robert Rutledge empfiehlt angehenden MGB-Chirurgen die biliopankreatische Schlinge aufgrund der Gefahr des exzessiven Gewichtsverlustes und der Gefahr der Malnutrition mit 150 Zentimeter zu wählen. Klinikintern führen wir den MGB adaptiert an den präoperativen BMI mit einem BPL zwischen 150 und 200 Zentimeter durch. Super-obese-Patienten (BMI > 50 kg/m2) erhalten eine Schlingenlänge von 180 Zentimeter. Bei einem BMI < 50 kg/m2 und jüngerem Lebensalter beträgt der BPL 150 Zentimeter, um die möglichen Nebeneffekte einer Mangelernährung zu limitieren. Bei Revisionseingriffen, d. h. nach Versagen eines restriktiven Eingriffs, muss der BPL auf 200 Zentimeter potenziert werden. Ahuja et al. untersuchten retrospektiv 101 Patienten, die einem MGB/OAGB unterzogen wurden und teilten die operierten Patienten je nach Länge des BPL in 150, 180 und 250 Zentimeter ein. Der %TWL war höher, je länger der BPL war (21,77 ± 7,620 vs. 36,55 ± 18,248 vs. 43,74 ± 18,84). Es zeigte sich ein signifikanter Unterschied zwischen 150 und 180 sowie 150 und 250 Zentimeter (p < 0,001). Hinsichtlich der Remission des DM2 und der arteriellen Hypertonie zeigte sich kein statistisch signifikanter Unterschied.
Die Gefahr der Malnutrition bei sehr langer BPL wird nicht durch Vorteile beim Gewichtsverlust aufgewogen
Hervorzuheben ist die Malnutrition an Vitamin D3 und B12, die statistisch signifikant höher in der 250-cm-BPL-Gruppe war. Ein Eisen- und Ferritinmangel war statistisch signifikant höher in der BPL-250-cm- im Vergleich zur BPL-150-cm-Gruppe. Ebenso waren der Protein- und Albuminmangel statistisch signifikant am höchsten in der BPL-250-cm-Gruppe. Zusammenfassend unterstreichen die Autoren das Einhalten einer Schlingenlänge von 150 Zentimeter für den BPL [25]. Mahawar kritisiert die Studiengruppen als ungleich, da der Ausgangs-BMI in dieser Studie unterschiedlich war und somit die Beurteilung der Gewichtsabnahme zu hinterfragen sei. Er unterstreicht jedoch auch die hohe Gefahr der 250-cm-BPL-Länge und die daraus resultierende erhöhte Mortalität [26]. Somit sind laut aktueller Evidenz bei einem verlängerten BPL weder die Besserung der Komorbiditäten noch der bessere Gewichtsverlust so prägnant, dass man die Gefahren der Malnutrition und die daraus resultierende erhöhte Morbidität in Kauf nehmen sollte.
Erneut zu unterstreichen ist auch das erhöhte Risiko der Malnutrition nach Distalisierung eines proximalen Roux-Y-Magen-Bypass bei Patienten mit Therapieversagen. Eine Verlängerung der alimentären Schlinge oder der biliopankreatischen Schlinge mit einem Common Channel unter 200 Zentimeter führt weder zu einer Besserung der Komorbiditäten, noch zu einer verbesserten Gewichtsabnahme. Lediglich das Risiko der Malnutrition steigt und birgt ein erhöhtes Mortalitätsrisiko [27]. Von der Distalisierung eines proximalen RYGB ist deshalb nach heutigem Stand der Dinge abzuraten. In seinem Review konnte Mahawar aufzeigen, dass die optimal ausgeschaltete Schlingenlänge, kombiniert beim RYGB oder einzeln beim MGB/OAGB, bei Patienten mit einem BMI bis 50 kg/m2 100 bis 200 Zentimeter beträgt. Ein Common Channel von mindestens 300 Zentimeter sollte immer gewahrt werden.
Eine aktuelle Listung der Prozeduren in Amerika belegt die zunehmende Rate an Revisionsoperationen
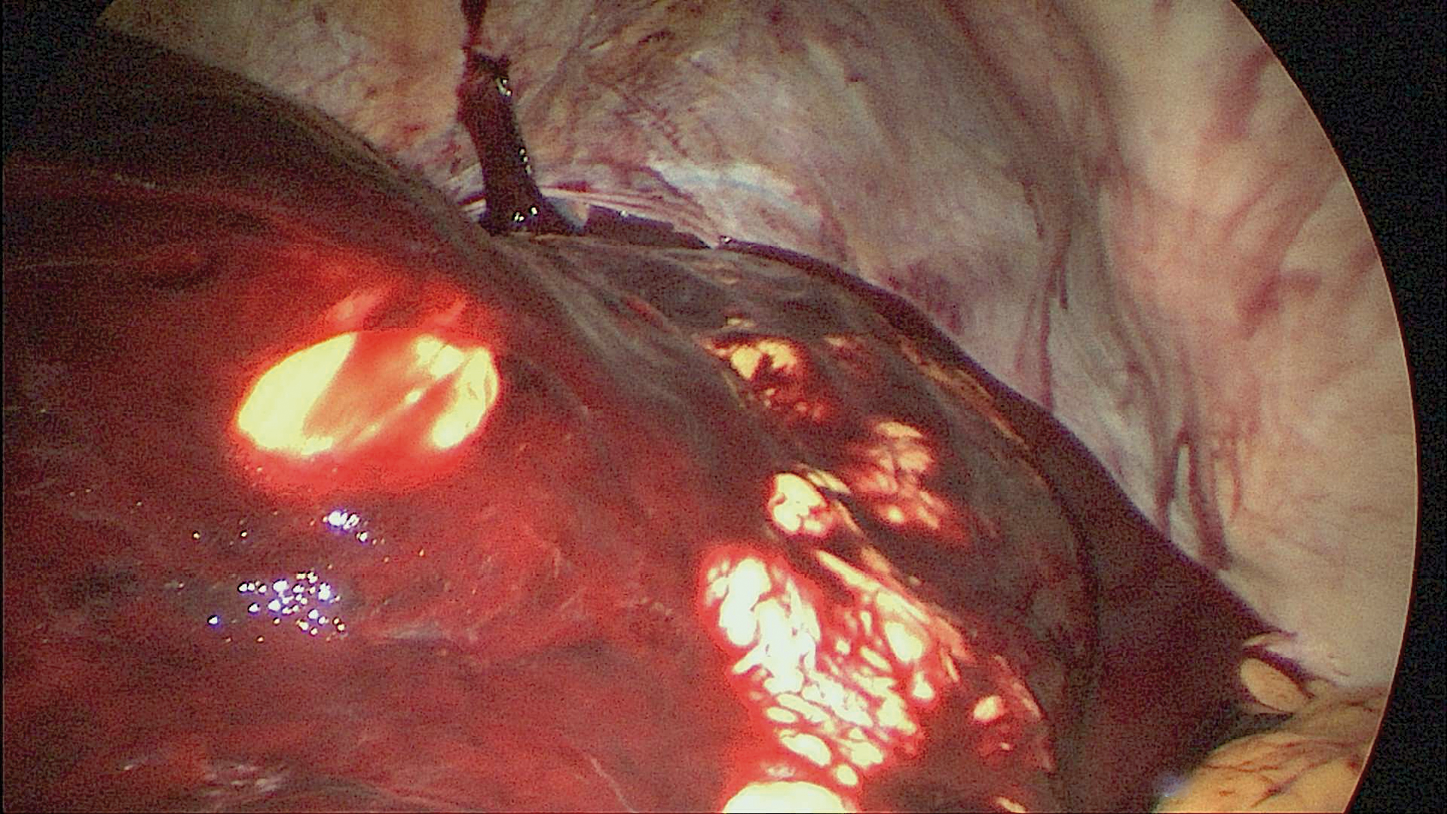
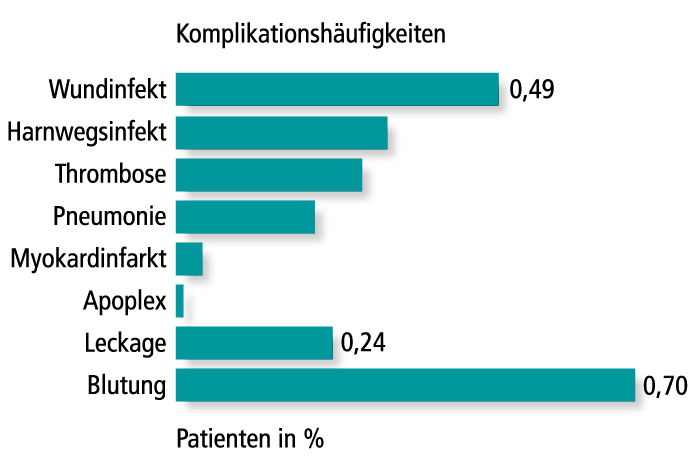
Das perioperative Risiko hat sich in der Adipositas- und metabolischen Chirurgie immer weiter verringert. Eine Auswertung von 135.413 Patienten von Daigle et al. ergab die Blutung (Abb. 4) mit einer Inzidenz von 0,7 Prozent und die Leckage mit 0,24 Prozent als häufigste chirurgische Major-Komplikationen [28] (Tab. 1). Im Komplikationsmanagement spielt mittlerweile die endoskopische Therapie neben der Chirurgie eine grundlegende Rolle. Vor allem die Therapie der SG-Leckage mittels Endo-VAC wird international immer häufiger eingesetzt und ergänzt die bis dato durchgeführte evidenzbasierte endoskopische Therapie der Leckage mittels Stent oder Pigtail-Katheter [29].
Eine aktuelle Listung der Prozeduren in Amerika belegt die zunehmende Rate an Revisionsoperationen. Betrug die Anzahl der Revisionen in den Jahren 2011 bis 2013 standhaft sechs Prozent, so zeigt sich 2016 ein Anstieg der Revisionsoperationen auf 13,9 Prozent [30]. Ob die Anzahl der Revisionsoperationen auf die gesteigerte Anzahl durchgeführter Schlauchmagenoperationen in den letzten Jahren zurückzuführen ist und welches der Standardverfahren die größte Rate an Revisionsoperationen birgt, bleibt zu erörtern. Grundsätzlich muss man sich davon distanzieren, die chronische Erkrankung Adipositas mit nur einem – nicht kausalen – adipositaschirurgischen Therapieverfahren beheben zu können. Lediglich flächendeckende Präventionsmaßnahmen können die chronische Krankheit Adipositas tatsächlich zurückdrängen.
Die Literaturliste erhalten Sie auf Nachfrage via passion_chirurgie@bdc.de.
Erstpublikation in Chirurgische Allgemeine, 19. Jahrgang, 10. Heft, 2018.
Chiappetta S, Weiner RA: Trends in der Adipositas- und metabolischen Chirurgie. Passion Chirurgie. 2019 Februar, 9(02): Artikel 03_02.