Infektionskrankheiten hatten noch zu Beginn des 20. Jahrhunderts vor allen anderen Erkrankungen hinsichtlich Morbidität und Mortalität die größte epidemiologische Bedeutung. In der ersten Hälfte des 20. Jahrhunderts kam es aufgrund verbesserter Hygiene-Bedingungen, Fortschritte in Diagnostik, Therapie und Immunprophylaxe zu einem bislang in der Menschheitsgeschichte vorher nie erreichten Erfolg bei der Verhütung, Erkennung und Bekämpfung von Infektionskrankheiten.
Im Mai 1945 fand die bisher größte „traumatische Epidemie“ – der zweite Weltkrieg – sein Ende. In Deutschland hat man zu diesem Zeitpunkt verschmutzte Trümmerwunden durch Wundauf- und -ausschneidung und nachhaltende Offenhaltung behandelt. Ziel war die saubere Sekundärheilung, unterstützt von Nähten im Granulationsstadium. 1944 erfolgte erstmalig ein Großeinsatz von Penicillin durch US-amerikanische Chirurgen und man schloss nach zeitgerechtem Debridement die Wunden locker, beschickte sie lokal über Drains mit Penicillin-Lösung und gab Penicillin auch systemisch. Trümmerwunden übelster Art, die vorher niemand zu schließen gewagt hätte, heilten nun primär.
1948 erschienen dann erste Berichte über die Anwendung von Penicillin in der Chirurgie mit „erstaunlichen, zum Teil lebensrettenden Erfolgen“ (von Oeynhausen, 1948). Später wurde das Antibiotikasortiment um das Streptomycin erweitert und 1951/52 standen dann Aureomycin, Chloramphenicol, später dann auch Neomycin, Tetracyclin, Polymyxin und Bacitracin zur Verfügung. Antibiotika halfen offenbar bei allen Problemen der Infektionschirurgie, man musste sie nur hoch genug dosieren, was bei Penicillin möglich war, bei den nachfolgenden Breitbandantibiotika aber schon auf Schwierigkeiten stieß. Die Antibiotika-Euphorie hatte die gesamte klinische Medizin ergriffen.
Bald gingen die Überlegungen in der operativen Medizin auch dahin, Antibiotika zur Verhütung postoperativer Wundinfektionen prophylaktisch einzusetzen. Das gefährliche an diesem Glauben an die Wirksamkeit der Antibiotika war, dass die bewährten Prinzipien der Anti- und Aseptik ins Wanken gerieten. Man glaubte, hygienische Nachlässigkeiten durch die prophylaktisch gegebenen Antibiotika ausgleichen zu können.
Bereits Anfang der 50er Jahre zeigte sich als erstes unerwartetes Ergebnis kritikloser Antibiotikaanwendung die Resistenz von Staphylokokken gegen Penicillin. Neuere und potentere Antibiotika halfen jedoch, diese Probleme zu überwinden.
Schon 1957 wurde eine Einschränkung des Antibiotikaverbrauchs und dafür die Beachtung der Regeln der Krankenhaushygiene gefordert. Hinweise, dass die Wundinfektionsraten nach aseptischen Operationen trotz Antibiotika in US-amerikanischen Kliniken nicht abgenommen habe, sondern signifikant angestiegen sei, wurden überhört. Anfang der 60er Jahre kamen aber aus den USA bereits die ersten Nachrichten über den Staphylokokken-Hospitalismus: Epidemieartige Häufungen von tödlichen Sepsisfällen, bei deren bakteriologischer Überprüfung schwere Lücken in der Anti- und Aseptik zutage traten und die Bedeutung der „Hauskeime“ für neu in das Krankenhaus aufgenommene Patienten erkennbar war.
Bis Anfang der 80er Jahre war man immer noch der Auffassung, dass der Kampf gegen die Infektionskrankheiten gewonnen sei und neue Infektionskrankheiten zukünftig durch Entwicklung von Impfstoffen vermieden oder durch Einsatz neuer Antibiotika behandelt werden könnten. Infolge dieser jahrelang vorherrschenden Situationsbeurteilung und der dadurch bedingten Selbstzufriedenheit und Gleichgültigkeit wurden Finanzmittel, die für die Verhütung, Erkennung, Überwachung und Forschung benötigt wurden, weltweit kontinuierlich gekürzt.
Das Auftreten und die Verbreitung multiresistenter bakterieller Infektionserreger betrifft besonders Krankenhäuser und vor allem Intensivtherapieeinheiten. Im Vordergrund stehen dabei Oxacillin-resistente Staphylokokken (MRSA), mehrfach-resistente Koagulase negative Staphylokokken, mehrfach- und gegen Glykopeptide resistente Enterokokken, mehrfach-resistente Enterobacter, Citrobacter, Serratia, Acinetobacter baumannii und Pseudomonas aeruginosa (MRGN). Wie am Beispiel der MRSA ersichtlich, wird ihre Ausbreitung durch Fehler in der Krankenhaushygiene und unpassendem Chemotherapeutikaeinsatz begünstigt.
Wenn wir die Geschichte zurückverfolgen, stellen wir fest, dass es immer wieder Zeiten gegeben hat, in denen Infektionserreger zur Häufung von Infektionen oder sogar Epidemien geführt haben, die Resistenzen gegen Desinfektionsmittel oder Antibiotika aufzeigten. In besonderem Umfang sind hierbei Intensivtherapiestationen, aber auch andere Bereiche des Krankenhauses mit breitem Antibiotikaeinsatz betroffen. Krankenhausinfektionen sind aufgrund einer Vielzahl neuer medizinischer Eingriffsmöglichkeiten, neuer therapeutischer Techniken, der Zunahme immunabwehrgeschwächter Patienten und dem Auftreten von Antibiotikaresistenzen bedeutsamer als je zuvor.
Wenn die meisten Antibiotika versagen und die chemotherapeutischen Möglichkeiten immer weniger werden, kann nur noch durch die strikte Einhaltung der Regeln der Hygiene eine Weiterverbreitung der Infektionskrankheiten unterbunden werden. Die zunehmende Bedrohung durch antibiotikaresistente Mikroorganismen ruft danach, neue und wirksamere Chemotherapeutika zu entwickeln. Da aber derartige Substanzen derzeit nicht in Sicht sind, hat die Einhaltung der Grundregeln der Hygiene als wichtigstes Instrument zur Vermeidung von Infektionskrankheiten und Epidemien zu gelten. Dazu gehören:
- Desinfektion,
- Sterilisation,
- das Tragen von Schutzkleidung (Handschuhe, Mund-/Nasen-Schutz, Haarschutz, Schutzkittel),
- das Erstellen und Einhalten von Hygieneplänen und
- die bauliche Gestaltung unter hygienischen Gesichtspunkten, die hygienisch funktionell einwandfreie Abläufe erst ermöglichen.
MRE im Krankenhaus
Infektionen durch MRE können immer noch mit den verfügbaren Antibiotika erfolgreich behandelt werden. Bakterielle Erreger, die gegen alle verfügbaren Antibiotika resistent sind, sind weltweit eine absolute Rarität oder kommen gar nicht vor. Eine bakterielle Infektion kann jedoch nur durch ein wirksames Antibiotikum bekämpft werden. Dieses ermittelt man ausschließlich durch Einsatz eines Antibiogramms.
Die Zahl der nosokomialen Infektionen hat sich seit dem Jahr 1988 kaum geändert. Es wird gern aufgeführt, dass heute kränkere Patienten behandelt werden können als vor 20 oder 30 Jahren. Stimmt! Aber gerade weil die Medizin so sensationelle Fortschritte gemacht hat, muss doch sicherstellt werden, dass die mit den modernsten Mitteln und Techniken behandelten Patienten auch von Infektionen unbeschadet und lebend das Krankenhaus wieder verlassen. Wenn dies nicht gesichert ist, dann sind alle vorangegangenen Bemühungen überflüssig!
Resistente Bakterien sind als Erreger nosokomialer Infektionen besonders gefährlich, da für eine Therapie nur noch wenige Antibiotika zur Verfügung stehen, diese aber frühzeitig zum Einsatz kommen müssen. Die Entstehung von Antibiotika-Resistenzen wird durch einen unsachgemäßen Antibiotika-Einsatz beschleunigt.
Konsequenzen sind längere und deutlich schwerere Krankheitsverläufe und vorzeitige Todesfälle. Dies betrifft Patientinnen und Patienten aller Altersgruppen. Gemeint sind die mehr als 40.000 Todesfälle pro Jahr, die Folge nosokomialer Infektionen sind. Dies liegt daran, dass zu oft und zu lange mit unwirksamen Antibiotika therapiert wird. So wird aus einer noch harmlosen Infektion eine todbringende Katastrophe. Das frühzeitig eingesetzte Antibiogramm ist das einzige Instrument zur erfolgreichen Bekämpfung multiresistenter Erreger.
MRE in der Praxis des niedergelassenen Arztes
In der aktuellen Situation erfolgt in über 90 Prozent eine ungezielte, kalkulierte Antibiotikatherapie. Die Auswahl des Antibiotikums findet nach Erregerverdacht statt, ohne konkret nachgewiesenen Erreger, ganz nach dem Zufallsprinzip.
Damit werden multiresistente Erreger selektiert und vermehrt. Deshalb muss die Verordnung von Antibiotika auf wissenschaftlicher Basis, unter Einsatz von Antibiogrammen (Synonym: Resistogramm) erfolgen.
Ein Antibiogramm (Kosten: ca. 6 Euro) ist das Ergebnis einer Antibiotika-Resistenzbestimmung. Es zeigt gegenüber welchen Antibiotika ein bestimmter bakterieller Krankheitserreger resistent oder sensibel ist. Deshalb immer gezielte Antibiotikatherapie nach Antibiogramm mit konkret nachgewiesenem Erreger.
Fachinformation zu COTRIM forte – Patientenhinweis
Jede Anwendung von Antibiotika kann zur Vermehrung von Erregern führen, die gegen das eingesetzte Arzneimittel unempfindlich (resistent) sind.
Diagnose Infektion in der Arztpraxis
- Entnahme des infektiösen Materials (Urin, Wundabstrich, Trachealsekret, Blut)
- Im Notfall „kalkulierte Therapie“ einleiten und parallel
- Material ins Labor schicken (Transportdauer längstens 2 Std.).
- Anlage einer Kultur mit Antibiogramm (Ergebnis liegt nach ca. 48 Std vor).
- Der behandelnde Arzt erhält das Antibiogramm vom Labor per E-Mail (30 Sek.).
- Der behandelnde Arzt prüft nun, ob das ggf. bereits verordnete Antibiotikum wirksam ist und
- wählt ein wirksames Antibiotikum aus.
- Der Patient erhält vom Arzt ein Rezept für das wirksame Antibiotikum.
- So erhält der Patient spätestens nach 48 Std immer ein wirksames Antibiotikum, auch bei einer Infektion durch multiresistente Erreger.
Dieser Weg ist der Einzige um Infektionen durch multiresistente Erreger erfolgreich zu therapieren und flächendeckend zu bekämpfen. Kein Arzt kann mit bloßem Auge erkennen, welcher Erreger die Infektion verursacht. Selbst wenn der erfahrene Arzt den Infektionserreger erahnen kann, so kann er dennoch keine Resistenzen ohne Antibiogramm ermitteln. Jede Antibiotikagabe, die den Krankheitserreger nicht vernichtet, schadet dem Patienten und begünstigt die Zunahme multiresistenter Erreger.
„BKK-Landesverband NORDWEST fordert verbindliche Regelung für eine sachgerechte Antibiotikatherapie gegen multiresistente Keime
Die Entstehung von Antibiotika-Resistenzen wird durch unsachgemäßen Antibiotika-Einsatz beschleunigt. Schwerere Krankheitsverläufe und vorzeitige Todesfälle in allen Altersgruppen sind die Folge.
Die Bundesregierung hat in den vergangenen Jahren neue Maßnahmen entwickelt, um die Entstehung von behandlungsassoziierten Infektionen und Antibiotika-Resistenzen zu verringern, doch sind die bisherigen Erfolge nicht zufriedenstellend.
Mit der Deutschen Antibiotika-Resistenzstrategie wurden Schritte zur Eindämmung von Antibiotika-Resistenzen eingeleitet; allerdings fehlt die wichtigste Maßnahme, das Antibiogramm.
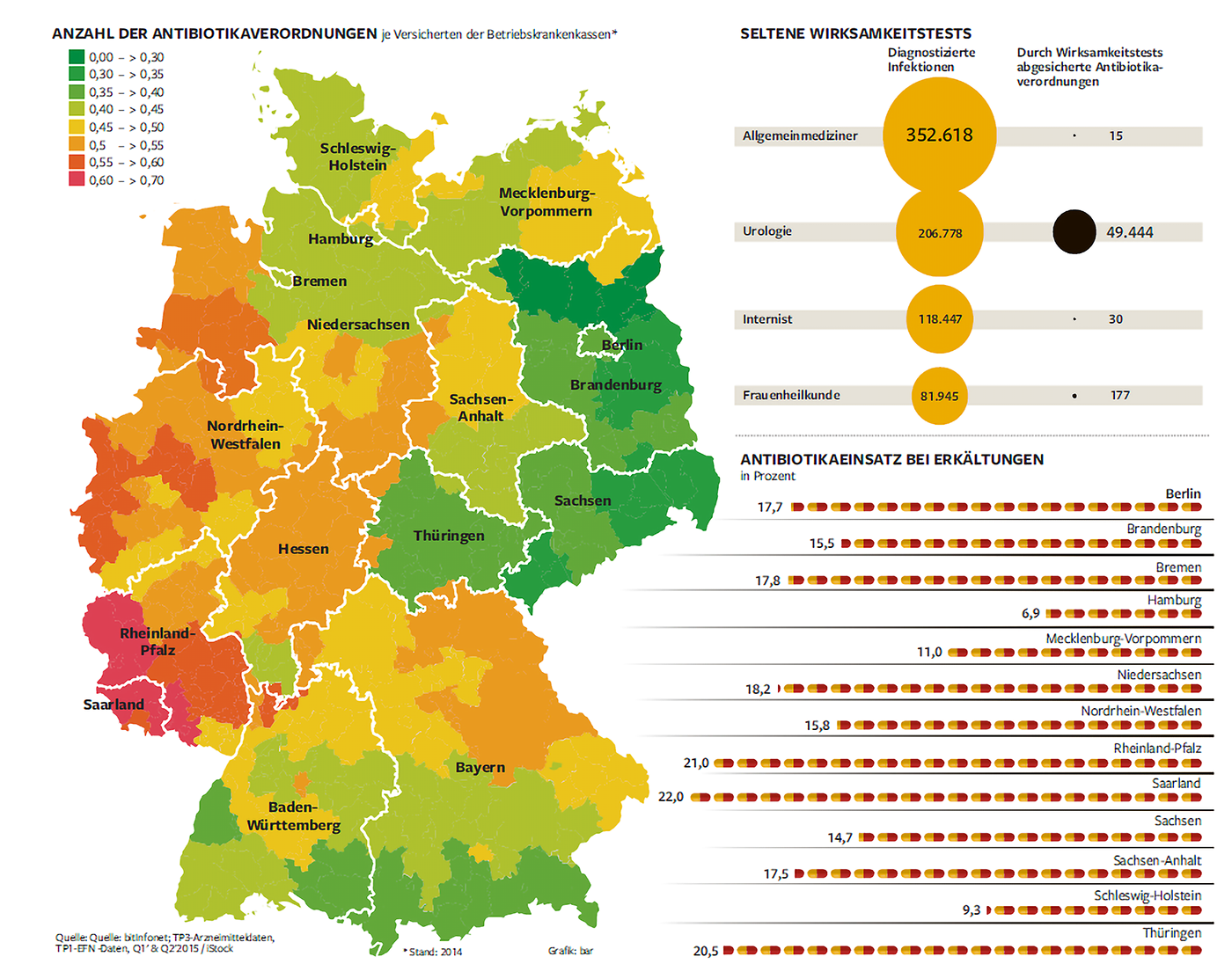
In einer groß angelegten Auswertung untersuchten die BKK-Landesverbände NORDWEST und Mitte die Verordnungshäufigkeit von Antibiotika in 13 Bundesländern.
Von den 6.8 Mio. Versicherten erhielten im Untersuchungszeitraum von 18 Monaten ca. 1,7 Mio. Versicherte mindestens einmal ein Antibiotikum.“
Abb. 1: Anzahl der Antibiotikaverordnungen 2014
Für die Idee und Umsetzung eines Strukturvertrages zur Reduzierung von Antibiotika-Verschreibungen durch Antibiogramme wurde der BKK-Landesverband NORDWEST mit dem Gesundheitsaward 2017 ausgezeichnet.
Fazit
Wenn wir den Kampf gegen multiresistente Erreger gewinnen wollen, dann brauchen wir dringend eine Regelung, die vorsieht, dass Antibiotika vor ihrem Einsatz auf Wirksamkeit geprüft werden. Sonst rutschen wir in eine Postantibiotika-Ära, die uns hygienisch-mikrobiologisch ins Mittelalter zurückwirft.
Die vor uns liegende, bereits tickende Zeitbombe zu entschärfen, ist Aufgabe der Mediziner, wird auch in entscheidendem Maße vom Gesundheitsminister abhängen, denn er macht die erforderlichen Gesetze.
Zastrow KD: Multiresistente Erreger – Folge fehlerhafter Antibiotikatherapie. Passion Chirurgie. 2018 Dezember; 8(12): Artikel 04_11.