01.08.2021 Fachgebiete
Update „Stuhlinkontinenz“

Einleitung
Die Therapie der Stuhlinkontinenz sollte nach zielgerichteter Diagnostik individualisiert und stufenweise erfolgen, um mit geringstmöglicher Invasivität einen größtmöglichen Therapieeffekt zu erreichen. Therapeutische Zielsetzungen sind die Symptomlinderung und die Verbesserung der Lebensqualität.
Primär werden konservative Therapieverfahren angewendet. Hierbei haben sich Kombinationstherapien als besonders wirksam erwiesen. Chirurgische Therapien sind in Betracht zu ziehen, wenn konservative Maßnahmen nicht zu ausreichender Symptomlinderung führen. Therapeutisch kommen Sphinkterplastik, Sphinkteraugmentation, Neuromodulation und anatomische Rekonstruktion des hinteren Beckenbodenkompartiments zum Einsatz. Der Langzeiterfolg der Sphinkterplastik ist gering. Die nachhaltige klinische Wirksamkeit der sakralen Neuromodulation ist etabliert. Bulking Agents erscheinen bei passiver Stuhlinkontinenz indiziert. Erste Ergebnisse zum SphinKeeper sind vielversprechend. Stuhlinkontinenz im Rahmen einer maskierten Stuhlentleerungsstörung wird zunehmend mittels ventraler Netzrektopexie behandelt.
Prävalenz und Ätiologie
Bei der Stuhlinkontinenz handelt es sich um ein häufig unterschätztes Krankheitsbild mit erheblichem Leidensdruck und signifikanter Einschränkung der Lebensqualität bei einem Großteil der Betroffenen [1, 2]. Ihre Prävalenz wird mit 5,9 % bis 8,4 % angegeben, im Rahmen von anonymen Befragungen in der Allgemeinbevölkerung sogar mit bis zu 12,4 % [3, 4]. Stuhlinkontinenz tritt nicht nur im Alter auf, ist jedoch deutlich altersabhängig: In Altersheimen wird von einer Prävalenz von bis zu 47 % berichtet [1, 5]. Als Folge von Stuhlinkontinenz fallen signifikante Kosten durch notwendige Diagnostik, Therapie und Pflegebedürftigkeit sowie Produktivitätsverlust und Arbeitsunfähigkeit an [6, 7]. Es ist zu erwarten, dass aufgrund des demografischen Wandels das Krankheitsbild in Zukunft an Bedeutung gewinnen wird.
Stuhlinkontinenz stellt keine genuine Entität dar, sie ist ein Symptom. Ihre möglichen Ursachen sind vielfältig.
Klassifikation
Die anale Inkontinenz ist gemäß der International Consultation on Incontinence (ICI) definiert als der wiederholte, ungewollte anale Abgang von Stuhl und/oder Gasen und/oder Schleim [8].
Das Ausmaß der analen Inkontinenz kann erheblich variieren und wird im deutschsprachigen Raum häufig in drei Schweregrade klassifiziert (Tab. 1). Die Klassifikation suggeriert, dass die Unfähigkeit, festen Stuhl zu kontrollieren, die gravierendste Form der Stuhlinkontinenz ist; Patienten bewerten Grad II als die belastendste Art der Inkontinenz.
Tab. 1: Klassifikation der Inkontinenz
|
Grad |
Beschreibung |
|
Grad I |
Unfähigkeit, Darmgase zu kontrollieren |
|
Grad II |
Unfähigkeit, flüssigen Stuhl zu kontrollieren |
|
Grad III |
Unfähigkeit, festen Stuhl zu kontrollieren |
Im englischsprachigen Raum findet sich oft die Unterscheidung zwischen passiver Inkontinenz und Dranginkontinenz. Ob der unkontrollierbare Stuhlverlust nicht spürbar (sensorisch) oder nicht willentlich verzögerbar ist, kann Hinweise auf die zugrundeliegende Pathophysiologie geben. Beide Formen können vergesellschaftet auftreten.
Als Sekundärinkontinenz wird Inkontinenz infolge einer anderen Erkrankung bezeichnet, zum Beispiel bei entzündlichen Darmerkrankungen oder kolorektalem Karzinom.
Diagnostik und Differentialdiagnostik
Aus medizinischen und auch aus ökonomischen Gründen ist es sinnvoll, eine schrittweise, praxisorientierte Diagnostik durchzuführen (Tab. 2).
Tab. 2: Stufendiagnostik der Stuhlinkontinenz [9]
|
Stufe |
Diagnostische Maßnahmen |
|
Basisdiagnostik |
– Anamnese – Erhebung von Scores – Führen eines Stuhltagebuchs (+ ggf. Ernährungstagebuchs) – Klinische Untersuchung (Inspektion, Palpation, Proktoskopie, Rektoskopie) mit Defäkationssimulation (Valsalva) und Testung der anorektalen Sensibilität |
|
Ergänzende Diagnostik |
– Anorektale Endosonographie – Anorektale Manometrie – Koloskopie mit ggf. Stufenbiopsien – Defäkographie (konventionell, MRT) |
|
Erweiterte Diagnostik |
– Neurologische Untersuchungen (Basisuntersuchung, Beckenboden-EMG, Pudendusdiagnostik) – Ergänzende Bildgebung (MRT, CT, Kolontransitzeit) – Konsiliaruntersuchung (Gynäkologie, Urologie) |
Die Verwendung von Stuhltagebüchern, standardisierten Fragebögen sowie generalisierten und krankheitsspezifischen Lebensqualitäts-Scores hilft, die Symptome im Detail zu dokumentieren und das Ausmaß der Beschwerden und ihren Einfluss auf die Lebensqualität zu quantifizieren.
Die am häufigsten verwendeten Scoring-Systeme sind der Cleveland Clinic Incontinence Score [10] und der St. Mark’s Incontinence Score [11]. Die Bristol Stool Charts [12, 13] erlauben es, die Stuhlkonsistenz anhand einer 7-Punkte-Skala zu klassifizieren.
Die Erfassung der Lebensqualität ist für das therapeutische Vorgehen grundlegend. Die subjektive Wahrnehmung der Stuhlinkontinenz und die Einbuße an Lebensqualität variieren erheblich: Zum einen ist die Korrelation von Symptomschwere und Einschränkung der Lebensqualität nicht linear. Zum anderen ist das Vermögen, mit der Inkontinenzsymptomatik umzugehen, individuell sehr unterschiedlich und von einer Vielzahl von Faktoren (zum Beispiel Berufstätigkeit, soziales Umfeld) abhängig. Die Lebensqualität wird meist durch krankheitsunspezifische Scoring-Systeme (z. B. SF36) und krankheitsspezifische Scores erfasst, wie z. B. dem Fecal Incontinence Quality of Life (FIQoL)-Instrument, das versucht, Einschränkungen in vier verschiedenen Kategorien (Lifestyle, Coping, Behavior, Depression and Awareness) zu quantifizieren [14]. Diese Score-Messinstrumente werden auch eingesetzt, um die klinische Wirksamkeit therapeutischer Interventionen zu evaluieren. In jüngster Zeit gewinnen zunehmend Patient Reported Outcome Measures (PROMs) bei der Beurteilung der klinischen Relevanz des Inkontinenzleidens und des Behandlungsergebnisses an Bedeutung.
Differentialdiagnostisch ist weiterhin wesentlich, ob das Symptom der Inkontinenz Sekundärphänomen, zum Beispiel von malignen, entzündlichen oder funktionellen Erkrankungen, insbesondere einer Stuhlentleerungsstörung, ist.
Therapieziele
Eine auf die Stuhlinkontinenz zielende Behandlung sollte erst initiiert werden, wenn alle sekundären Formen der Inkontinenz ausgeschlossen sind. Das Ziel der Behandlung ist die Symptomlinderung (Senkung der Häufigkeit und Schwere der Inkontinenzepisoden) und damit die Verbesserung der Lebensqualität. Da der Zusammenhang zwischen der Schwere des Inkontinenzleidens und der Minderung der Lebensqualität nicht linear ist, kann selbst eine nur moderate Verbesserung der Inkontinenz zu einer erheblichen Verbesserung der Lebensqualität führen.
Aufgrund der vielfältigen Ursachen der Stuhlinkontinenz sowie der unterschiedlichen Ausprägung der klinischen Symptome besteht für die Behandlung keine einheitliche, allgemein gültige Therapieempfehlung. Vielmehr sollte nach entsprechender Diagnostik ein individuelles Therapiekonzept für jeden Patienten gefunden werden [15, 16, 17]. Die Therapie erfolgt stufenweise, um mit geringstmöglicher therapeutischer Invasivität eine größtmögliche Symptomlinderung und Patientenzufriedenheit zu erreichen. Nicht selten kommen Kombinationen aus mehreren Behandlungskonzepten (konservativ, operativ) zum Einsatz, da diese effektiver als einzelne Therapien sein können.
Indikationsstellung und Therapiealternativen (konservativ, operativ)
Die Therapie ist an die individuellen Bedürfnisse und Erwartungen des Patienten anzupassen und abhängig von den pathomorphologischen und pathophysiologischen Gegebenheiten. Folgende Grundprinzipien sollten beachtet werden:
•von nicht invasiver zu invasiver Behandlung
•chirurgische Behandlung (Tab. 3) ist indiziert, falls konservative Maßnahmen nicht zu ausreichender Symptomlinderung führen
Tab. 3: Vergleich der chirurgischen Behandlungsverfahren einer Stuhlinkontinenz in Hinblick auf das Indikationsspektrum, die Effizienz, die Morbidität und den Empfehlungsgrad von ICI und American Society of Colon and Rectal Surgeons (ASCRS). (in Anlehnung [9])
|
Sphinkteroplastik |
Sphinkteraugmentation (Bulking Agents (BA), Gatekeeper (GK) Spinkeeper (SK) |
Neuromodulation (SNM, PTNS) |
Kolostoma |
Ventrale Netzrektopexie |
|
|
Einsatz/ Indikation |
Definierter Sphinkterdefekt |
Passive Stuhlinkontinenz |
Breites Indikationsspektrum, für Patienten mit und ohne Sphinkterdefekt geeignet |
Patienten mit fehlgeschlagenen anderen Therapieoptionen oder Patienten, die keine anderen Therapien wünschen |
Stuhlinkontinenz im Rahmen von Senkungen des hinteren Beckenorgan/-bodenkompartments |
|
Effizienz |
Kurzzeitverlauf: Verbesserung in bis zu 86 % der Patienten Langzeitverlauf: Nach 5–10 Jahren ca. 25–4 0% kontinent Hohe Zufriedenheit |
BA: 52 % der Patienten mit einer mind. 50%igen Reduktion der Inkontinenzepisoden, keine Langzeitergebnisse GK: 56 % der Patienten mit mind. 75%igen Verbesserung der Inkontinenzparameter, 13 % vollständig kontinent, keine Langzeitergebnisse SK: 52 % der Patienten mit mind. 50%igen Verbesserung der Inkontinenzparameter, 11% vollständig kontinent, keine Langzeitergebnisse |
SNS: 71–89 % der Patienten mit einer mind. 50%igen Verbesserung, konstanter Therapieeffekt auch im Mittel- und Langzeitverlauf, signifikante Verbesserung der Lebensqualität PTNS: 38 % der Patienten mit mind. 50%iger Verbesserung, allerdings auch mind. 50%ige Verbesserung bei 31 % der Patienten mit Placebobehandlung |
80 % der Patienten mit Stuhlinkontinenz, bei denen ein Stoma angelegt wurde, würden sich wieder für eine Stomaanlage entscheiden |
Bei 20–92 % der Patienten zeigte sich eine Verbesserung der Stuhlinkontinenz, die mediane Verbesserung des FISI (Feacal Incontinence Severity Index) liegt bei 16–25 Punkten, bisher begrenzte Langzeitergebnisse |
|
Morbidität |
Moderat |
BA, GK: Gering |
Gering |
Moderat |
Moderat |
|
ICI-Empfehlungsgrad |
C |
BA: C |
SNM: B PTNS: D |
C |
C* |
|
Empfehlung Guideline American Society of Colon and Rectal Surgeons |
Einsatz bei definiertem Sphinkterdefekt sinnvoll Empfehlung: stark Evidenzqualität: moderat |
BA, GK: Bei Patienten mit passiver Stuhlinkontinenz Empfehlung: schwach Evidenzqualität: moderat (BA, GK) SK: bislang kein Empfehlungsgrad vorliegend |
SNM: Chirurgische Erstlinientherapie PTNS: Einsatz möglich Empfehlung: stark (SNM), schwach (PTNS) Evidenzqualität: moderat (SNM), gering (PTNS) |
Option für Patienten, bei denen andere Therapieoptionen fehlgeschlagen sind oder welche keine anderen Methoden wünschen Evidenzqualität: gering |
Bei Stuhlinkontinenz als Folge einer anatomischen Pathologie (u.a. Senkungen des hinteren Beckenorgan/- bodenkomparti-ments) Empfehlung: stark* Evidenzqualität: gering* |
* Diese Empfehlungen beziehen sich auf die Korrektur anatomischer Pathologien, welche eine Stuhlinkontinenz bedingen, und nicht explizit auf die Durchführung einer ventralen Netzrektopexie.
Konservative Therapie
Die primäre Therapie der Stuhlinkontinenz ist konservativ und zielt auf eine Verbesserung der Stuhlkonsistenz, eine kontrollierte, möglichst vollständige Stuhlentleerung und eine Kräftigung von Beckenboden und Analsphinkter ab. Hierfür kommen sowohl medikamentöse Therapieansätze (Quellmittel, Peristaltikhemmer) als auch verschiedene Darm- und Schließmuskeltrainingsprogramme (anale Irrigation, Biofeedbacktraining) zum Einsatz. Die verschiedenen konservativen Verfahren können einzeln, sequenziell oder kombiniert angewendet werden. Dabei ist die Kombination mehrerer Behandlungsverfahren manchmal effektiver als der Einsatz einer einzelnen Methode. So zeigte der Vergleich einer Monotherapie (Biofeedbacktraining, medikamentöse Therapie) mit einer Kombinationstherapie beider Maßnahmen, dass unter Kombinationstherapie ein signifikant besseres Therapieergebnis erzielt wurde [18].
Operative Therapieverfahren
Zur führenden Therapie hat sich in den letzten Jahren aufgrund des konstanten Behandlungserfolgs im Langzeitverlauf bei gleichzeitig geringer Morbidität die sakrale Neuromodulation (SNM, auch Sakralnervstimulation (SNS) genannt) entwickelt. Hierbei werden in Lokal- oder Allgemeinanästhesie in Seldinger-Technik Elektroden im Bereich der ventralen Öffnung der sakralen Foramina S3 oder S4 platziert und mit einem Impulsgeber zur Niederfrequenzstimulation verbunden. Üblicherweise erfolgt zunächst eine mehrwöchige Testphase mit einem externen Impulsgeber. Bei hinreichender klinischer Wirksamkeit (≥ 50 % Symptomverbesserung hinsichtlich der Häufigkeit von Inkontinenzepisoden) wird ein permanentes System mit einem meist gluteal positionierten Impulsgeber implantiert. In den letzten Jahren konnte die therapeutische Effektivität mit Erfolgsraten von 89 % und einer mit der Normalbevölkerung vergleichbaren Lebensqualität auch an großen Patientenkollektiven und im Langzeitverlauf überzeugend nachgewiesen werden [19, 20]. Zudem hat sich das Indikationsspektum erweitert und umfasst mittlerweile multiple Entitäten der Stuhlinkontinenz. Auch bei Vorliegen eines Sphinkterdefekts kann eine SNM therapeutisch effektiv sein. Durch die gleichzeitig geringe Invasivität und das niedrige Komplikationsrisiko mit Explantationsraten von 1,7 bis 6,25 % [21] konnte sich die SNM als Goldstandard in der operativen Inkontinenztherapie etablieren.
Keine breite Anwendung findet bisher hingegen die Nervus tibialis posterior-Stimulation (PTNS). Dieses einfach durchzuführende, ambulante Neuromodulationsverfahren, bei dem der Nervus tibialis posterior über dem medialen Malleolus mittels Pflaster- oder Nadelelektrode wiederholt stimuliert wird, konnte in zwei randomisierten Studien keine signifikante Überlegenheit gegenüber einer Scheinbehandlung zeigen [22, 23]. Zwar deutet eine Ex-post-Subanalyse der Daten darauf hin, dass das Verfahren bei Dranginkontinenz effizienter sein könnte [24], eine generelle Empfehlung zur Anwendung kann zum jetzigen Zeitpunkt jedoch nicht gegeben werden.
Eine weitere therapeutische Option stellt die Sphinkterplastik dar, bei der eine Lücke im Sphinkter ani externus und/oder internus durch Naht der verbliebenen Muskelbäuche verschlossen wird. Zwar führt die Rekonstruktion des Analsphinkters zu günstigen Kurzzeitergebnissen mit einer Verbesserung der Kontinenzleistung bei der Mehrzahl der Patienten. Im Langzeitverlauf verschlechtert sich diese jedoch erheblich, so dass nach 7 bis 10 Jahren bei mehr als der Hälfte der Operierten keine klinische Wirksamkeit mehr besteht. Trotz der nachlassenden Wirkung bleiben bis zu 40 % der Patienten mit dem Ergebnis jedoch zufrieden [25]. Im Therapiealgorithmus ist die Sphinkterplastik vor allem bei großen Sphinkterdefekten > 120° insbesondere nach geburtshilflichen Traumata angesiedelt.
Die Verfahren der Sphinkteraugmentation zielen darauf ab, die residuale Schließmuskelfunktion zu verstärken. Dabei werden sog. Bulking Agents (z. B. Silikon, Kollagen, Dextranomer in Hyaloronsäure (NASHA-DX)) palpatorisch oder ultraschallgesteuert submukosal oder intersphinktär in den Schließmuskel injiziert. 2017 konnte eine Übersichtsanalyse von 889 Patienten in 23 Studien zeigen, dass sich nach einem mittleren Follow-up von 23,7 Monaten der Cleveland Clinic Incontinence Score deutlich verbessert hatte [26]. Im Vergleich zur Neuromodulation erwies sich die Injektion von Permacol hinsichtlich der Reduktion des St. Marks Inkontinenzscores und der Verbesserung der Lebensqualität jedoch als deutlich unterlegen [27]. Vor allem Patienten mit passiver Stuhlinkontinenz scheinen von dieser Methode zu profitieren.
Ein weiteres Augmentationsverfahren stellt die Injektion von „Gatekeeper“ bzw. der Weiterentwicklung „SphinKeeper“ dar. Unter endosonographischer Kontrolle werden selbstexpandierende Implantate aus Polyacrylonitril an 6 bzw. 10 Positionen im Intersphinktärraum positioniert. Die anschließende Vergrößerung der Implantate führt zu einer Verbesserung der Inkontinenz- und Lebensqualitätsscores [28, 29, 30, 31]. Für eine generelle Therapieempfehlung ist die Datenlage momentan aber noch nicht ausreichend.
Die Schließmuskelaugmentation mittels magnetischem Sphinkter (Ring aus Titanperlen mit Magnetkern, der um den externen analen Sphinkter gelegt wird) ist derzeit hingegen nicht mehr verfügbar. Gleiches gilt für Schließmuskelersatzverfahren wie die dynamische Graciloplastik und den Artificial Bowel Sphincter.
Da sich Stuhlinkontinenz auch als Symptom einer Entleerungsstörung präsentieren kann, hat sich die ventrale Netzrektopexie zur Therapie bei morphologischen Veränderungen des hinteren Beckenbodenkompartiments (z. B. Intussuszeption, Enterocele, Rectocele, Rektumvollwandprolaps) im chirurgischen Behandlungsalgorithmus etabliert. Dieses nichtresezierende, organerhaltende Vorgehen ohne die Notwendigkeit einer Anastomose, das sowohl konventionell laparoskopisch als auch roboter-assistiert durchgeführt werden kann, setzt sich zunehmend als effektives, sicheres und rezidivarmes Verfahren durch [32, 33, 34]. Oft resultiert die anatomische Rekonstruktion des hinteren Beckenbodenkompartiments unter Verwendung eines biologischen oder synthetischen Netzes in einer signifikanten Verbesserung der Stuhlinkontinenz [33, 34].
Für andere vielversprechende Therapieansätze wie die Stammzelltherapie werden in naher Zukunft weiterführende Daten erwartet.
Die Anlage eines Stomas bleibt weiterhin eine Therapieoption der Stuhlinkontinenz bei Scheitern der anderen chirurgischen Behandlungsverfahren oder entsprechendem Patientenwunsch.
Fazit
Die Therapie der Stuhlinkontinenz sollte nach zielgerichteter Diagnostik individualisiert und stufenweise erfolgen, um mit geringstmöglicher therapeutischer Invasivität einen größtmöglichen Therapieeffekt zu erreichen. Therapeutische Zielsetzung ist die Symptomlinderung und in der Folge die Verbesserung der Lebensqualität.
Studien der letzten Jahre haben folgende Aspekte hervorgehoben: Patient Reported Outcome Measures (PROMs) gewinnen bei der Beurteilung des Behandlungsergebnisses an Bedeutung. Primär kommen konservative Therapiemaßnahmen zum Einsatz. Im Rahmen der konservativen Inkontinenztherapie haben sich Kombinationstherapien als besonders wirksam erwiesen. Chirurgische Therapien sind in Betracht zu ziehen, wenn konservative Maßnahmen zu einer unzureichenden Symptomlinderung führen. Der Langzeiterfolg der Sphinkterplastik ist gering. Die Evidenz der nachhaltigen klinischen Wirksamkeit der sakralen Neuromodulation wächst und bekräftigt damit die Bedeutung der SNM als führende Therapie unter den chirurgischen Behandlungsmöglichkeiten. Bulking Agents stellen eine Therapieoption bei passiver Stuhlinkontinenz dar, wenngleich die Evidenz aufgrund der unterschiedlichen verwendeten Substanzen und Techniken sowie fehlender Langzeitergebnisse eingeschränkt ist. Zur Behandlung einer Stuhlinkontinenz im Rahmen einer maskierten Stuhlentleerungsstörung etabliert sich die ventrale Netzrektopexie. Mehrere in der Vergangenheit angewendete chirurgische Verfahren stehen aktuell nicht mehr zur Verfügung: magnetischer Sphinkter, dynamische Graziloplastik, Artificial Bowel Sphincter. Neuere Verfahren bedürfen der weiteren Evaluierung: Die aktuelle Datenlage erlaubt noch keine dezidierte Empfehlung für Gatekeeper/SphinKeeper und die Nervus tibialis posterior Stimulation. Für neuere Therapieansätze wie der Stammzelltherapie werden weiterführende Daten erwartet.
In Zusammenschau der aktuellen Literatur [8] ergibt sich hinsichtlich der chirurgischen Therapie der Stuhlinkontinenz derzeit folgende Therapieempfehlung der International Consultation on Incontinence (ICI); Abb. 1.
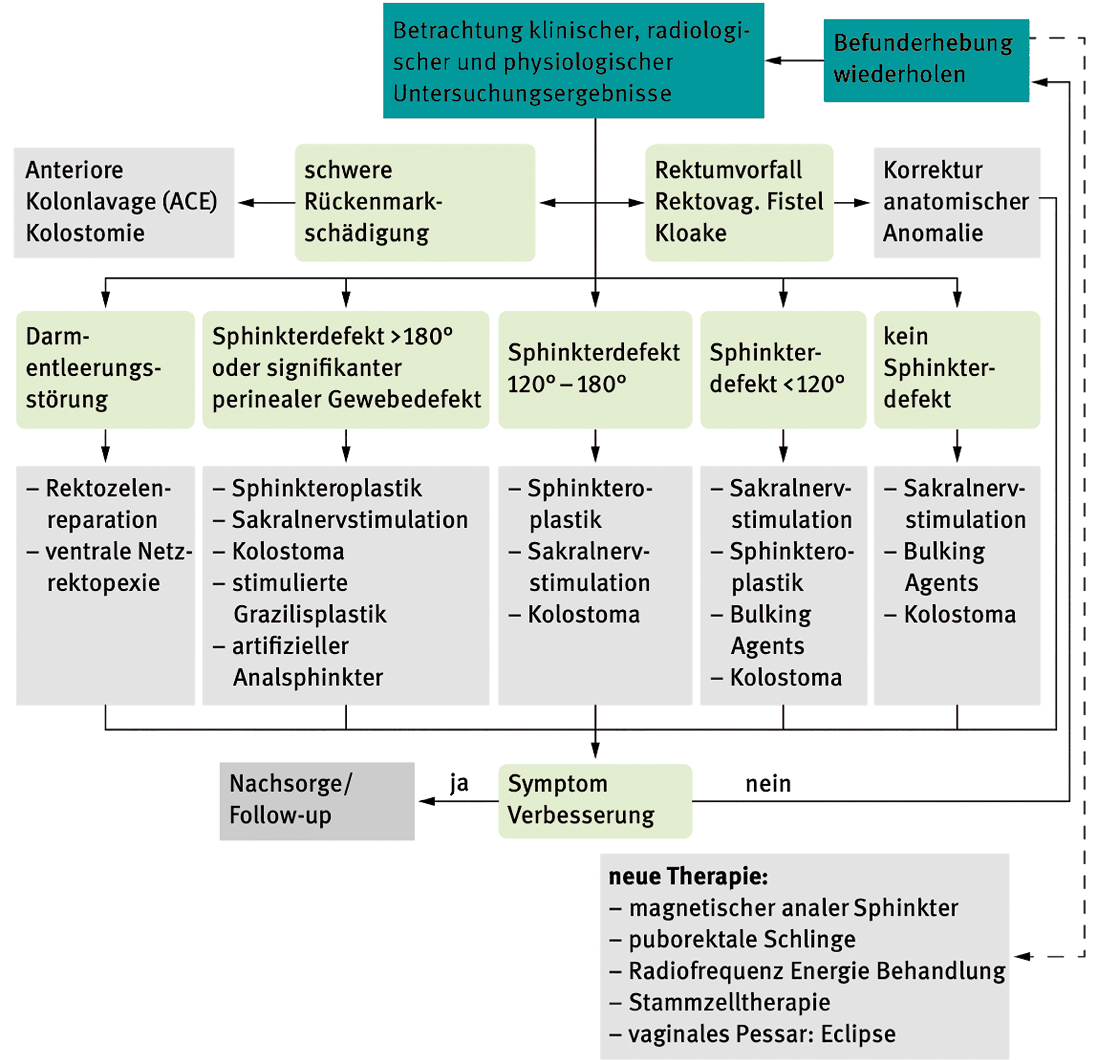
Abbildung 1: Algorithmus der chirurgischen Therapie der Stuhlinkontinenz [8] (dynamische Graziloplastik, artifizieller Analsphinkter, magnetischer Analsphinkter aktuell nicht verfügbar)
Literatur
Die Literaturliste zu diesem Beitrag erhalten Sie auf Nachfrage bei der Redaktion (passion_chirurgie@bdc.de).
Matzel K E, Bittorf B: Update „Stuhlinkontinenz“. Passion Chirurgie. 2021 Juli/August; 11(07/08): Artikel 03_02.
Autoren des Artikels
Prof. Dr. med. Klaus Matzel
Chirurgische Klinik der Universität ErlangenKrankenhausstr. 1291052Erlangen kontaktierenPD Dr. med. Birgit Bittorf
Chirurgische Klinik der Universität ErlangenKrankenhausstr. 1291052Erlangen kontaktierenWeitere aktuelle Artikel
17.06.2025 Abrechnung
Aktive Bewegungsschiene nach Kreuzbandriss wird keine ambulante Kassenleistung
Die Verordnung passiver Motorschienen ist nach wie vor möglich.
09.05.2025 BDC|News
Update zur Wundversorgung
Nahezu 1 Million behandlungsbedürftige Fälle von chronischen oder schlecht heilenden Wunden, Kosten für das Gesundheitssystem von geschätzt 8 Mrd. Euro werden als Belastung für das deutsche Gesundheitswesen bezeichnet.
01.05.2025 Fachübergreifend
Die Rolle der Chirurgie in der Versorgung chronischer Wunden
Das deutsche Gesundheitssystem steht in den nächsten Jahren vor immensen Herausforderungen. Die politisch gewünschte Zentralisierung und hieraus folgende Reduzierung stationärer Leistungserbringer sowie die Verschiebung von Behandlungen in den ambulanten Sektor wird auch für die Versorgung von Menschen mit chronischen Wunden zu noch nicht absehbaren Verwerfungen und vermutlich auch zu einer Verschlechterung der Behandlungsqualität, der ohnehin oftmals bereits unterversorgten Patienten führen.
01.05.2025 Fachübergreifend
Was benötigen spezialisierte Leistungserbringer zur Behandlung schwer heilender und chronischer Wunden von Chirurg:innen für eine gute Zusammenarbeit
Wunden haben immer eine Ursache. Sie sind Folge eines Ereignisses oder Symptom einer Erkrankung. Interne Faktoren, wie zum Beispiel Erkrankungen der Atemwege, des Verdauungs-, Herz-Kreislauf-, des Immunsystems oder Funktionsverlust der Haut können zusätzlich die physiologischen Mechanismen der Wundheilung stören.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.