01.04.2019 Gefäßchirurgie
Die Chirurgie des (Dialyse) Gefäßzugangs als komplexe, hochspannende induktive Prozesschirurgie

Mit dem Verlust der Nabelschnur verliert der Mensch die Fähigkeit zum konvektiven Stoff(Volumen)austausch mit der Umgebung. Dieser Austausch ist kurz- oder (intermittierend) langfristig z. B. für einen extrakorporalen Kreislauf (apparativer Ersatz von Herz- oder exkretorischer Nierenfunktion, Apheresetherapie) oder zur großvolumigen parenteralen Flüssigkeitssubstitution (Kurzdarmsyndrom) wieder erforderlich. Es braucht also für diese Patienten wieder ein Gefäßzugangsorgan. Wie macht man das?
Technische Lösung: Katheter als „äußere Nabelschnur“ mit permanenter Hautperforation und permanentem intravasalem Fremdkörper
Anfangs (1940er/1950er Jahre) wurde die Nabelschnur einfach technisch mechanisch kopiert. Katheter aus verschiedenen Materialien (Glas, Metall, Kunststoff) wurden operativ wiederholt intermittierend oder dauerhaft in Blutgefäße eingebunden, bei kleinkalibrigen peripheren Gefäßen arterio-venös (Abb. 1), bei großlumigen stammnahen Venen (V. femoralis, V. subclavia) ermöglicht auch die venovenöse Katheterisierung ausreichende Flüsse.
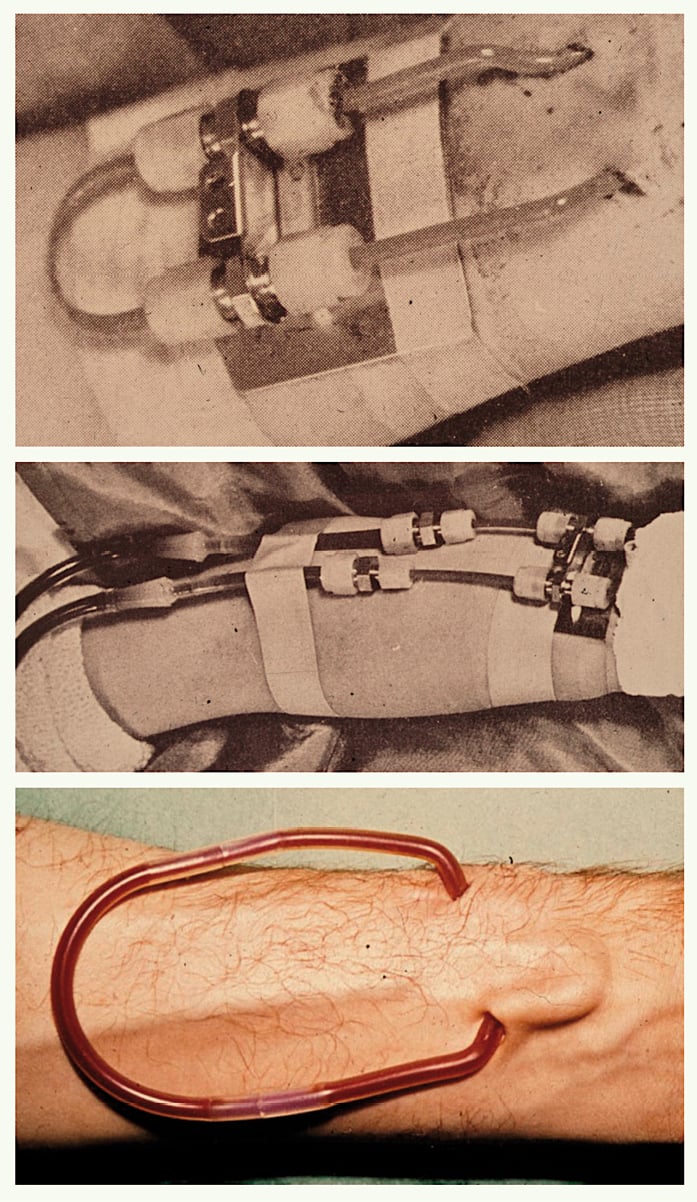
Abb. 1: Externe Kunststoffshunts; oben und Mitte: Teflonshunt mit „Armplatte und Überwurfmuttern“ (frühe Version eines Scribner Shunts) Anfang der 60er Jahre; unten: Teflon-Silastik-Shunt Ende der 1960er Jahre.
Vereinfacht dargestellt wurde bei unveränderter Anatomie mit aufwendiger Technik der Zugang zum Kreislaufsystem realisiert. Permanente Hautperforation und intravasaler Fremdkörper führten zu einer alltäglich nicht akzeptablen Komplikationsdichte und damit zu einem hohen Druck, bessere Gefäßzugänge zu entwickeln.
Biologische Lösung: Einfache periphere Punktion einer autologen „inneren Nabelschnur“
Die klinisch etablierte einfache periphere Gefäßpunktion wäre alltäglich problemlos auch wiederholt anzuwenden, benötigt aber ein gut zu punktierendes kräftigkalibriges oberflächliches Blutgefäß mit einer Förder- und Rücknahmekapazität von mindestens 600 ml Blut pro Minute. Über ein solches Blutgefäß verfügt der Mensch nicht. Durch die Anastomosierung einer kräftigkalibrigen oberflächlichen Leitvene am Arm mit der vicinalen Leitarterie erfüllt diese Vene dann die oben beschriebene Eigenschaftskombination, um mit einer einfachen peripheren Venenpunktion einen extrakorporalen Kreislauf zu realisieren (Abb. 2).
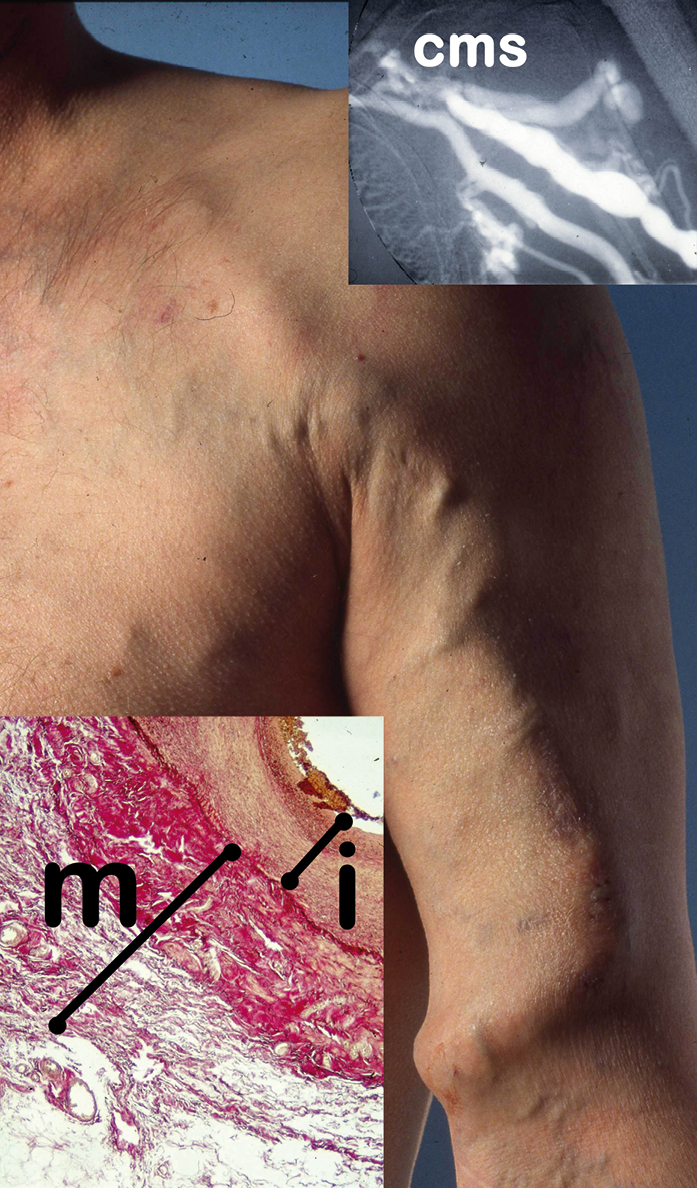
Abb. 2: Langstreckig bei Cephalicamündungsstenose (cms) druckinduziert hypertroph dilatierte arterialisierte Vena cephalica am linken Oberarm als ideal zu punktierende „innere Nabelschnur“ mit deutlich verdickter Intima (i) und Media (m).
Funktionsmorphologie
Körperstrukturen sind in Bezug auf die vorgesehene Leistung/Belastung hin konzipiert und werden prozessual durch letztere induktiv modifiziert und erhalten, alltäglich belegt u. a. durch die Phänomene Aktivitätshypertrophie (z. B. im Sport) oder Inaktivitätsatrophie (Use it or loose it!). An den Blutgefäßen lassen sich die korrespondierenden Belastungs- und Strukturelemente einfach darstellen und sind etabliertes (patho)physiologisches Wissen.
Um die Basalmembran gruppieren sich die drei Accessoria: Intima, Media und Adventitia belastungs-/funktionsabhängig qualitativ und quantitativ unterschiedlich. Die Intima nimmt mechanisch die Scherbelastung der durchströmenden Flüssigkeit auf. Sie ist bei langsamer (laminarer) Strömung dünn mit einem einschichtigen Endothel (alle Venen und peripheren Arterien) und am dicksten mit mehrschichtigem Endothel in den Arterien mit der höchsten Flussgeschwindigkeit (Kranzarterien und proximalen Aorta). Bereits beim Embryo finden sich an Arterienaufzweigungen mit turbulentem Flussmuster Intimapolster! Die Media nimmt in den Arterien die pulsierende Druckbelastung (Wandspannung) ausgleichend (Windkessel) und regulierend (Widerstand) auf und ist qualitativ (elastische/muskuläre Anteile) und quantitativ (Mediastärke) entsprechend der jeweiligen Belastungssituation modifiziert. Bei den Venen korrespondiert die Mediastärke mit der topographisch unterschiedlichen Druckbelastung (Wandspannung). Sie ist am stärksten in der V. saphena magna distal (hydrostatisch arterielle Drücke), schwächer z. B. in den Armvenen und fehlt bei den intrakraniellen Venen (bei denen keinerlei Druckbelastung auftritt) völlig!
Durch den arteriovenösen Kurzschluss wird das Belastungsprofil der beteiligten Gefäße deutlich verändert. Die Flussgeschwindigkeit steigt in allen am Kurzschlusskreislauf beteiligten Gefäße(abschnitt)en. In der (den) zuführenden Arterie(n) nimmt der intraluminale Druck ab und in der (den) drainierenden Vene(n) zu. Obwohl die durch diese Belastungsänderungen induzierten morphologischen Veränderungen (Remodeling) der beteiligten Gefäße, aufgrund der zuvor beschriebenen physiologischen Kenntnisse, mit eindeutiger kausaler Bezogenheit (Scherstress → Intima und Druckstress → Media) vorhersehbar waren, hat es über 20 Jahre gedauert, bis das Remodeling Eingang in den klinischen Diskurs gefunden hat.
Remodeling
Armvenen transportieren das Blut mit niedrigem Druck und langsamer Flussgeschwindigkeit ohne sichtbare morphologische oder degenerative Veränderung bis ins hohe Alter. Ändern sich die Belastungsbedingungen, indem eine Armvene arterialisiert und regelmäßig punktiert wird, zeigen sie regelmäßig deutlich sichtbare morphologische Veränderungen, für die nur die vier bei der Shuntvene geänderten Belastungen ursächlich sein können: Erhöhte Scherbelastung, erhöhter intraluminaler Druck, segmentale Devaskularisation und Vielfachpunktion (Abb. 3).
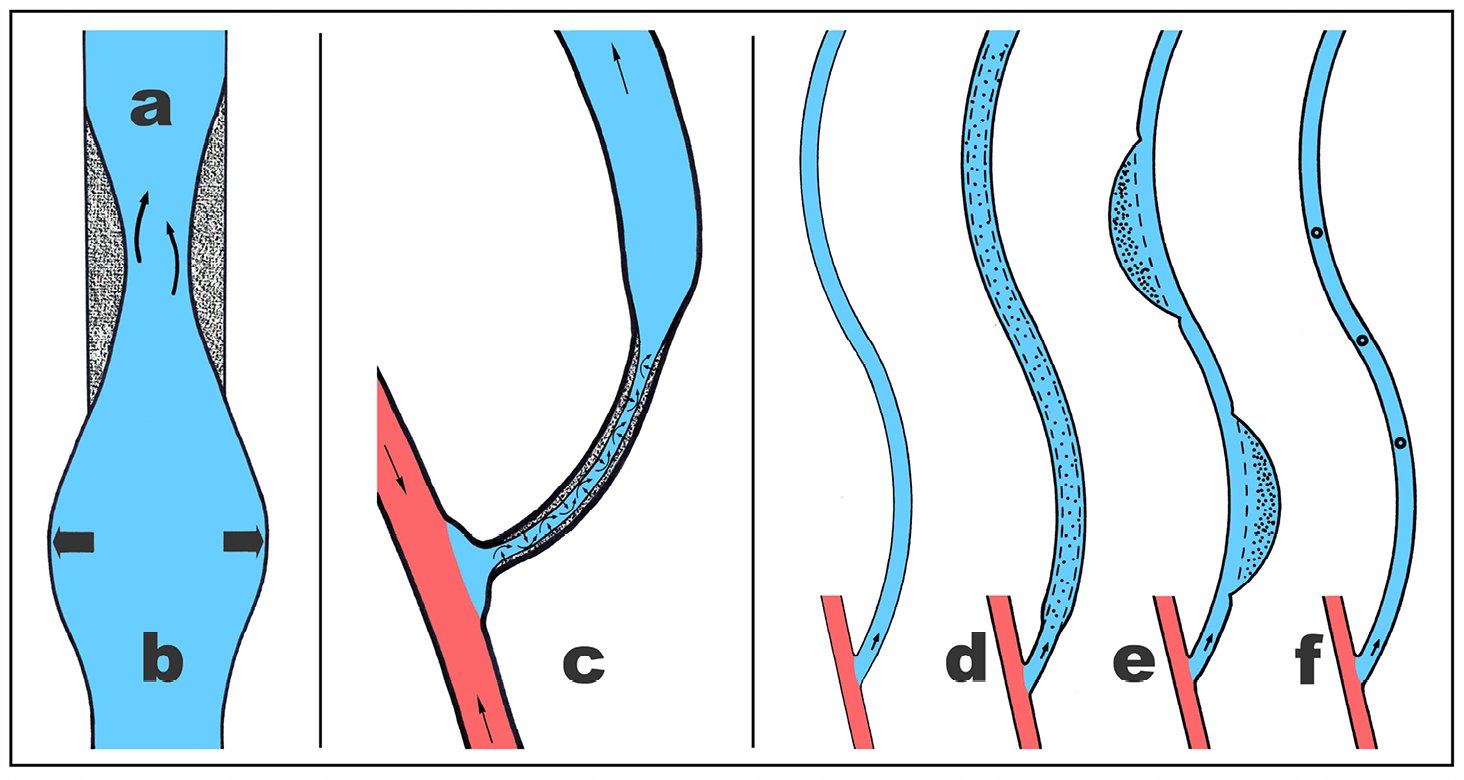
Abb. 3: Die morphologische Eigendynamik der arterialisierten und vielfach punktierten Shuntvene (schematisch) mit den Folgen von erhöhter Scherbelastung (a), erhöhter Druckbelastung (b), segmentaler Devaskularisation mit fixiertem Spasmus und sekundärer Intimaproliferation (c), Strickleiterpunktion (d), Arealpunktion (e) und Knopflochpunktion (f).
Erhöhte Scherbelastung
Eine erhöhte Scherbelastung (Flussgeschwindigkeit, Turbulenz) führt immer zur Verdickung (Proliferation) der Intima/Subintima von bis zu mehreren Millimetern (Abb. 3a). Das Ausmaß dieser Intimaproliferation nimmt individuell unterschiedlich ausgeprägt genau wie unter physiologischen Bedingungen (s. o.) mit steigender Scherbelastung grundsätzlich zu und bestimmt in Abhängigkeit vom anatomischen Ausgangsdurchmesser (u. U. verkleinert durch eine fixierte spastische Engstellung oder erweitert durch eine druckinduzierte Dilatation), ob es zur hämodynamisch wirksamen Lumeneinengung kommt u. U. bis hin zum Shuntverschluss.
Erhöhte Druckbelastung/Wandspannung
Übersteigt der intraluminale Druck den für diese Vene (Mediastärke) physiologischen Wert, kann dies zur Venendilatation führen (Abb. 2, 3b). Da die muskelstarke V. saphena magna hydrostatische arterielle Drucke gewohnt ist, zeigt sie regelhaft auch bei Verwendung als arterieller in situ Bypass keine Neigung zur Dilatation. Armvenen zeigen bei einer Druckerhöhung über 50 mmHg in 80 Prozent eine Kaliberzunahme im Sinne einer wandhypertrophen Dilatation. Abgesehen von falschen und den typischen punktionsbedingten Aneurysmen sind alle Shuntvenendilatationen druckinduziert, liegen (im Gegensatz zu der arteriellen poststenotischen Dilatation) ausnahmslos prästenotisch und weisen palpatorisch einen mehr oder weniger ausgeprägten Stenosepuls auf.
Diese Dilatationen entwickeln sich typischerweise in zeitlich begrenzten Phasen von einigen Monaten und kommen dann zum Stillstand. Die naheliegende Erklärung ist, dass die hypertrophe Venenwand dann der erhöhten Druckbelastung standhalten kann. Erreicht die Venenwand diese Stabilität nicht, kann es in Einzelfällen auch zur weiter progredienten Dilatation kommen.
Einzige gelegentliche Ausnahmen sind dilatierte Shuntvenensegmente ohne Stenosepuls bei Patienten mit längerer Kortisonmedikation, die wir als kortikoidbedingte Gefäßerweiterung analog zur Schwangerschaftvarikose oder von Ösophagusvarizen (verminderter Östrogenabbau bei Leberzirrhose) interpretieren.
Segmentale Devaskularisation
Das für die Anastomosierung freipräparierte Venensegment reagiert mit einem ausgeprägten Spasmus, der nicht, wie man annehmen könnte, durch den Druck des freigegebenen Blutstroms erweitert, sondern im Gegenteil durch den Bernoulli- (resp. Venturi-) Effekt funktionell perpetuiert und durch die zerstörte Vaskularisation narbig sklerotisch in dieser Engstellung fixiert wird (Abb. 3c). Diese induziert ihrerseits wieder eine Intimaproliferation, womit der Circulus vitiosus einer progredienten Lumeneinengung dieses postanastomotisch freipräparierten Venensegmentes komplettiert ist. Ohne Gegenmaßnahmen (frühzeitige intraluminale Druckerhöhung (!) zur Vermeidung eines fixierten Spasmus) entwickelt dieses Shuntvenensegment dann ca. 70 Prozent aller Shuntvenenstenosen.
Plastische Verformung der Shuntvene durch Vielfachpunktion
Die drei grundsätzlichen Lokalisationsmöglichkeiten der Vielfachpunktion (Strickleiter-, Areal- und Knopflochpunktion) mit ihren plastischen Folgen für die Shuntvene wurden wiederholt beschrieben und sollen der Vollständigkeit halber erwähnt werden (Abb. 3d-f). Der indizierte Einsatz aller drei Techniken mit alltäglicher Bevorzugung der Strickleiterpunktion gestattet eine topographisch gezielte plastische Erweiterung der Shuntvene (Areal- und Strickleiterpunktion) bzw. deren Vermeidung (Knopflochpunktion).
Die fünf Wandqualitäten der Shuntvene
Die beschriebenen Veränderungen im Rahmen des Remodeling führen zu fünf verschiedenen Wandqualitäten der Shuntvene (Abb. 4), deren Kenntnis und Beachtung für die shuntchirurgische Indikationsstellung und das intraoperative Handling entscheidend sind und die Shuntchirurgie als eigenständige Disziplin innerhalb der Gefäßchirurgie klar von der Arterienchirurgie abgrenzen.
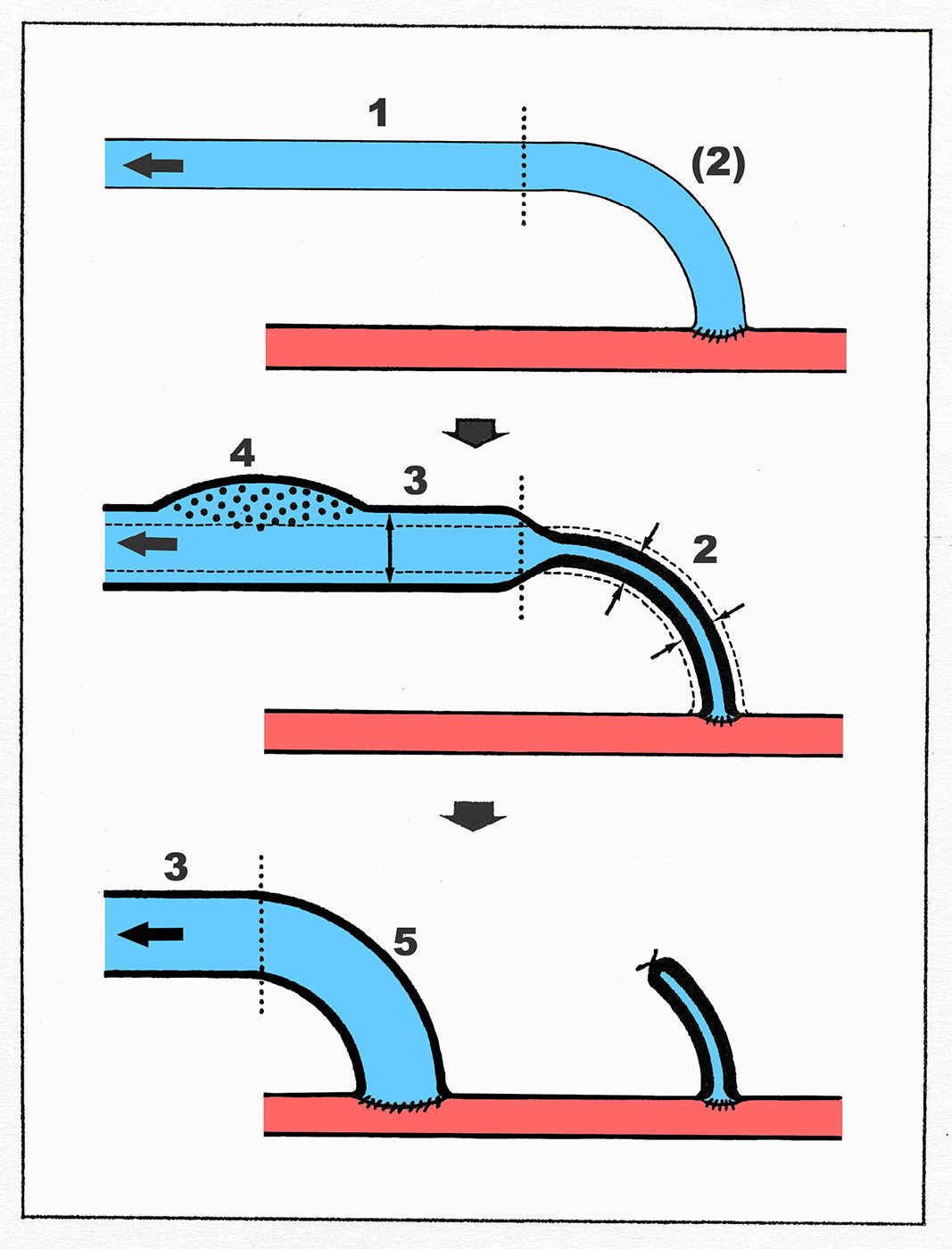
Abb. 4: Die fünf Wandtypen der Shuntvene schematisch. 1: native Venenwand; 2: nativ freipräparierte, transponiert arterialisierte, sekundär sklerotisch stenosierte Venenwand, 3: nicht freipräparierte, in situ arterialisierte, sekundär hypertroph dilatierte Venenwand; 4: hypertroph dilatierte Venenwand im Bereich eines Punktionsareals; 5: hypertroph dilatierte, sekundär freipräparierte und transponierte Venenwand.
Das langstreckig hypertroph dilatierte Punktionssegment ist die „Zielstruktur“ in der Shuntchirurgie, deren Induktion und Erhalt alle shuntchirurgischen Bemühungen in erster Linie gelten sollten. Umgekehrt ist die nativ freipräparierte Vene (ohne die intraluminale Druckschienung des venösen Bypasses im Hochdruckkompartment bei der arteriellen Rekonstruktion) die „Problemstruktur“ in der Shuntchirurgie mit einer hohen Stenoseinzidenz. Die Problematik der nativ devaskularisierten Vene im Niederdruckbereich hat bis heute die Entwicklung einer rekonstruktiven Venenchirurgie verhindert und erklärt ebenfalls zwanglos in der Shuntchirurgie die hohe Erfolgsrate nach einer Anastomosenneuanlage weiter proximal mit einer nunmehr hypertroph arterialisierten Venenwand (Ziff. 5 in Abb. 3).
Was heißt Venenmaturierung?
Armvenen sind dünnwandig und selten so kräftigkalibrig, dass sie problemlos einfach und wiederholt mit Dialysekanülen zu punktieren wären und der Punktionskanal sich nach Kanülenentfernung rasch und sicher verschließt. Da trifft es sich gut, dass die mit dem Ziel einer Flusserhöhung durchgeführte Arterialisierung sozusagen kollateral druckinduziert zu einer Hypertrophie der Media und einer Vergrößerung des Durchmessers führt. Wir bezeichnen diese druckinduzierte hypertrophe Dilatation als (erwünschte) Plusentgleisung und stellen sie der scherstressinduzierten rein stenosierenden Intimaproliferation (Abb. 3a) als zu vermeidende Minusentgleisung gegenüber.
Induktion der Maturation
Die klinisch eindeutige kausale Verknüpfung von erhöhtem Scherstress → Intimaproliferation und intraluminaler Druckerhöhung → hypertrophe Dilatation führte konsequenterweise zur Idee der topographischen Trennung von hämodynamischer Katastrophe und deren Korrektur (Abb. 5) als essenziellem Konstruktionsprinzip zur Induktion einer inneren Nabelschnur in der autologen Shuntchirurgie. Die Flussvolumina Mitte und unten in Abbildung 5 sind identisch, entscheidender Unterschied ist die Druckbelastung des Segmentes a bis b in Abbildung 5 unten, klinisch realisiert z. B. durch ein postoperatives Shuntvenentrainig mit einer mehrmals täglich für eine Viertelstunde am proximalen Oberarm angelegten venösen Staubinde oder einer nachgeschalteten proximalen spontanen (belassenen) oder iatrogenen (prox. Banding) „protektiven“ Stenose! Diese segmentale Fehlbelastung des Niederdruckschlauchs Vene durch die intraluminale Druckerhöhung liefert genau den induktiven Impuls, um das für die Dialyse benötigte, oberflächlich leicht zu punktierende, kräftigkalibrige und wandhypertrophe Gefäß zu induzieren, dass die Evolution nicht zur Verfügung stellt.
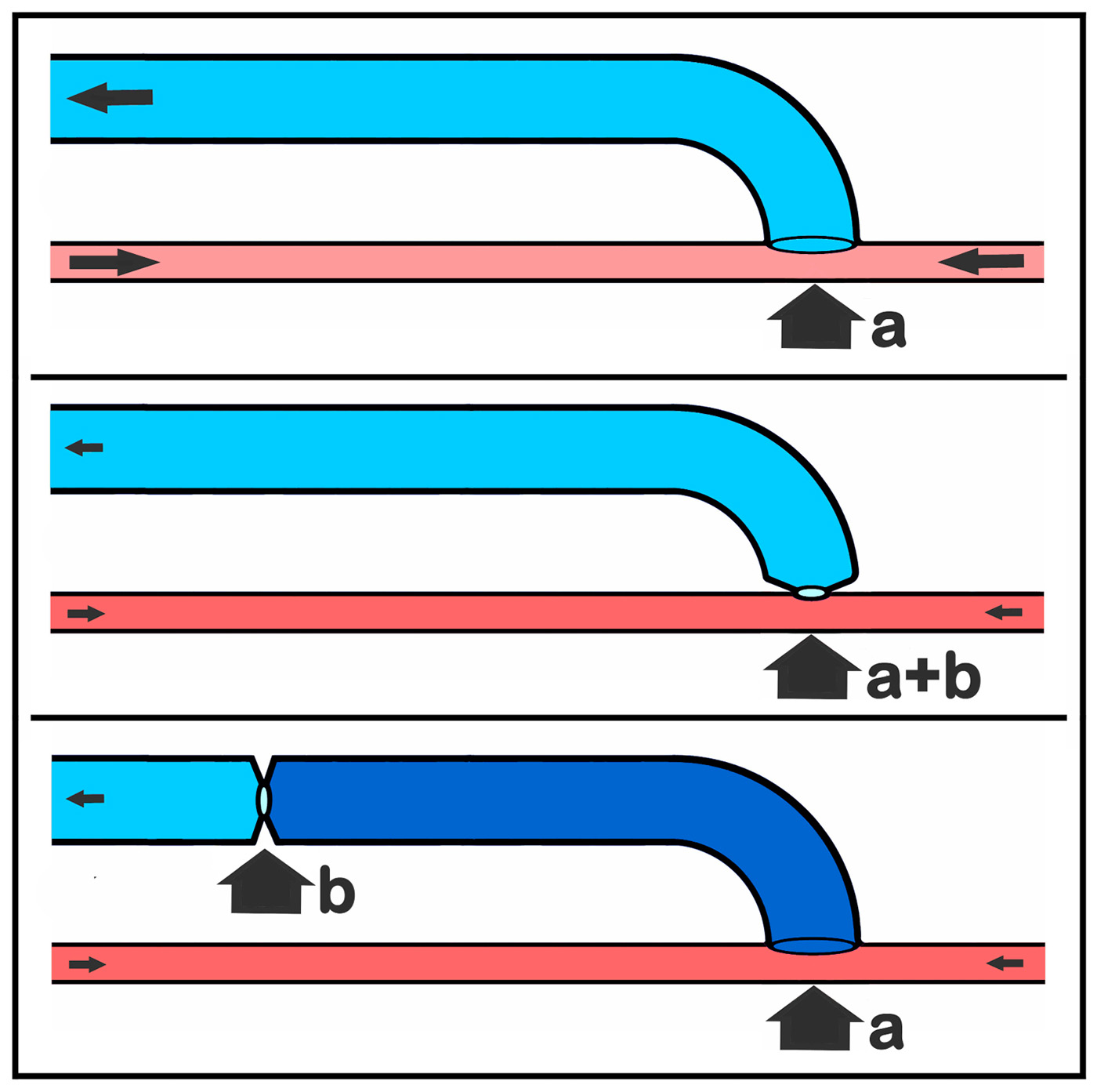
Abb. 5: Topographische Trennung von hämodynamischer „Katastrophe“ und „Korrektur“. Oben: großkalibrige periphere av-Anastomose (a) als hämodynamische „Katastrophe“; Mitte: hämodynamische (Teil)“Korrektur“ durch Einengung (b) der av-Anastomose (a und b fallen topographisch zusammen); unten: topographische Trennung von hämodynamischer „Katastrophe“ (a) und deren „Korrektur“ (b), jetzt in Form einers segmental nachgeschalteten Stenose (b).
Die nachgeschaltete protektive Stenose wird damit zu einem entscheidenden Konstruktionselement des autologen Gefäßzugangs und wichtiger Gegenspieler zum unphysiologischen arteriellem Leck der arteriovenösen Anastomose (z. B. Vermeidung von Steal-S. und HOF).
Steuerung und Erhalt der Maturation
Die Maturation muss nicht nur initiiert, sondern auch gesteuert und das Zielsubstrat, das hypertroph dilatierte Punktionssegment möglichst über viele Jahre erhalten werden. Die wesentlichen shuntspezifischen (neben allen gefäßchirurgischen) Techniken sind plastisch gefäßchirurgische Korrekturen der Shuntvene (wie z. B. bei mehreren Aneurysmen in Abbildung 6) sowie die Transposition oder Transplantation des Punktionssegments in eine andere Extremitätenregion, letztere meist, wenn die Drainage regional nicht mehr rekonstruierbar ist. Es ist ein mit vielen speziellen shuntchirurgischen Techniken kreativ anspruchsvolles und attraktives chirurgisches Tätigkeitsfeld bei intensiver Zuwendung mit hohem Erfüllungs- und Erfolgspotenzial.
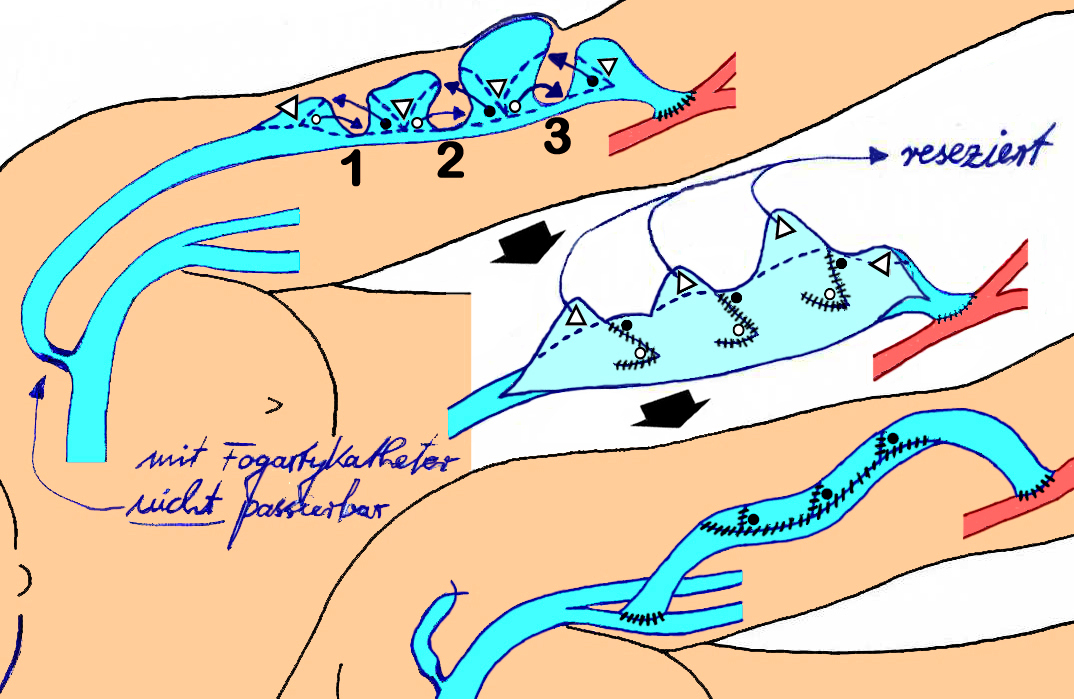
Abb. 6: Ausschnitt aus einer OP-Skizze nach Korrektur von wechselnden Shuntvenenaneurysmen und -stenosen mit mehreren Z-Plastiken.
Mit der beschriebenen Eigenständigkeit und Spezifität einer „induktiven Prozesschirurgie“ (gegenüber der gesamten übrigen Chirurgie als „reparativer Ereignischirurgie“) mit der Aufgabe, eine in der Evolution nicht vorgesehene Struktur/Funktion induktiv realisieren und erhalten zu müssen, hat die Shuntchirurgie den notwendigen eigenen Annahme(Axiom)rahmen gefunden, um ohne substratfremden arterienchirurgischen Bezug eigene shuntspezifische Substratbewertungen, diagnostische, klinische, operationstechnische und punktionstechnische Strategien, Terminologien und Dokumentationskriterien entwickeln und formulieren zu können und ist damit neben der Arterienchirurgie zur zweiten selbstständigen Disziplin innerhalb der Gefäßchirurgie geworden mit eigener Terminologie für den täglichen shuntchirurgischen Diskurs: Plusentgleisung, Minusentgleisung, protektive Stenose, hypertrophe Dilatation, Banding-OP, Chancenverzicht (versus Erfolgsrate), Naht unter Spannung, In-Situ-Proximalisierung, Shuntvenentransplantation etc.
Ist diese Eigenständigkeit der Shuntchirurgie einmal formuliert und der notwendige Rahmen zur eigenständigen klinischen Anwendung und Forschung geschaffen, sollte die Shuntchirurgie, insbesondere und dringend auch für die jüngeren Kolleg(inn)en, ein hohes Provokationspotenzial haben, bei dieser promethäischen Aufgabe weitere Lösungsschritte zu finden.
Literatur erhalten Sie über den Autoren.
Krönung G: Die Chirurgie des (Dialyse)Gefäßzugangs als komplexe, hochspannende induktive Prozesschirurgie. Passion Chirurgie. 2019 April, 9(04): Artikel 03_02.
Autor des Artikels
Prof. Dr. med. Gerhard Krönung
Chefarzt der ShuntchirurgieDKD Helios Klinik WiesbadenAukammallee 3365191Wiesbaden kontaktierenWeitere aktuelle Artikel
22.02.2022 Herzchirurgie
Spendenlauf für Kinderherztransplantation erzielt über 67.000 Euro
Bei dem im Januar 2021 gestarteten und nun beendeten virtuellen Spendenlauf "Ich lauf um dein Leben" der Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie e.V. (DGTHG) und der Deutschen Gesellschaft für Pädiatrische Kardiologie und Angeborene Herzfehler e.V. (DGPK) erzielten mehr als 2.300 Läuferinnen und Läufer eine Spendensumme von 67.295,18 EUR.
01.02.2022 Gefäßchirurgie
Niedergelassene Gefäßchirurgie, eine Chance für die Zukunft?
Der medizinische Fortschritt, die Veränderungen der Erwartungen von Patient:innen und die sinkende Zahl an Ärzte:innen fordern die Gefäßchirurgie als hochspezialisiertes Fach in besonderer Weise. Die Demographie gibt vor, dass die vorhandenen Probleme zunehmen werden.
25.04.2019 Gefäßchirurgie
Passion Shuntchirurgie
Während der Bearbeitung des Themas hat mich die Nachricht vom Tode meines shuntchirurgischen Lehrers, früheren Vorgesetzten und Vorgängers in der Leitung der Shuntklinik in Neckargemünd erreicht. Prof. Dr. Wolf Dieter Brittinger ist am 10. Januar 2019 gestorben. Gefäßzugänge für die Hämodialyse, oder wie er es gern nannte „Anschlussverfahren für die künstliche Niere“, waren sein Anliegen, in dessen Dienst er sich fast lebenslang gestellt hat.
01.04.2019 Gefäßchirurgie
Editorial: Shuntchirurgie – Ein anspruchsvolles und lohnendes Gebiet der Gefäßchirurgie
Die Shuntchirurgie ist ein Betätigungsfeld in der Gefäßchirurgie, das sowohl im ambulanten Sektor in der Breite als auch in Referenzzentren für Shuntchirurgie betrieben wird. Nichtsdestotrotz ist die Shuntchirurgie wenig im Fokus und es ist der Redaktion der Zeitschrift PASSION CHIRURGIE zu danken, dieses für den Patienten und die Gefäßchirurgie so wichtige Feld, den Lesern nahezubringen.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.