Die Stammveneninsuffizienz mit Varikosis ist die häufigste Ursache der chronischen venösen Insuffizienz (CVI) und die operative Behandlung der Varikosis gehört zu den häufigsten operativen Eingriffen in Deutschland. In den vergangenen 17 Jahren ist eine dynamische Entwicklung und Erweiterung des Behandlungsspektrums der Stammveneninsuffizienz zu beobachten.
Epidemiologie und Pathophysiologie
Die Prävalenz aller Stadien der chronischen venösen Insuffizienz (CVI) beträgt in Europa ca. 60 %. Ausgeprägte Veränderungen der CVI mit Ödem, Hyperpigmentierung oder Corona phlebectatica paraplantaris liegen bei etwa 5 % der Bevölkerung vor. Abgeheilte oder floride Ulcerationen aufgrund einer CVI bestehen bei 1 bis 2 %. Folgende Faktoren können die Entstehung eine Varikosis bzw. CVI begünstigen: Alter, weibliches Geschlecht, Schwangerschaft, Adipositas und genetische Disposition [61].
 Die pathophysiologischen Zusammenhänge der Varikosis sind noch nicht vollständig verstanden. Die Varikosis wird auf eine Degeneration der Venenwand und des Klappenapparates mit Funktionsstörung der Klappen zurückgeführt. Aufgrund des insuffizienten Klappenschlusses kommt es zum inadäquaten venösen Rücktransport aus dem Bein und zum Reflux des venösen Blutes, der dann zur venösen Hypertension im epifaszialen Venensystem des Beines führt. Prinzipiell unterscheidet man die oben beschriebene primäre Varikosis von der sekundären Varikosis, die nach tiefer Beinvenenthrombose (TVT) oder nach Venenverletzungen auftreten kann.
Die pathophysiologischen Zusammenhänge der Varikosis sind noch nicht vollständig verstanden. Die Varikosis wird auf eine Degeneration der Venenwand und des Klappenapparates mit Funktionsstörung der Klappen zurückgeführt. Aufgrund des insuffizienten Klappenschlusses kommt es zum inadäquaten venösen Rücktransport aus dem Bein und zum Reflux des venösen Blutes, der dann zur venösen Hypertension im epifaszialen Venensystem des Beines führt. Prinzipiell unterscheidet man die oben beschriebene primäre Varikosis von der sekundären Varikosis, die nach tiefer Beinvenenthrombose (TVT) oder nach Venenverletzungen auftreten kann.
Klinik
Die klinischen Zeichen der CVI reichen von erweiterten intradermalen Venen (Besenreisern), subcutanen Varizen über Hautveränderungen mit Ödem, Hyperpigmentierungen bis hin zu floriden Ulcerationen. Typische klinische Beschwerden sind Schweregefühl, Spannungsgefühl und stechende Schmerzen, welche insbesondere nach längerem Stehen oder Sitzen auftreten. Oft sind die Beschwerden durch Hochlagerung der Beine oder Mobilisierung rückläufig. Die Varikophlebitis von Seitenästen oder eine Thrombophlebits insuffizienter Stammvenen stellt eine relevante Komplikation der Varikosis mit dem Risiko einer TVT dar. Bei vulnerabler Haut über varikösen subucutanen Venen oder bei Ulcerationen können auch Blutungskomplikationen auftreten.
Diagnostik
Die gezielte Anamnese zur CVI umfasst Fragen nach Auftreten klinischer Zeichen, subjektiver Beschwerden und nach Komplikationen der Varikosis. Wichtig ist die Frage nach Thrombophlebitis oder TVT in der Vorgeschichte. Vorausgegangene Therapiemaßnahmen (Kompression, Sklerotherapie, Operationen) sollten ebenfalls dokumentiert werden. Vervollständigt wird die Anamnese mit Fragen zu weiteren klinischen Beschwerden wie beispielsweise Claudicatiosymptomatik, therapierten Begleiterkrankungen und zur aktuellen Medikation. Die Frage nach Thrombozytenaggregationshemmung oder Antikoagulation ist im Hinblick auf eine notwendige Operation besonders wichtig.
Bei der klinischen Untersuchung wird systematisch nach den oben genannten klinischen Zeichen der CVI gesucht. Außerdem sollte die arterielle Perfusion der Beine klinisch und durch Palpation des Pulsstatus und ggf. Dopplerdruckmessung überprüft werden.
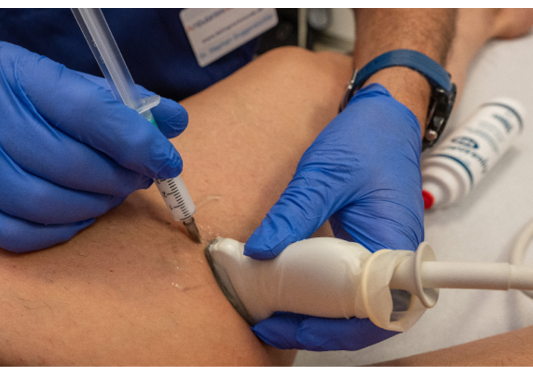
Mit der Duplexsonographie (Abb. 1) können die wichtigsten Informationen zur Ursache der CVI bzw. zur pathologischen Anatomie und Funktion des epifaszialen und tiefen Venensystems erarbeitet werden. Hierzu gehören die Identifizierung der refluxführenden epifaszialen oder tiefen Venensegmente und die Lokalisation der Refluxquellen aus dem tiefen in das epifasziale Venensystem mit Dokumentation der proximalen und distalen Insuffizienzpunkte sowie die Detektion insuffizienter Perforansvenen. Die duplexsonographische Untersuchung sollte bei stehendem Patienten durchgeführt werden. Außerdem sollten Hinweise auf eine floride oder stattgehabte tiefe Beinvenenthrombose wie thrombotisch okkludierte, teilrekanalisierte und auch sklerosierte Venensegmente oder Kollateralvenen detektiert und dokumentiert werden. Für die Identifizierung und Quantifizierung von Obstruktionen im tiefen Venensystem kann die Untersuchung im Liegen sinnvoll sein.
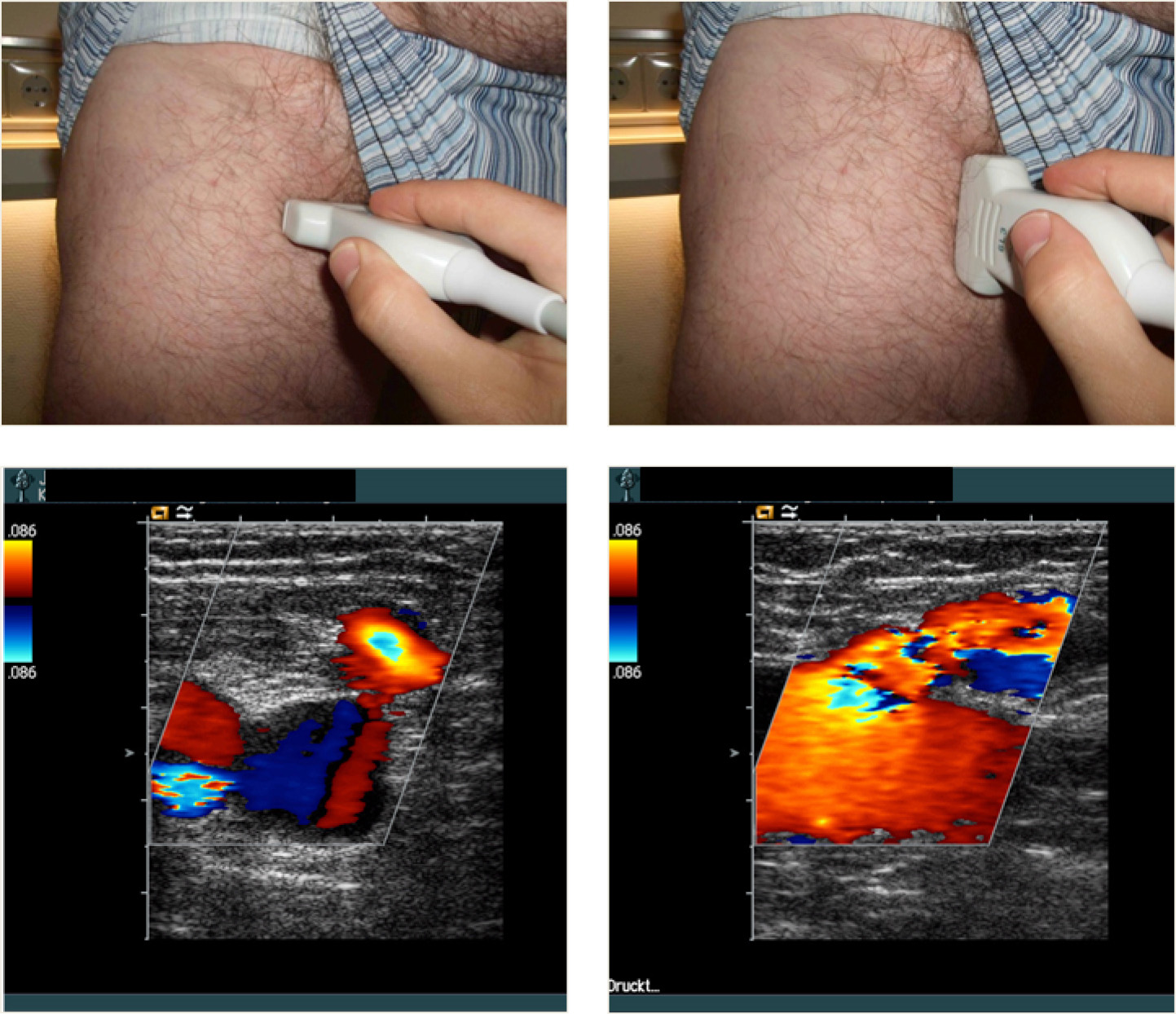
Abb. 1: Farbcodierte Duplexsonographie zur Diagnostik bei Varikosis
Die klassische Phlebographie mit Kontrastmittel hat an Bedeutung verloren. Sie kann erwogen werden, wenn die duplexsonographische Untersuchung keine schlüssigen Befunde über die Offenheit oder Funktion des tiefen Leitvenensystems erbringt (z. B. bei postthrombotischem Syndrom). Zusätzliche Informationen können auch bei venösen Malformationen und komplexen Rezidivkonstellationen sowie bei iliacalen oder pelvinen venösen Pathologien gewonnen werden.
Bei Hinweisen auf extravaskuläre Kompression (z. B. May-Thurner-Syndrom) oder ilio-cavale oder pelvine Pathologika (postthrombotische Obstruktion oder pelvine Varikosis) kann auch eine CT-Phlebographie oder MR-Phlebographie sinnvoll sein. Bei der CT-Phlebographie sind die Kontrastmittelexposition und die Röntgenstrahlung und bei der MR-Phlebographie sind die Kontrastmittelexposition und die relativ lange Untersuchungszeit einzukalkulieren. Bei bestimmten Fragestellungen (z. B. ilio-cavale venöse Kompression) kann auch eine intravaskuläre Ultraschalluntersuchung (IVUS) erwogen werden.
Klassifikationen der CVI
In den vergangen Jahren hat sich die CEAP Klassifikation [9] zur Beschreibung des klinischen Befundes (C-Clinical, Abb. 2), der Äthiologie bzw. Genese (E-Ethiological), der Anatomischen Bezeichnung der betroffenen Venensysteme (A-Anatomical) und Pathophysiologie (P-Pathophysiological) der CVI etabliert. Während die Kategorie C für den klinischen Alltag gut praktikabel ist, werden die weiteren Kategorien eher im Rahmen wissenschaftlicher Fragestellungen erhoben. Die einzelnen Parameter der CEAP Klassifikation sind in Tabelle 1 aufgeführt.
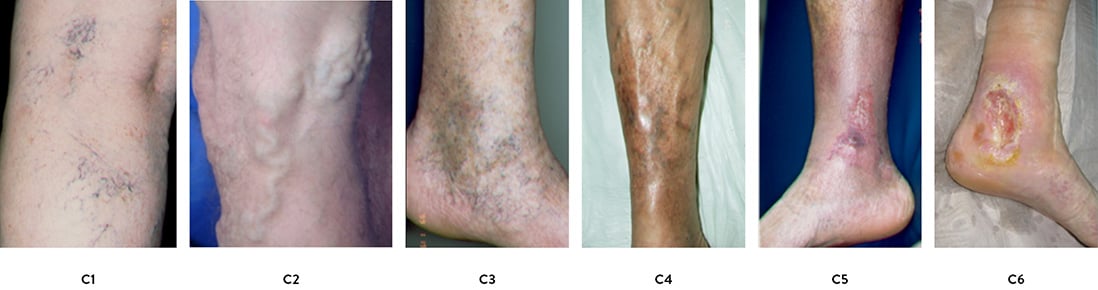
Abb. 2: Klinische Stadien der chronischen venösen Insuffizienz (CVI) nach CEAP Klassifikation
Tab. 1: CEAP-Klassifikation
|
C: Klinische Klassifikation |
|
|
C0 |
keine sichtbaren Zeichen der CVI |
|
C1 |
Besenreiser, Teleangiektasien |
|
C2 |
variköse Venen |
|
C3 |
Ödem |
|
C4a |
Hyperpigmentierung, Dermatitis |
|
C4b |
Dermatoliposklerose, Atrophie blanche |
|
C5 |
abgeheilte Ulceration |
|
C6 |
Floride Ulceration |
|
s: |
Symptomatik vorhanden z. B. Schweregefühl, Schmerzen, Wadenkrämpfen |
|
a: |
Asymtomatische Veränderungen, keine Beschwerden |
|
E: Äthiologische Klassifikation |
|
|
Ec |
Kongenital, angeboren |
|
Ep |
Primär (ungeklärte Ursache) |
|
Es |
Sekundär (z. B. bei postthrombotischem Syndrom) |
|
En |
keine venöse Ursache vorhanden |
|
A: Anatomische Klassifikation |
|
|
As |
Epifasziale Venen |
|
Ap |
Perforansvenen |
|
Ad |
Tiefe Venen |
|
An |
keine exakte Lokalisation der pathologischen Venen möglich |
|
P: Pathophysiologische Klassifikation |
|
|
Pr |
Reflux |
|
Po |
Obstruktion |
|
Pr,o |
Reflux und Obstruktion |
|
Pn |
keine venöse Pathophysiologie identifizierbar |
Die Ausprägung klinischer Beschwerden und klinischer Zeichen der Varikosis mit Durchführung der Kompressionstherapie können mit dem Venous Clinical Severity Score (VCSS) beschrieben werden [45]. Der VCSS ergänzt die CEAP Klassifikation und wird bei vielen klinischen Studien zur Varikosis verwendet. Insgesamt zehn Merkmale werden mit 0 bis 3 Punkten bewertet Der VCSS Score wird dann aus der Summe der zehn Merkmale berechnet. Vor mehreren Jahren wurde der VCSS Score revidiert und überprüft. Tabelle 2 zeigt die aktuelle Fassung des rVCSS [26, 53].
Außerdem existieren zahlreiche weitere anatomische, pathophysiologische und psychologische Scores für die Klassifizierung der Varikosis bzw. CVI.
Tab. 2: Der Revised Venous Clinical Severity Score (rVCSS) [53, 26]
|
Merkmal |
nicht vorhanden (0) |
mild, leicht (1) |
moderat, mäßig (2) |
stark, heftig (3) |
|
1. Schmerzen, Missempfindungen |
keine |
gelegentlich |
täglich ohne die üblichen Aktivitäten zu beeinträchtigen |
täglich mit häufiger Beeinträchtigung der üblichen Aktivitäten |
|
2. Variköse Venen, Varizen |
keine |
wenig, vereinzelt |
beschränkt auf Unterschenkel oder Oberschenkel |
betreffen Unterschenkel und Oberschenkel |
|
3. Venöses Ödem |
kein |
beschränkt auf Fuß und Sprunggelenk |
ausgedehnt oberhalb des Sprunggelenkes aber unterhalb des Kniegelenkes |
ausgedehnt bis zum Kniegelenk oder darüber |
|
4. Hyper-pigmentierung |
keine oder nur fokal |
begrenzt auf die perimalleoläre Region |
verbreitet auf distales Unterschenkeldrittel |
Ausdehnung über das distale Unterschenkeldrittel hinaus. |
|
5. Entzündung |
keine |
begrenzt auf die perimalleoläre Region |
verbreitet auf distales Unterschenkeldrittel |
Ausdehnung über das distale Unterschenkeldrittel hinaus. |
|
6. Induration, Sklerosierung |
keine |
begrenzt auf die perimalleoläre Region |
betrifft distales Drittel des Unterschenkels |
betrifft mehr als das distale Drittel des Unterschenkels |
|
7. Anzahl florider Ulcerationen |
keine |
1 |
2 |
>2 |
|
8. Zeitdauer der floriden Ulceration |
keine |
<3 Monate |
>3 Monate, <1 Jahr |
>1 Jahr |
|
9. Größe der floriden Ulceration |
keine |
Durchmesser <2cm |
Durchmesser 2-6cm |
Durchmesser >6cm |
|
10. Kompressionstherapie |
keine |
Gelegentliches Tragen von Kompres- |
Tragen der Kompressionsstrümpfe an den meisten Tagen |
Tägliches konsequentes Tragen von Kompres- |
Konservative Therapie
Prinzipiell kann bei symptomatischer CVI und fehlender therapierelevanter pAVK eine Kompressionstherapie empfohlen werden. In der Akutphase einer Beinschwellung und zur Entstauungstherapie sind Kompressionsverbände mit Kurzzugbinden sinnvoll. Da sich diese bei Mobilisierung und nach Abschwellung lockern, müssen sie regelmäßig gewechselt bzw. neu angelegt werden. Im Liegen bzw. nachts ist eine Kompressionstherapie selten notwendig.
Zur Dauertherapie sind rundgestrickte medizinische Kompressionsstrümpfe (MKS) der Klasse II nach Maß geeignet. Bei Varikosis wird meist die Kompressionsklasse II (mittel, 23-32 mmHg) empfohlen. Der Schenkelstrumpf (A-G) wird üblicherweise mit einem silikonbeschichteten Haftrand am Abrutschen gehindert. Wadenstrümpfe (A-D) können bei geringgradiger CVI ausreichend sein und die Therapieadhärenz verbessern [34]. Genauso wie die Strumpfverordnung stellt die Kontrolle der Strumpfanpassung eine originäre ärztliche Aufgabe dar. Intermittierendes Hochlagern der Beine, Venengymnastik und Schwimmen als sportliche Betätigung sind ebenfalls sinnvoll.
Operative und endovenöse Therapie der Stammveneninsuffizienz
Die operative Eliminierung des epifaszialen Refluxes hat im Vergleich zur alleinigen konservativen Therapie mit Kompression in Bezug auf das kosmetische Ergebnis, die Linderung der Beschwerden und die Verbesserung der Lebensqualität einen gut belegten Vorteil [62, 63]. Auch bei der Behandlung von venösen Ulcerationen kann mit der operativen Sanierung des epifaszialen Venensystems im Vergleich zur Kompressionstherapie ein nachhaltiges Ergebnis erreicht werden [16].
Heute steht eine Vielzahl von operativen und endovenösen Therapieoptionen zur Verfügung. Das breite Therapiespektrum kann in drei Gruppen gegliedert werden. Man unterscheidet die offenen-operativen von den endovenös-thermischen und den endovenösen non-thermischen Therapieoptionen (Tabelle 3).
Tab. 3: Therapiespektrum der Stammveneninsuffizienz
|
Offen-chirurgisch |
Endovenös thermisch |
Endovenös non-thermisch |
|
•Krossektomie •Stripping •CHIVA •Valvuloplastie |
•Radiofrequenz (ClosureFastR, RFITTR, EVRFR) •Laser (810-1940nm) •Wasserdampf |
•Schaumsklerosierung •Mechano-chemisch (ClariveinR) •Akrylatkleber (VenaSealR) |
Ziel der klassischen Varizenoperation ist die Eliminierung des Refluxes aus dem tiefen in das epifasziale Venensystem. Meist besteht als Refluxquelle eine insuffiziente sapheno-femorale oder sapheno-popliteale Mündung. Bei der Krossektomie wird diese chirurgisch präpariert und unterbunden. Die im sapheno-femoralen Übergang einmündenden Venenäste (z. B. V. epigastrica superficialis, V. pudenda externa, V. circumflexa ilium superficialis, V. saphena accessoria anterior und posterior) werden durchtrennt und ligiert (Abb.3). Es wird empfohlen, die insuffiziente Stammvene unmittelbar an der tiefen Leitvene abzusetzten und einen längeren Venenstumpf zu vermeiden. Es wird postuliert, dass bei Belassen eines Stumpfes dieser weiter mit Blut gefüllt und der Reflux dann über accessorischen Äste der V. saphena magna in epifaszialen Venensegmente fortgeleitet wird und dadurch eine Rezidivvarikosis entstehen kann. Als Nahtmaterial an der V. femorals communis wird nicht-resorbierbares Nahtmaterial empfohlen [14]. Man nimmt an, dass bei Verwendung von resorbierbaren Fäden die Neoangiogenese im Bereich der ehemaligen Refluxquelle stimuliert wird. Die Neoangiogenese wird als eine der wichtigen Ursachen für einen inguinalen bzw. poplitealen Neoreflux angesehen. Die Empfehlungen zur Destruktion des freiliegenden Endothels im Nahtbereich durch Elektrokoagulation oder zum Verschluss des Hiatus saphenus bzw. der Fossa ovalis durch Naht der Fascia cribriformis (Barrierebildung) zielen ebenfallt darauf ab, die Neigung zur Neoangiogenese bzw. zur Entwicklung eines epifaszialen Rezidivrefluxes zu reduzierten [7]. Unter Einhaltung dieser Prinzipien und einer standardisierten Operationstechnik können mit der Krossektomie sehr gute Ergebnisse erzielt werden [36].
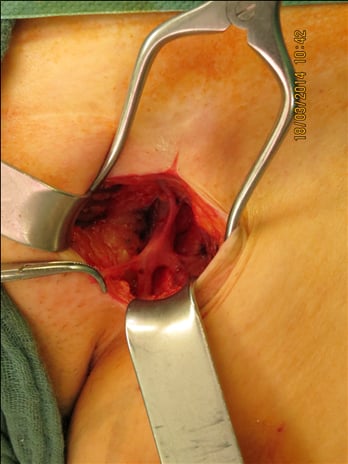
Abb. 3: Präparation der sapheno-femoralen Mündung links zur Durchführung der Krossektomie
Der zweite Schritt der klassischen Venenoperation ist die Entfernung der refluxführenden Stammvenensegmente durch das Strippingmanöver. Die Krossektomie mit zusätzlicher Eliminierung der insuffizienten Stammvene hat Vorteile im Vergleich zur alleinigen Krossektomie in Bezug auf das kosmetische Ergebnis und die Rezidivrate [8, 46, 59]. Das Strippingmanöver kann in der klassischen Babcock Methode [2] oder als PIN-Stripping (Perforate Invagination) bzw. Invaginationsstripping erfolgen. Es wird postuliert, dass die Invaginationsmethode zu einer geringeren Inzidenz von Nervenläsionen führt [47]. Außerdem wird das Stripping von proximal nach distal mit einer geringeren Inzidenz von Nervenläsionen assoziiert [41]. Als weitere Variante ist das Strippen der Stammvene mit einer Kryosonde möglich. Prinzipiell wird eine stadiengerechte Sanierung empfohlen [17]. Hier werden nur die tatsächlich insuffizienten Stammvenensegmente entfernt. Funktionell intakte Segmente sollten belassen werden. Aufgrund des höheren Risikos für eine Alteration von Hautnerven sollte ein Strippen der V. saphena parva und der V. saphena magna im Verlauf des Unterschenkels nur bei absoluter Indikation durchgeführt werden [20].
Bei der CHIVA (Théorie et practique de la Cure Conservatrice et Hémodynamique de l’Insuffisance Veineuse en Ambulatroire) wird versucht, den epifaszialen Reflux zu reduzieren, aber das Stammvenensystem weitgehend zu erhalten [12]. Diese Operationstechnik erfordert ein spezielles pathophysiologische Verständnis der venösen Drainage bzw. des epifaszialen Refluxes. Hierzu ist eine besonders differenzierte funktionelle Untersuchung bzw. Duplexsonographie erforderlich Einzelne kontrollierte Studien weisen auf Vorteile dieser Therapieform hin [38].
Als weitere offene Operationstechnik mit Erhalt der insuffizienten Stammvene ist die Valvuloplastie beschrieben [30]. Hier wird durch Umhüllung der V. saphena magna mit einem Dacron Patch eine Lumenreduktion mit Rekonstruktion der Klappenfunktion an der sapheno-femoralen Mündung erreicht.
Endovenöse thermische Ablation
Seit Ende der 1990er Jahre existieren Therapieprotokolle zur Endovenösen Laserablation (EVLA) und Endovenösen Radiofrequenzablation (RFA), die seither kontinuierlich weiterentwickelt werden [3, 58].
Ziel der endovenösen thermischen Verfahren ist die hämodynamische Ausschaltung der insuffizienten Stammvene, wobei auf die Krossektomie und das Stripping und damit auf das operative Trauma verzichtet werden kann. Durch dosierte Hitzeeinwirkung wird eine Destruktion der Intima und der Muskelzellen der Venenwand und eine Denaturierung des Kollagens erreicht, was unmittelbar zu einer Verdickung der Venenwand und Reduktion des Lumens führt (Abb.4 und 5).
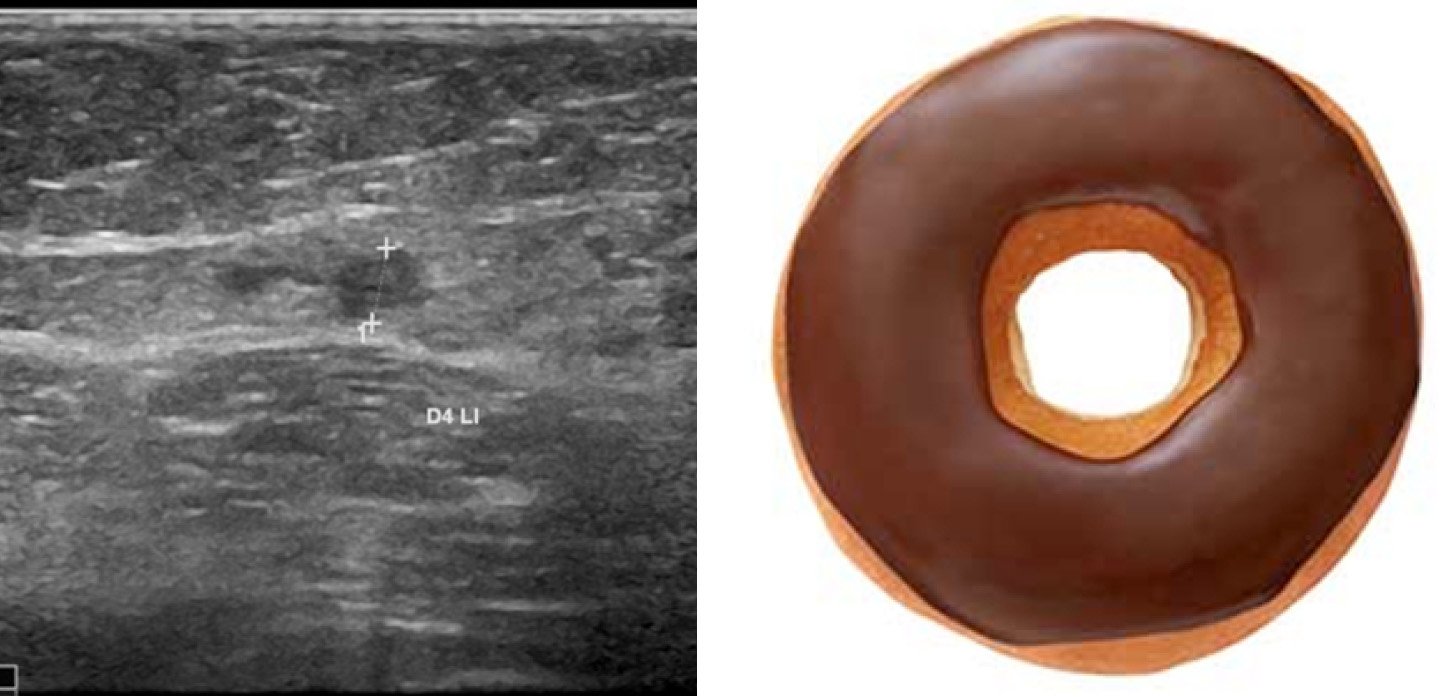
Abb. 4: Sonographischer Querschnitt am proximalen Oberschenkel einen Tag nach endothermischer Therapie der V. saphena magna mit Wandverdickung und Reduktion des Lumens („Donut-Zeichen“)
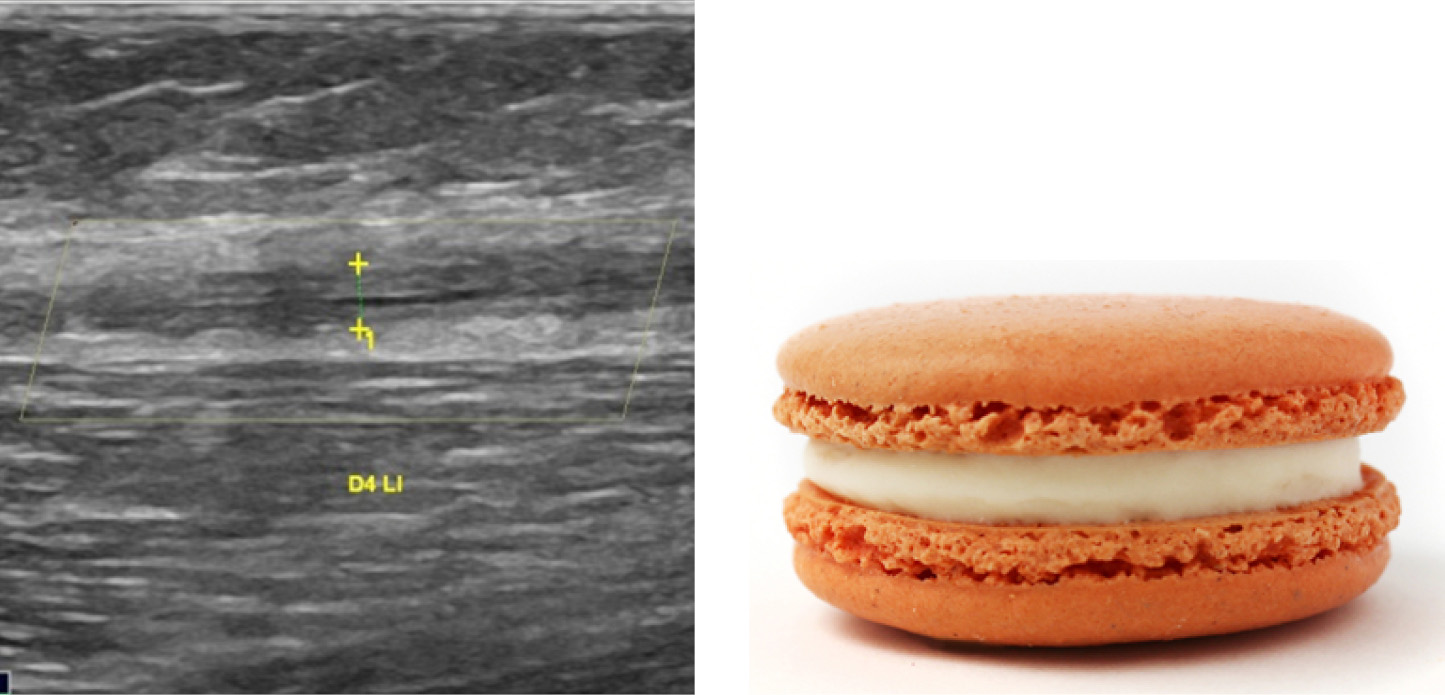
Abb. 5: Sonographischer Längsschnitt am proximalen Oberschenkel einen Tag nach endothermischer Therapie der V. saphena magna mit Wandverdickung und Reduktion des Lumens („Cookie-Zeichen“)
Das Restlumen wir durch koaguliertes Blut okkludiert, sodass bereits unmittelbar nach der Behandlung kein Flussnachweis mehr möglich ist. Als chronische Folge dieses thermischen Traumas ist eine Obliteration des Lumens und Fibrosierung der Vene zu beobachten. Häufig ist die behandelte Vene nach mehreren Monaten sonographisch nicht mehr nachweisbar. Essentiell für diese Therapieform ist das perivenöse Einbringen einer Tumeszenzflüssigkeit (meist NaCl 0,9 % + Lokalanästhetikum + Bicarbonat + Epinephrin) undmittelbar vor der endothermischen Behandlung (Abb. 6). Neben der Schmerzausschaltung werden durch die Tumeszenzflüssigkeit ein Schutz des perivenösen Gewebes vor thermischen Schäden [44] und ein verbesserter Kontakt der Therapiesonden mit der Venenwand erreicht. Die endovenösen Verfahren werden meist ausschließlich mit Tumeszenzanästhesie als ambulante Operation durchgeführt. Falls in gleicher Sitzung eine umfangreiche Seitenastexhairese oder eine Perforansvenenligatur durchgeführt wird, kann zusätzlich auch eine Spinalanästhesie oder Allgemeinanästhesie sinnvoll sein. Wichtig für eine erfolgreiche endothermische Therapie ist die weitgehende Entleerung der Vene bei der Behandlung, was durch Trendelenburglagerung erreicht werden kann. Die endovenöse thermische Ablation kann auch unter fortgesetzter therapeutischer oraler Antikoagulation sicher durchgeführt werden [52].
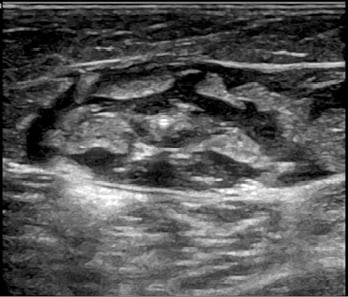
Abb. 6: Sonographischer Befund (Querschnitt) der endovenösen Therapiesonde nach Einbringen der perivenösen Tumeszenzflüssigkeit
Zur Endovenösen Lasertherapie (EVLT) stehen zahlreiche Generatoren mit Diodenlasern und unterschiedlichen Lichtwellenleitern verschiedener Firmen zur Verfügung. Aktuell werden längere Wellenlängen (1470 nm) und radial abstrahlende Lichtwellenleiter empfohlen [48]. Akzentuierte thermische Gewebeeffekte wie Karbonisierungen und Venenwandperforationen können so vermieden werden [51]. Maßnahmen zum Laserschutz müssen eingehalten werden (Abb. 7) Die endovenös applizierte Energiedichte (Longitudinale Endovenöse Energiedichte – LEED) wird hauptsächlich durch die eingestellte Leistung des Generators und die Rückzugsgeschwindigkeit bestimmt. Beides wird an den Durchmesser der zu behandelnden Vene angepasst und muss vom Operateur festgelegt und eingehalten werden. Leistungen zwischen 4 und 10 Watt und Rückzugsgeschwindigkeiten von 1-2 mm/s sind üblich. Es resultieren dann endovenöse Energiedichten (LEED) von 40-100 Joule/cm.
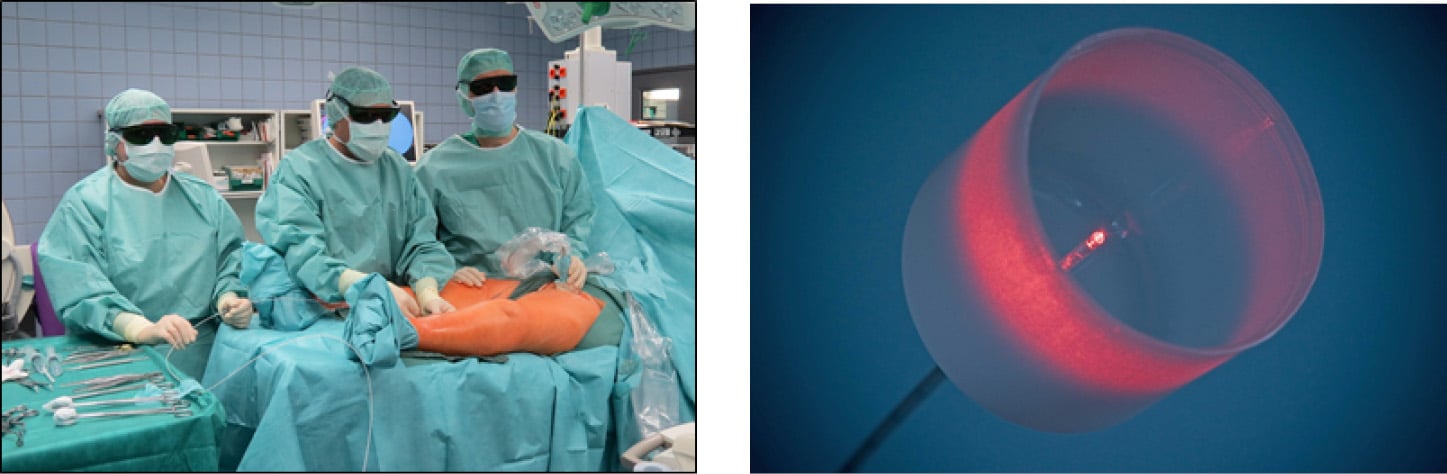
Abb. 7: Endovenöse Lasertherapie mit Radialfaser
Das am häufigsten verbreite Verfahren zur RFA ist die segmentale Radiofrequenztherapie (ClosureFASTR, Fa. Medtronic) (Abb. 8) Hier erfolgt eine standardisierte Erhitzung der Venenwand, wobei die Leistung des Generators automatisch durch einen temperaturgesteuerten Feed-back Mechanismus angepasst wird [39]. Alternativ stehen die bipolare RFITT Behandlung (Fa. Olympus) und das EVRF Verfahren (F-Care Systems) zur Verfügung [32, 50].
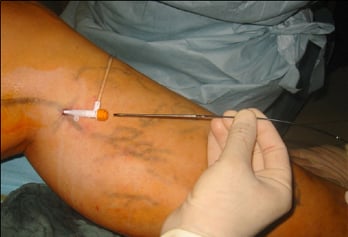
Abb. 8: Segmentale Radiofrequenzablation (hier ClosureFAST Prozedur)
Die endovenöse Heißdampftherapie (Endovenous Steam Ablation – EVSA oder Steam venous sclerosis – SVS) (Abb. 9) wird in vereinzelten Zentren angewendet und wissenschaftlich evaluiert [56]. Im Vergleich zu den anderen endothermischen Verfahren ist diese Therapieform im klinischen Alltag bisher am wenigsten etabliert.

Abb. 9: Endovenöse Heißdampftherapie bzw. Endovenous Steam Ablation (EVSA)
Endovenöase non-thermische Ablation (EVA)
Allen endovenösen non-thermischen Therapieverfahren gemeinsam ist, dass hier keine perivenöse Tumeszenz erforderlich ist. Fakultativ kann zur Punktion der zu behandelnden Stammvene eine Lokalanästhesie durchgeführt werden.
Die Schaumsklerotherapie ist nicht nur für die Behandlung von varikösen Seitenästen sondern auch für die Behandlung der Stammveneninsuffizienz etabliert. Die Sklerotherapie mit aufgeschäumten Sklerosierungsmittel ist insbesondere bei großlumigen Venen effektiver als die Flüssigsklerosierung [35]. Die Therapieprinzipien bestehen aus der standardisierten Herstellung eines geeigneten Schaumes welcher unter sonographischer Kontrolle über Punktion mit einer Venenverweilkanüle in die insuffiziente Stammvene eingebracht und bis an die sapheno-femorale bzw. sapheno-popliteale Mündung bewegt wird (Abb. 10). Durch die chemische Alteration der Intima und weiterer Venenwandstrukturen soll eine Fibrosierung und Obliteration des Lumens erzielt werden. Die Menge des endovenös applizierten Schaumes ist limitiert und richtet sich nach den Leitlinienempfehlungen bzw. den Angaben des Herstellers [40]. Im Vergleich zur operativen Entfernung oder thermischen Ablation der Stammvene ist die Schaumsklerotherapie weniger effektiv und erfordert ggf. wiederholte Behandlungen [42, 57].
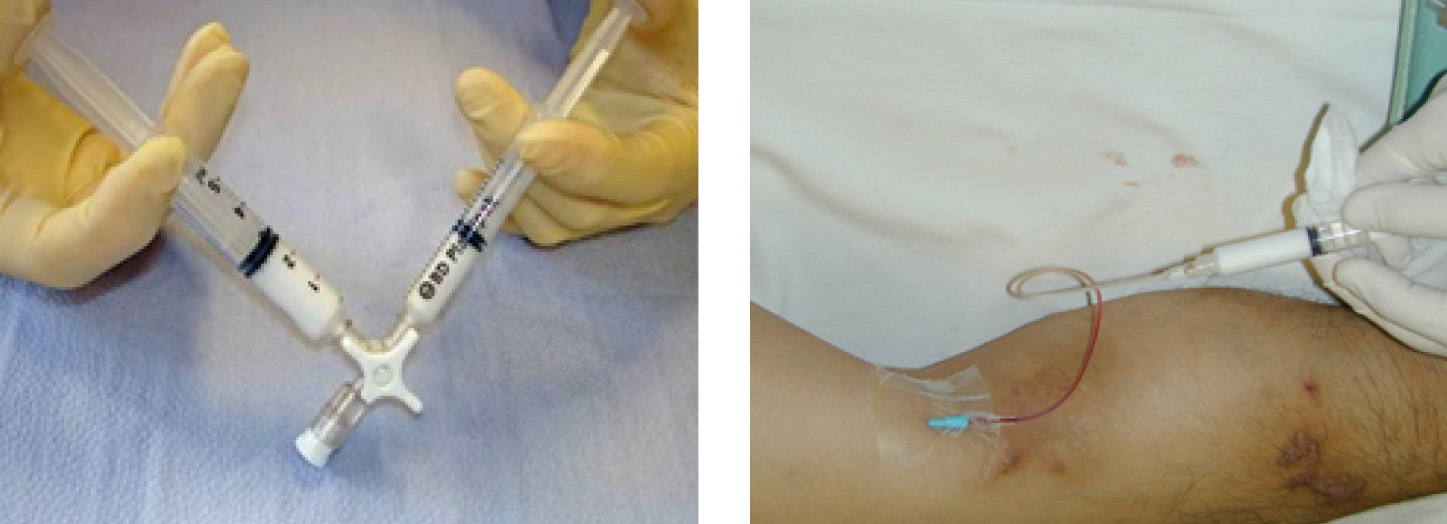
Abb. 10: Schaumsklerotherapie
Um die Effektivität der Sklerotherapie bei der Behandlung der Stammveneninsuffizienz zu erhöhen, wird bei der mechano-chemischen Ablation (MOCA, ClariveinR) eine Kombination von mechanischem und chemischem Trauma auf das Endothel und die Venenwandstrukuren genutzt (Abb. 11). Ein elektrisch betriebener Rotor wird manuell unter songraphischer Kontrolle langsam von proximal nach distal gezogen und gleichzeitig flüssiges Sklerosierungsmittel über den Katheter in das Venenlumen eingespritzt [4]. Die Effektivität ist im kurzfristigen Verlauf gut. Im Langzeitverlauf werden die funktionellen und klinischen Ergebnisse möglicherweise schlechter [60].
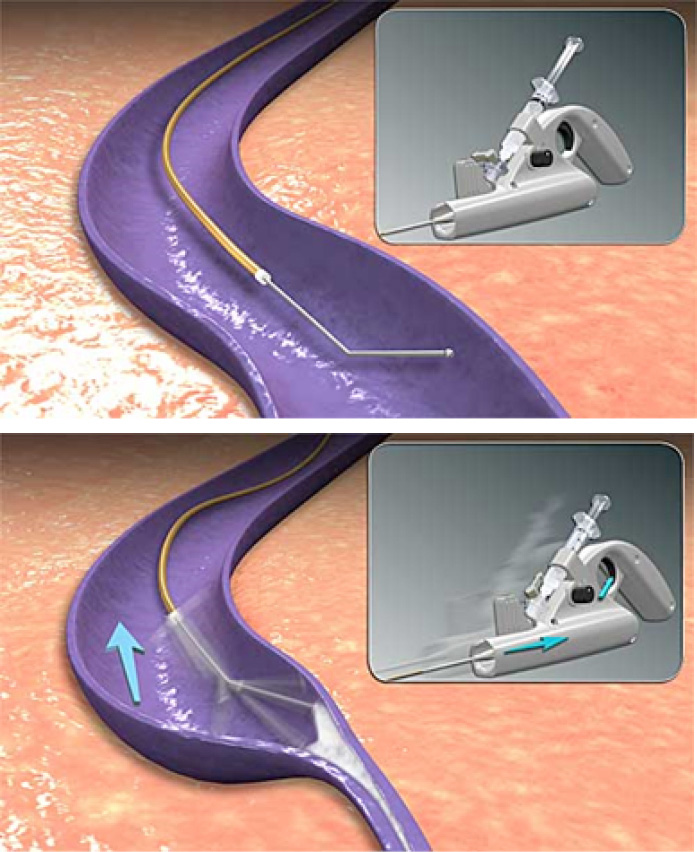
Abb. 11: Mechano-chemische Ablation (MOCA) bzw. ClariveinR
Eine weitere non-thermische bzw. endochemische Therapieoption ist die Okklusion der insuffizienten Stammvene mit Akrylatkleber (VenaSealR, Fa. Medtronic), welche über ein spezielles Injektionssystem sonographisch kontrolliert in die Vene injiziert wird (Abb. 12). Die bisher zur Verfügung stehenden klinischen Daten deuten zumindest bei kurzfristiger Nachuntersuchung eine effektive Okklusion an [27]. Allerdings werden auch unerwünschte Ereignisse wie akzentuierte Heilungsreaktionen oder Phlebitiden der behandelten Stammvene beobachtet [1]. Die Effektivität der Behandlung von großlumigen insuffizienten Stammvenen (> 6,5 mm) ist möglicherweise reduziert [6].
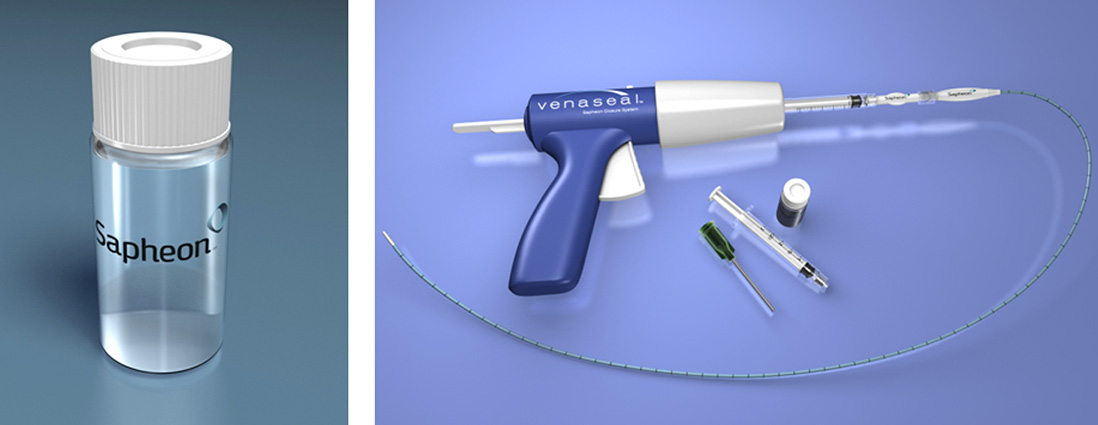
Abb. 12: Occlusion der insuffizienten Stammvene mit Akrylatkleber (hier: VenaSealR, Fa. Medtronic)
Therapie der Perforansveneninsuffizienz
Die hämodynamische bzw. pathologische Bedeutung von insuffizienten Stammvenen wird kontrovers diskutiert. Perforansvenen mit einem Durchmesser von >3mm, nachgewiesenem Reflux und passenden klinischen Beschwerden sollten behandelt werden. Die offene Ligatur nach Hautinzision über der zuvor markierten Perforansvene ist die klassische Behandlungsform.
Alternativ ist die thermische Obliteration mit Laser oder Radiofrequenz beschrieben.
Die endoskopische subfasziale Dissektion der Perforansvenen (ESDP) kann bei Perforansvenen im Bereich entzündlich veränderter Haut oder floriden Ulcerationen sinnvoll sein [19]. Diese Therapieform wird heute jedoch nur noch selten angewendet.
Therapie der Seitenastvarikosis
Die Seitenastvarikosis wird meist im Sinne einer Mini-Phlebektomie über Stichinzisionen nach Muller/Varady behandelt [29] (Abb. 13). Alternativ ist die Flüssig- und Schaumsklerotherapie möglich. Konzentration und Menge des Sklerosierungsmittels richten sich nach dem Durchmesser bzw. dem Volumen der zu behandelnden Varizen [40]. Zu möglichen unerwünschten Ereignissen der Sklerotherapie gehören Hautnekrosen, Matting, Hyperpigmentierung und allergische Reaktionen. Bei chirurgischer Seitenastexhairese kann es zur Alteration von Hautnerven mit konsekutiver Dysästhesie kommen. In der Diskussion ist der optimale Zeitpunkt zur Behandlung der Seitenastvarikose. Überwiegend wird eine simultane Behandlung der Seitenastvarikosis in gleicher Sitzung mit der Sanierung der Stammveneninsuffizienz empfohlen [14].
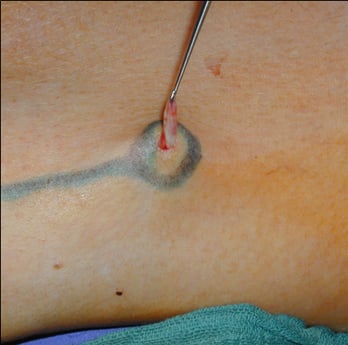
Abb. 13: Mini-Phlebektomie nach Muller/Varady
Therapie der Besenreiservarikosis
Besenreiservarizen können mit Flüssigsklerosierung (z. B. Polidocanol), transkutaner Radiofrequenztherapie (z. B. F-Care Systems TC 3000) oder transcutaner Lasertherapie (TCL) behandelt werden. Im Vergleich zur Sklerotherapie ist die Lasertherapie weniger effektiv, erfordert mehrere Therapiesitzungen und ist teurer [61]. Allerdings gibt es auch gute Indikationen für die Lasertherapie wie beispielsweise Allergie gegen Sklerotherapeutika, Spritzenphobie oder Therapieversagen nach Sklerotherapie.
Nachbehandlung
Eine postoperative Thromboseprophylaxe ist nur bei vorliegender Thrombophilie oder TVT in der Anamnese erforderlich. Eine generelle medikamentöse Thromboseprophylaxe nach Operationen bzw. Interventionen am epifaszialen Venensystem ist nicht erforderlich.
Ein Kompressionsbehandlung mit elastischen Kurzzugbinden oder Kompressionsstrümpfen der Klasse II nach Maß wird nach Veneneingriffen prinzipiell empfohlen. Eine Ausnahme bildet hier die Behandlung mit Akrylatkleber, hier wird keine Kompressionstherapie gefordert. Über die Dauer der Kompression existieren unterschiedliche Empfehlungen. Eine aktuelle Meta-Analyse zeigte keine signifikanten Unterschiede zwischen kurzfristiger (3 bis 10 Tage) und langfristiger (3 bis 6 Wochen) Kompressionstherapie bei der Reduktion postoperativer Schmerzen, Schwellungen, Komplikationen und Arbeitsunfähigkeit [21]. Eine pragmatische Empfehlung ist die Fortführung der Kompressionstherapie über den zehnten postoperativen Tag hinaus, nur wenn diese vom Patienten als angenehm empfunden wird oder ein anderer Grund für eine kontinuierliche Kompressionstherapie wie tiefe Leitveneninsuffizienz, PTS oder Lymphödem vorliegt.
Nach endovenöser Therapie sollte innerhalb der ersten Tage nach der Prozedur eine duplexsonographische Untersuchung erfolgen, um eine Thrombuspropagation in das tiefe Leitvenensystem zu detektieren und dann konsequent zu behandeln. Je nach Ausmaß der Thrombuspropagation wird eine kurzzeitige Antikoagulation mit NMH oder eine orale Antikoagulation empfohlen [18, 24]. Zur Klassifikation wurde der Begriff Endovenous Heat Induced Thrombus (EHIT) geprägt. Reicht der EHIT bis unmittelbar an die Tiefe Vene heran (Level C) wird eine Antikoagulation als fakultativ angesehen. Ragt der EHIT jedoch in die tiefe Leitvenen hinein (Level D und E), liegt formell eine TVT vor. Hier sollte eine therapeutische Antikoagulation mit Niedermolekularem Heparin oder oralen Antikoagulantien durchgeführt werden.
 Vergleich und Auswahl der Therapieverfahren
Vergleich und Auswahl der Therapieverfahren
Zur wissenschaftlichen Bewertung der einzelnen Therapieverfahren liegen zur offenen Operation, EVLA, RFA und Schaumsklerotherapie zahlreiche randomisierte kontrollierte Studien vor [25, 55, 54]. Hierbei sind Parameter zur Beurteilung der Sicherheit (unerwünschte Ereignisse, Komplikationen), Effektivität (Verschlussrate, Rekanalisationsrate, Rezidivreflux, klinische und funktionelle Scores), dem periprozeduralem Komfort (Schmerzen, Rekonvaleszenz, Arbeitsunfähigkeit, Lebensqualität) und die Kosten (Material, Zeit) von besonderem Interesse. Zahlreiche randomisierte kontrollierte Studien wurden in mehreren Meta-Analysen zusammengefasst vor [31, 37, 49].
Die Tabelle 4 fasst die zur Verfügung stehenden Daten zu den o. g. Parametern plakativ zusammen. Alle Verfahren erscheinen sicher. Schwerwiegende Komplikationen werden bei keiner der Therapieoptionen beobachtet. Die Effektivität in Bezug auf die dauerhafte Eliminierung des epifaszialen Refluxes scheint ebenfalls vergleichbar. Hier führt nur die Schaumsklerotherapie zu schlechteren Ergebnissen. Allerdings kann die Behandlung mehrmals wiederholt werden. Bezüglich des Komforts bestehen offenbar Vorteile bei den endovenösen Behandlungsformen im Vergleich zur offenen Operation, da hier das Operationstrauma geringer ist. Geringerer Schmerzmittelbedarf und eine schnellere Rekonvaleszenz werden häufig berichtet. Allerdings sind endovenöse thermische Behandlungssonden und auch die Therapiesonde zur MOCA oder zur Acrylatklebung Einmalprodukte und teurer als eine Strippingsonde oder Sklerosierungsmittel.
Unerwünschte Ereignisse werden nach allen Behandlungsverfahren nur relativ selten beobachtet. Aufgrund der natürlichen Progredienz der Grunderkrankung sollten alle Patienten über die Möglichkeit von erneuten klinischen Zeichen und Beschwerden der chronischen venösen Insuffizienz bzw. Varikosis aufgeklärt werden.
Tab. 4: Bewertung der wichtigsten Therapieverfahren der Stammveneninsuffizienz anhand der Studiendaten und Leitlinienempfehlungen
|
Krossektomie/ Stripping |
Laser |
Radiofrequenz |
Schaum-sklerotherapie |
|
|
Sicherheit |
+ |
+ |
+ |
+ |
|
Effektivität |
+ |
(+) |
(+) |
– |
|
Patientenkomfort |
– |
+ |
+ |
+ |
|
Behandlungskosten |
(+) |
– |
– |
+ |
Bei der Strippingoperation stehen schmerzhafte subcutane Hämatome und Alterationen von Hautnerven im Vordergrund. Nach chirurgischer Seitenastexhairese kann es zu umschriebenen Dysästhesien kommen. Wundheilungsstörungen oder Lymphozelen sind prinzipiell möglich, aber selten.
Im Zusammenhang mit endovenöser thermischer Therapie muss über die Möglichkeit einer Non-Okklusion oder Rekanalisation der behandelten Vene aufgeklärt werden. Bei nicht adäquater Entleerung der Vene bzw. fehlender Trendelenburg Lagerung kann eine Thrombophlebitis der behandelten Vene auftreten. Prinzipiell kann eine Thrombuspropagation in das tiefe Leitvenensystem bzw. ein endovenöser hitzeinduzierter Thrombus (EHIT) entstehen (Abb.14). Diese sollten frühzeitig ausgeschlossen bzw. detektiert und dann durch Thrombozytenaggregationshemmung oder Antikoagulation behandelt werden [22]. Bisher sind keine Berichte über klinisch signifikante Lungenembolien bekannt. Sporadisch werden Hyperpigmentierungen über dem Venenverlauf beobachtet, insbesondere nach Behandlung von relativ oberflächlich verlaufenden Stammvenensegmenten oder schlanken Patienten. Manche Patienten berichten über Missempfindungen oder eine Verhärtung im Verlauf der thermisch behandelten Vene. Nach endovenöser non-thermischer Therapie können neben Non-Okklusionen und Rekanalisationen auch akzentuierte Heilungsreaktionen und Phlebitis ähnliche Beschwerden beobachtet werden.
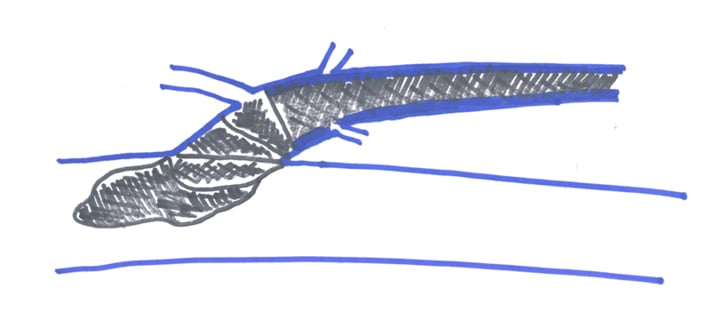
Abb. 14: Hitzeinduzierte Occlusion und Thrombuspropagation aus der endovenös thermisch behandelten V. saphena magna in die V. femoralis communis. Klassifikation nach Lawrence: Level A: Occlusion peripher der V. epigastrica superficialis, Level B: Occlusion zentral der V. epigastrica superficialis, Level C: EHIT (Endovenös hitzeinduzierter Thrombus) reicht bis an die V. femoralis communis (VFC) heran, Level D: EHIT reicht wenige Millimeter in die VFC, Level E: EHIT reicht >5mm in die VFC
Leitlinien
Die deutschsprachige Leitlinie zur Diagnostik und Behandlung des Krampfaderleidens stammt aus dem Jahre 2010 [33]. Derzeit wird eine aktualisierte Leitlinie erarbeitet, die voraussichtlich Ende 2017 publiziert wird.
In den USA wurde eine Leitlinie des American Venous Forum [15] und in Großbritannien eine Leitlinie des National Institute for Health and Carel Evidence (NICE) publiziert. Außerdem wurde eine umfangreiche Leitlinie der European Society for Vascular Surgery (ESVS) veröffentlicht [61]. Aufgrund der hohen Sicherheit und der geringeren Invasivität und Schmerzbelastung werden in den o. g. Leitlinien als Therapie der Wahl bei Stammveneninsuffizienz primär endovenöse thermische Verfahren (Radiofrequenz, Laser) vorgeschlagen.
Diese Einschätzung wird in Deutschland noch kontrovers diskutiert. Viele der Studien, die Vorteile bei Komfort, Schmerz und Rekonvaleszenz für die endovenösen Therapien zeigen, wurden von Firmen gesponsert, die Materialien für endovenöse Verfahren herstellen bzw. vertreiben. Mit einer standardisiert durchgeführten, offenen Operation mit Krossektomie und Stripping kann im Vergleich zu den Ergebnissen endovenöser Verfahren ebenfalls ein sehr gutes und nachhaltiges Ergebnis erzielt werden [36].
Varikosis-Register der DGG
Nach langer Vorbereitungszeit wird voraussichtlich 2017 ein webbasiertes Dokumentationssystem zur Erhebung aller Venenoperationen der teilnehmenden Praxen und Kliniken zur Verfügung stehen. Mit der Erfassung aller konsekutiven Veneneingriffe soll eine Bestandsaufnahme der im klinischen Alltag durchgeführten diagnostischen und therapeutischen Maßnahmen erfolgen. Durch die Erfassung unerwünschter Ereignisse im Zusammenhang mit der Behandlung können wichtige Daten zur periprozeduralen Morbidität gewonnen werden. Durch die Erstellung von Benchmark Daten ist ein Vergleich der teilnehmenden Zentren möglich.
Schmedt CG. Chirurgische Therapie der primären Varikosis – Offene und endovenöse Therapieoptionen. Passion Chirurgie. 2017 September, 7(09): Artikel 03_02.