23.02.2022 Krankenhaus
BDC-Praxistest: Künstliche Intelligenz in der Chirurgie

Vorwort
Liebe Kolleginnen und Kollegen,
eine im Herbst 2018 unter 2.000 deutschen Verbrauchern durchgeführte Studie von VMware ging der Frage nach, in welchem Maße potentielle Nutzer künstlicher Intelligenz (KI) vertrauen, wenn es um das hohe Gut ihrer Gesundheit geht. Die Studienergebnisse werden begeisterte Tekkies enttäuschen, ergaben sie doch neben viel Akzeptanz auch ein großes Misstrauen. Während zwar die Mehrheit der Befragten (68 %) den Einsatz von KI befürworten, um dadurch ihren älteren Familienangehörigen ein längeres Leben im eigenen Heim zu ermöglichen, würden 61 % der Deutschen einen menschlichen Chirurgen einem Roboter trotzdem immer noch vorziehen, selbst wenn der Heilungsprozess sich dadurch verlängert. Die Studie resümiert, dass die Hauptgründe für dieses Misstrauen in der Abneigung der Verbraucher die Kontrolle über bestimmte Lebensbereiche abzugeben und in der Angst vor fehlendem Datenschutz liegen. Dagegen bewerten viele Befürworter von KI in der Medizin die Thematik komplett anders: sie sind davon überzeigt, dass „KI die Medizin zur besten je dagewesenen Medizin mache, Millionen Menschen Leid ersparen und die Gesundheitssysteme weltweit gerechter, menschlicher, effizienter und sicherer machen werde“. Klingt übertrieben? Was denn nun? Blinde Begeisterung? Pures Misstrauen?
Pikanterweise beurteilte eine aktuelle Meta-Studie im Lancet aus 2019, weniger als 1 % von mehr als 20.000 KI-Studien zur medizinischen Bilddiagnostik als vertrauenswürdig. Fazit: Alea iacta non est (Nicht-Lateiner könnten jetzt ihr Smartphone zücken!). Um unsere Meinung zu schärfen hilft sicher der aktuelle Beitrag aus der Universitätsklinik Bern, in dem wir lernen, was KI für die Chirurgie bedeuten und welche Potentiale wir vielleicht heben können.
Spannende Lektüre wünschen
Prof. Dr. med. C. J. Krones und Prof. Dr. med.D. Vallböhmer


Künstliche Intelligenz (KI, engl. artificial intelligence) ist eine Technologie, die aktuell in aller Munde ist. Viele Branchen setzen große Hoffnungen in KI für die Weiterentwicklung ihrer Dienstleistungen und Produkte. Eine Vorreiterrolle spielt dabei natürlich die Informationstechnologie selbst: Sind Sie sich bewusst, dass die Auswahl der Bücher, die Ihnen zum Kauf empfohlen werden, der Vorschlag der Abendunterhaltung durch Online-Streaming-Dienste oder die Nachrichten, die Ihnen in den sozialen Medien angezeigt werden, Resultate von KI sind? Dieser Artikel erläutert die wichtigsten technischen Begriffe der KI und gibt eine Übersicht über die Erforschung und den Einsatz von KI in der Chirurgie.
Was ist künstliche Intelligenz?
Der Begriff KI wurde 1955 erstmals vom Computerwissenschaftler John McCarthy als „die Wissenschaft und Technik der Herstellung intelligenter Maschinen“ beschrieben [1]. Seither hat sich diese junge Disziplin der Computerwissenschaften in vielfältigen Anwendungen etabliert. Nur 40 Jahre nach der Erstbeschreibung von KI, hat 1997 erstmals der von IBM entwickelte Schachcomputer Deep Blue den amtierenden Weltmeister Garry Kasparov unter Turnierbedingungen besiegt [2]. Doch was ist KI wirklich, und wie wird sie angewandt?
Eine der am häufigsten verwandten KI-Anwendungen ist das maschinelle Lernen (engl. machine learning). Dabei handelt es sich um Computerprogramme, sogenannte Algorithmen, die am Beispiel (Trainings-Datensatz) das Erkennen von Mustern (Markern) erlernen. Die erlernten Muster können dann durch den Algorithmus in einem unbekannten Test-Datensatz wiedererkannt werden (Abb. 1). Da diese Methode des maschinellen Lernens von Menschen generierte Datensätze für das Training des Algorithmus benötigt, wird sie als überwachtes Lernen (engl. supervised learning) bezeichnet. Im Gegensatz dazu gibt es Anwendungen des maschinellen Lernens, bei denen keine Trainings-Datensätze geliefert werden, sondern der Algorithmus aus der Struktur der zu bewertenden Daten die Muster selbstständig erlernt. Bei diesen Anwendungen spricht man von nicht-überwachtem Lernen (engl. unsupervised learning).
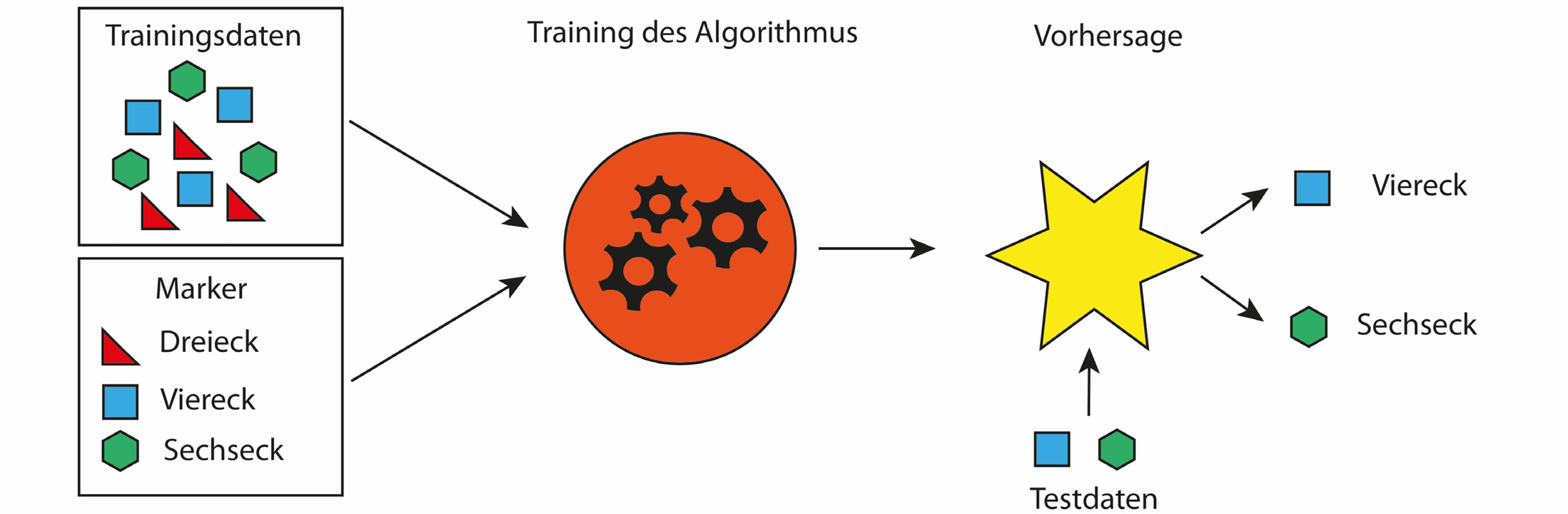
Abb. 1: Wie funktioniert überwachtes maschinelles Lernen?
Anhand von markierten Trainingsdaten wird ein Algorithmus darin trainiert die Marker von nicht markierten Testdaten vorherzusagen.
Für die Bearbeitung von Bild- und Video-Daten mittels maschinellem Lernen werden vornehmlich neuronale Netzwerke (engl. convolutional neural network) verwandt. Neuronale Netzwerke sind Algorithmen, die in Analogie zum menschlichen Gehirn auf vielen Ebenen (engl. layer) von neuronalen Verschaltungen basieren. Bei neuronalen Netzwerken werden nur der eingespeiste Datensatz (input) und der resultierende Datensatz (output: Klassifikation bei kategorischen Outcomes oder Regression bei numerischen Outcomes) definiert. Zwischen Input- und Output-Layern finden viele Zwischenrechenschritte in sogenannten versteckten Ebenen (engl. hidden layers) statt, die nicht explizit programmiert werden. Deshalb haftet KI-Anwendungen das Image von nicht nachvollziehbaren willkürlichen Entscheidungen eines Computerprogrammes an. Dem muss aber entgegnet werden, dass die Architektur eines Algorithmus im Gegensatz zum Trainings-Datensatz die Resultate einer KI-Anwendung nur wenig beeinflusst. Die aktuell verfügbaren Anwendungen der KI in der Chirurgie benutzen neuronale Netzwerke im Bereich des überwachten Lernens für die Analyse von Bild- und Video-Daten (z. B. intraoperative Standbilder oder Video-Aufzeichnungen endoskopischer Eingriffe).
Wie wird KI in der Chirurgie angewandt?
Auf drei Anwendungen von KI in der Chirurgie wird im folgenden Abschnitt näher eingegangen:
- KI zur Risikostratifizierung und Prognose von Outcomes
- KI zum Erlernen der „Sprache der Chirurgie“
- KI zur intraoperativen Unterstützung von Chirurgen
KI zur Risikostratifizierung und Prognose von Outcomes
KI-Modelle können eine Vielzahl prä- und perioperativer Variablen in die Risikostratifizierung und Prognose von Outcomes einbeziehen. Assoziationen und Interaktionen von prä- und perioperativen Risikofaktoren können von KI in einer Komplexität berechnet werden, die über lineare, uni- und multivariable Regressionsanalysen hinausgeht. Deshalb sind KI-Modelle zur Risikostratifizierung und Prognose von Outcomes in der Chirurgie besonders geeignet und zuverlässiger als konventionelle Risikokalkulatoren.
Eine der ersten KI-Anwendungen in diesem Bereich ist der „POTTER“ Risikokalkulator zur Vorhersage postoperativer Mortalität und Morbidität nach Notfalleingriffen [3]. Die Datengrundlage dieser Anwendung bildet die Datenbank des „American College of Surgeons (ACS) National Surgical Quality Improvement Program“. Mehr als 150 prä- und perioperative Variablen von über 320.000 Patienten, die zwischen 2007 und 2013 einen chirurgischen Notfalleingriff hatten, wurden für das Training des Algorithmus verwendet. Mit der Beantwortung von vier bis elf Fragen kann für jeden Patienten das 30-Tages-Mortalitätsrisiko mit einer höheren Genauigkeit als konventionelle Risiko-Scores (AUROC 0.916 vs. American Society of Anesthesia Score 0.874 vs. Emergency Surgery Score 0.891 vs. American College of Surgeons Surgical Risk Calculator 0.898) berechnet werden.
Eine vergleichbare KI-Anwendung gibt es für die Mortalität- und Morbiditäts-Vorhersage in der Unfallchirurgie in Form einer Smartphone App [4]. Der „Trauma outcome predictor“ wurde anhand der „ACS Trauma Quality Improvement Program“ Datenbank erstellt. Alle Patienten über 18 Jahre wurden eingeschlossen, die zwischen 2010 und 2016 wegen eines stumpfen oder penetrierenden Traumas behandelt wurden. Die Daten von über 745.000 Patienten wurden für das Training und die Daten von über 185.000 Patienten für die Validierung des Algorithmus verwendet. Sowohl für stumpfes als auch penetrierendes Trauma hat der „Trauma outcome predictor“ eine höhere Genauigkeit in der Mortalitätsvorhersage als der etablierte „Trauma and Injury Severity Score“ (AUROC 0.890 resp. 0.941 vs. 0.866 resp. 0.935).
Die Risikostratifikation und Outcome Vorhersage kann neben klinischen Daten auch auf präoperativer Bildgebung beruhen. In einer US-amerikanischen Studie wurden die präoperativen Computertomographie Bilder von Bauchwandhernien zur automatischen Beurteilung der chirurgischen Komplexität und Vorhersage von postoperativen Wundinfektionen verwendet [5]. Anhand von nahezu 370 Patienten und über 9300 CT-Bildern wurde der Algorithmus trainiert. Die Notwendigkeit einer Komponentenseparation zur Bauchwandhernien Versorgung wurde vom KI-Algorithmus deutlich genauer vorhergesagt als von erfahrenen Bauchwand Chirurgen (Genauigkeit 81,3 % vs. 65,0 %, p<0.001). Postoperative Wundinfektionen konnten durch den Algorithmus sehr gut vorhergesagt werden (AUROC 0.898, p<0.001).
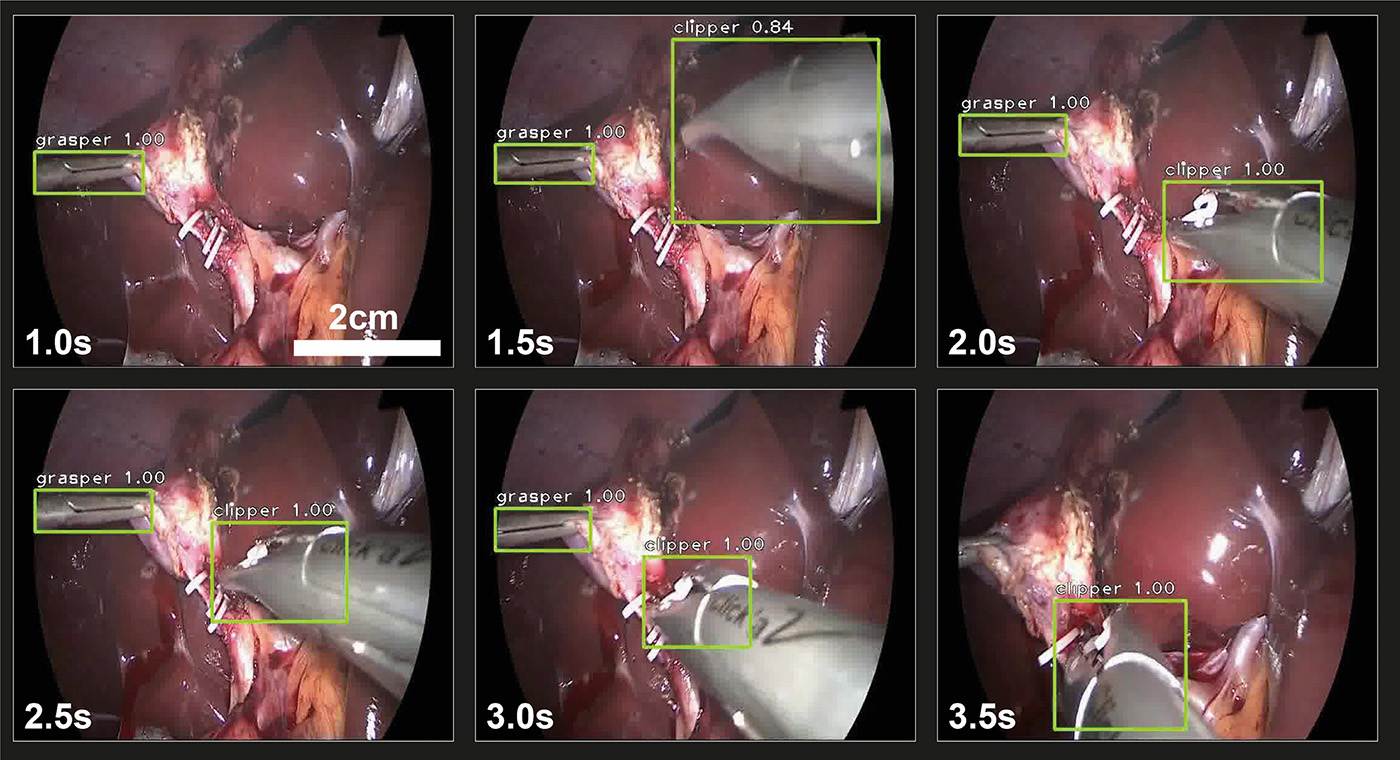
Abb. 2: Instrument-Erkennungs-Algorithmus.
Der Algorithmus identifiziert die Instrumente (grüne Boxen), klassifiziert sie (grasper = Fasszange, clipper = Clipzange) und gibt die Erkennungskonfidenz an. (6 Beispielbilder, vollständiges Video unter https://doi.org/10.1038/s41598-021-84295-6)
KI zum Erlernen der „Sprache der Chirurgie“
Damit KI die „Sprache der Chirurgie“ erlernen kann, müssen mehrstündige Eingriffe in kürzere, reproduzierbare und hierarchisch gegliederte Einheiten aufgeteilt werden. So unterteilt sich jede Operation in mehrere Phasen (Zugang, Mobilisation, Resektion, Rekonstruktion, etc.), welche sich wiederum aus mehreren Schritten (Präparation, Gefäßkontrolle, etc.) und wiederum aus repetitiven Handlungen (Schneiden, Koagulieren, Nähen, etc.) zusammensetzen. Endoskopische Eingriffe eignen sich hervorragend für das Training von KI aufgrund der einfach aufzuzeichnenden Videos und des somit vorhandenen Rohdatenmaterials. Mittels manueller Markierung des Rohdatenmaterials durch Chirurgen, wurden Algorithmen trainiert, welche die Operationsphasen in laparoskopischen Cholezystektomien [6], in laparoskopischen Sleeve-Gastrektomien [7], in laparoskopischen Magenbypass Operationen [8] und in laparoskopischen kolorektalen Eingriffen [9] identifizieren. Die Identifikation von Operationsphasen eignet sich zum Beispiel für die Analyse der durchschnittlichen Operationsdauer pro Phase und somit auch für die Vorhersage der verbleibenden Operationszeit [10].
Neben der Identifikation von Operationsphasen und -schritten ist das Erkennen der Instrumente von zentraler Bedeutung für das Verständnis der Chirurgie. Mit Hilfe von KI lassen sich laparoskopische Instrumente Identifizieren und Klassifizieren (Abb. 2). Erfolgt die Instrumentenerkennung über einen gewissen Zeitraum lassen sich Bewegungsabläufe und -muster extrahieren. Präzise Bewegungsmuster mit kurzen Wegstrecken sind charakteristisch für gute chirurgische Fähigkeiten. Durch die Analyse der Bewegungsmuster lassen sich chirurgische Fähigkeiten automatisch mittels KI beurteilen [11]. Dies ist sowohl für die Aus- und Weiterbildung von Chirurgen als auch in der Analyse von postoperativen Komplikationen wichtig.
KI zur intraoperativen Unterstützung von Chirurgen
Der nächste logische Schritt nach dem Erlernen der chirurgischen Sprache durch KI ist die Unterstützung von Chirurgen während der Operation. Diese Anwendungen stecken jedoch aktuell noch in den Kinderschuhen, da dafür Algorithmen notwendig sind, die in Echtzeit und mit beschränkten, mobilen Rechenkapazitäten funktionieren.
Da die laparoskopische Cholezystektomie ein häufiger und vergleichsweise standarisierter Eingriff mit kurzer Operationsdauer ist, basieren viele Entwicklungen in diesem Bereich auf diesem Eingriff. So wurde zum Beispiel durch eine Gruppe in Strasbourg, Frankreich ein intraoperatives Assistenzsystem entwickelt, welches mittels KI analysiert, ob während der laparoskopischen Cholezystektomie die „critical view of safety (CVS)“ erreicht wird [12]. CVS ist ein Konzept welches 1995 zur Reduktion von Gallengangsverletzungen während der laparoskopischen Cholezystektomie eingeführt wurde und beinhaltet unter anderem die sichere Visualisierung des Ductus cysticus und der Arteria cystica [13].
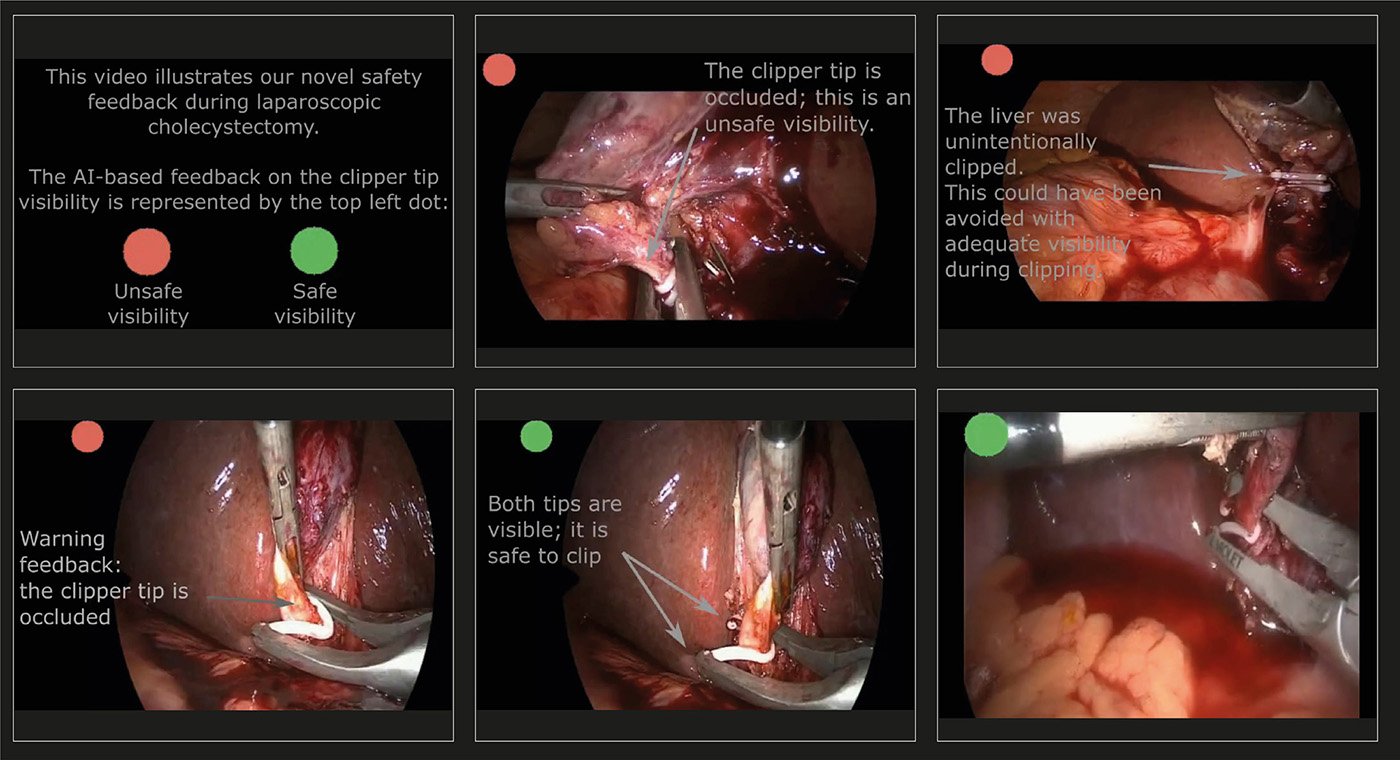
Abb. 3: Assistenzsystem
Das Assistenzsystem zeigt mit einem grünen beziehungsweise roten Punkt an, ob die Spitzen der Clipzange sichtbar beziehungsweise nicht sichtbar sind (6 Beispielspielbilder, vollständiges Video unter https://doi.org/10.1007/s11548-021-02441-x)
Da es bei der Clip Applikation an Gallenblasengang und -arterie leicht zu versehentlichem Verletzen von Nachbarstrukturen (Hauptgallengang, rechts-posteriore Leberarterie) kommen kann, wurde von unserer Gruppe ein intraoperatives Assistenzsystem entwickelt, welches mittels KI erkennt, ob die Spitzen des Clips frei sind, bevor dieser appliziert wird [14]. So wird durch visuelle Rückmeldung sichergestellt, dass die zu clippende Struktur vollständig vom Clip umfasst wird und sich keine unerwünschten Strukturen darin befinden (Abb. 3).
Ein weiteres intraoperatives Assistenzsystem analysiert mittels KI wo sich anatomisch sichere („go“) und unsichere („no-go“) Zonen für die Präparation während der laparoskopischen Cholezystektomie befinden [15]. Diese Information wird in Echtzeit mittels Einblendung über das Bild des Laparoskops projiziert, so dass die „go“ und „no-go“ Zonen im Sinne einer erweiterten Realität (engl. augmented reality) für das ganze Operationsteam (Chirurg, Assistent, OP-Pflege, Zuschauer) sichtbar sind.
Zusammenfassung
KI hat das Potential die Chirurgie nachhaltig zu verändern. Erste Schritte im Einsatz von KI für die Risikostratifikation und Prognose von Outcomes chirurgischer Patienten und zum Erlernen der „Sprache der Chirurgie“ wurden bereits unternommen. Darauf aufbauend werden Assistenzsysteme entwickelt, die den Chirurgen der Zukunft intraoperative Entscheidungshilfen in Echtzeit liefern werden. Erste Prototypen dieser KI-Assistenzsysteme existieren bereits, ihre Validierung im klinischen Einsatz ist jedoch noch ausstehend.
Literatur
[1] McCarthy J, Minsky M, Shannon CE, et al., A Proposal for the Dartmouth Summer Research Project on Artificial Intelligence. 1955.[2] IBM Research | Deep Blue |. [cited 2021 15.09.2021]; Available from: https://web.archive.org/web/20090212090603/http://www.research.ibm.com/deepblue/.
[3] Bertsimas D, Dunn J, Velmahos GC, et al. Surgical Risk Is Not Linear: Derivation and Validation of a Novel, User-friendly, and Machine-learning-based Predictive OpTimal Trees in Emergency Surgery Risk (POTTER) Calculator. Annals of surgery, 2018. 268(4): p. 574-583. https://doi.org/10.1097/SLA.0000000000002956.
[4] Maurer LR, Bertsimas D, Bouardi HT, et al. Trauma outcome predictor: An artificial intelligence interactive smartphone tool to predict outcomes in trauma patients. The journal of trauma and acute care surgery, 2021. 91(1): p. 93-99. https://doi.org/10.1097/TA.0000000000003158.
[5] Elhage SA, Deerenberg EB, Ayuso SA, et al. Development and Validation of Image-Based Deep Learning Models to Predict Surgical Complexity and Complications in Abdominal Wall Reconstruction. JAMA surgery, 2021. https://doi.org/10.1001/jamasurg.2021.3012.
[6] Twinanda AP, Shehata S, Mutter D, et al. EndoNet: A Deep Architecture for Recognition Tasks on Laparoscopic Videos. IEEE transactions on medical imaging, 2017. 36(1): p. 86-97. https://doi.org/10.1109/TMI.2016.2593957.
[7] Hashimoto DA, Rosman G, Witkowski ER, et al. Computer Vision Analysis of Intraoperative Video: Automated Recognition of Operative Steps in Laparoscopic Sleeve Gastrectomy. Annals of surgery, 2019. 270(3): p. 414-421. https://doi.org/10.1097/SLA.0000000000003460.
[8] Ramesh S, Dall’Alba D, Gonzalez C, et al. Multi-task temporal convolutional networks for joint recognition of surgical phases and steps in gastric bypass procedures. International journal of computer assisted radiology and surgery, 2021. 16(7): p. 1111-1119. https://doi.org/10.1007/s11548-021-02388-z.
[9] Kitaguchi D, Takeshita N, Matsuzaki H, et al. Automated laparoscopic colorectal surgery workflow recognition using artificial intelligence: Experimental research. International journal of surgery, 2020. 79: p. 88-94. https://doi.org/10.1016/j.ijsu.2020.05.015.
[10] Twinanda AP, Yengera G, Mutter D, et al. RSDNet: Learning to Predict Remaining Surgery Duration from Laparoscopic Videos Without Manual Annotations. IEEE Transactions on Medical Imaging, 2019. 38(4): p. 1069-1078. https://doi.org/10.1109/TMI.2018.2878055.
[11] Lavanchy JL, Zindel J, Kirtac K, et al. Automation of surgical skill assessment using a three-stage machine learning algorithm. Scientific reports, 2021. 11(1): p. 5197. https://doi.org/10.1038/s41598-021-84295-6.
[12] Mascagni P, Vardazaryan A, Alapatt D, et al. Artificial Intelligence for Surgical Safety: Automatic Assessment of the Critical View of Safety in Laparoscopic Cholecystectomy Using Deep Learning. Annals of surgery, 2020. https://doi.org/10.1097/SLA.0000000000004351.
[13] Strasberg SM, Hertl M,Soper NJ. An analysis of the problem of biliary injury during laparoscopic cholecystectomy. Journal of the American College of Surgeons, 1995. 180(1): p. 101-25.
[14] Aspart F, Bolmgren JL, Lavanchy JL, et al. ClipAssistNet: bringing real-time safety feedback to operating rooms. International journal of computer assisted radiology and surgery, 2021. https://doi.org/10.1007/s11548-021-02441-x.
[15] Madani A, Namazi B, Altieri MS, et al. Artificial Intelligence for Intraoperative Guidance: Using Semantic Segmentation to Identify Surgical Anatomy During Laparoscopic Cholecystectomy. Annals of surgery, 2020. https://doi.org/10.1097/SLA.0000000000004594.

Korrespondierender Autor:
Dr. med. Joël L. Lavanchy
Oberarzt Viszerale und Transplantationschirurgie
Universitätsklinik für Viszerale Chirurgie und Medizin
Inselspital, Universitätsspital Bern, Universität Bern
Freiburgstrasse
3010 Bern
Prof. Dr. med. Guido Beldi
Leitender Arzt Viszerale und Transplantationschirurgie
Universitätsklinik für Viszerale Chirurgie und Medizin
Inselspital, Universitätsspital Bern, Universität Bern
Freiburgstrasse
3010 Bern
Gesundheitspolitik
Lavanchy, J L, Beldi G: BDC-Praxistest: Künstliche Intelligenz in der Chirurgie. Passion Chirurgie. 2022 Januar/Februar; 12(01/02): Artikel 05_01.
Diesen Artikel finden Sie auf BDC|Online (www.bdc.de) unter der Rubrik Politik | Krankenhaus
Weitere aktuelle Artikel
01.10.2023 Krankenhaus
Berufspolitik Aktuell: Ersteinschätzungsrichtlinie des G-BA für Notfallpatienten vom BMG beanstandet
Das Bundeskabinett hat das Krankenhaustransparenzgesetz beschlossen. Es muss aber noch vom Parlament verabschiedet werden und angesichts des Widerstands vor allem aus den Ländern ist mit zahlreichen Änderungen zu rechnen.
24.02.2023 BDC|News
Krankenhausreform: Reaktion der Länder
Laut der Ärztezeitung hat ein neues Gutachten über die Auswirkungen der Klinikreform in den Bundesländern zu großer Unruhe geführt.
26.01.2023 BDC|News
Qualitätsberichte der Krankenhäuser in neuem Portal des G-BA einsehbar
Das neue Portal des G-BA bietet alle Informationen rund um die jährlichen Qualitätsberichte der Krankenhäuser.
16.11.2022 Pressemitteilungen
Koalitionsplan für tagesstationäre Krankenhausbehandlungen birgt erhebliche Unsicherheiten
Der aktuelle Plan der Koalition, eine sogenannte „tagesstationäre Behandlung“ über das Krankenhauspflegeentlastungsgesetz (KHPflEG) ins Sozialgesetzbuch Fünftes Buch (SGB V) aufzunehmen, weist erhebliche Unsicherheiten auf.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.