Der primäre Hyperparathyreoidismus (pHPT) ist die dritthäufigste endokrine Erkrankung. In 85-90 % der Fälle wird der pHPT durch ein singuläres Adenom verursacht. Es gibt allerdings auch Mehrdrüsenerkrankungen, die dann häufiger im Zusammenhang mit genetischen Syndromen, wie zum Beispiel bei der Multiplen Endokrinen Neoplasie 1, auftreten können [1–3]. Das Nebenschilddrüsenkarzinom ist eine Rarität und tritt bei weniger als 1 % der Patienten mit dem klinischen Bild eines pHPT auf [4]. Die einzige kausale Therapie des pHPT ist die chirurgische Entfernung der erkrankten Nebenschilddrüse [1, 5].
Klinische Symptomatik und Formen des pHPT
Mit einem Erkrankungsgipfel im Alter von 50 bis 60 Jahren ist der pHPT die häufigste Ursache einer Hyperkalziämie und wird im Erwachsenenalter bei Frauen häufiger festgestellt. Zu den typischen Symptomen gehören die Nephrolithiasis bei etwa 20 % der Betroffenen, das Vorliegen von osteoporotischen Veränderungen in etwa 30 % sowie muskuläre Beschwerden [1]. Es können auch Beschwerden im oberen Gastrointestinaltrakt auftreten. Zusätzlich sind häufig unspezifische psychische Symptome wie Antriebslosigkeit, Konzentrationsstörungen, Müdigkeit und Stimmungsschwankungen sowie depressive Stimmungslagen bis hin zu Angststörungen zu beobachten [6]. Man unterscheidet den symptomatischen pHPT vom asymptomatischen pHPT. Da beim asymptomatischen pHPT häufig okkulte Symptome vorliegen, ist es sinnvoll, eine detaillierte Anamnese zu erheben [1, 2].
Die Diagnose eines primären Hyperparathyreoidismus wird ausschließlich durch die biochemische Konstellation gestellt. Diese umfasst ein erhöhtes Calcium, ein erhöhtes Parathormon und meist ein erniedrigtes Phosphat bei häufig normaler oder wenig eingeschränkter Nierenfunktion. Schwierig ist es manchmal, den normocalciämischen pHPT zu erkennen. Hierbei ist das Calcium im hoch-normalen Bereich und das Parathormon inadäquat erhöht. Zur Diagnosestellung ist die Feststellung einer erhöhten Calciumkonzentration im Urin hilfreich. Dies sollte unabhängig davon regelhaft beim pHPT durchgeführt werden, um differentialdiagnostisch die Familiäre Hypercalciämische Hypocalciurie (FHH) auszuschließen [1–3].
Operationsindikation beim pHPT
Der symptomatische pHPT mit den typischen körperlichen und/oder psychischen Symptomen stellt eine Operationsindikation dar. Hier ist zu beachten, dass die Symptome oft vielfältig sind und in starken Abstufungen vorkommen können. Vor allem die einem pHPT häufig zugrundeliegenden psychischen Veränderungen sollten hierbei gezielt erfragt werden. Beim normokalziämischen pHPT, der biochemisch durch ein inadäquat erhöhtes Parathormon bei hochnormalem Calcium gekennzeichnet ist, gilt ebenfalls die symptomatische Erkrankung als Operationsindikation. Beim asymptomatischen Patienten muss die Indikation in Abhängigkeit der erhöhten Calciumkonzentration sowie bei der Detektion okkulter Symptome gestellt werden. In der Literatur wird mehrheitlich darüber berichtet, dass auch diese vermeintlich „asymptomatische“ Patientengruppe von der Operation profitiert [1–3, 5].
Da die Operation die einzige kausale Therapie darstellt und zudem eine niedrige Morbidität aufweist, sollte die Indikation eher großzügig gestellt werden, um Langzeitschäden beim Patienten zu vermeiden [5].
Präoperative Bildgebung beim pHPT
Der Nachweis eines Adenoms durch bildgebende und/oder funktionelle Diagnostik ist weder beweisend für das Vorhandensein eines pHPT, noch schließt umgekehrt der fehlende Nachweis eines Adenoms diese Erkrankung aus. Beim sporadischen primären Hyperparathyreoidismus liegt in etwa 85 % der Fälle ein einzelnes Adenom vor, während in den anderen Fällen eine multiglanduläre Erkrankung vorliegen kann. Der Verdacht auf eine Mehrdrüsenerkrankung kann bereits im Rahmen der präoperativen Lokalisationsdiagnostik aufkommen, wenn diese inkonklusiv ist oder keinen Nachweis eines Nebenschilddrüsenadenoms erbringt. Grundsätzlich schließt jedoch der Nachweis eines Adenoms nicht die Mehrdrüsenerkrankung aus. Die Basisdiagnostik sollte in jedem Fall eine Sonographie des Halses umfassen. Diese dient auch dazu, etwaige Begleitpathologien an der Schilddrüse auszuschließen und um diese gegebenenfalls in die Planung der operativen Therapie einzubeziehen.
In der täglichen Praxis wird häufig zusätzlich zur Sonographie eine funktionelle Bildgebung durchgeführt. Dies wird vor allem angeraten, wenn die Sonographie nicht erfolgreich dabei ist, ein Nebenschilddrüsenadenom zu detektieren, um eine extrazervikale Lokalisation auszuschließen [1]. Hierfür wird häufig eine SESTA-MIBI-Szintigraphie durchgeführt. Auf Basis eigener Erfahrungen sehen wir den Sinn dieser Untersuchung kritisch: Im eigenen Patientenkollektiv haben wir über 600 Patienten mit pHPT retrospektiv in Bezug auf die Bildgebung untersucht. Hierin hat sich gezeigt, dass die Sonographie in 77 % der Fälle erfolgreich war, das gesuchte Nebenschilddrüsenadenom zu detektieren. Die nachfolgende SESTA-MIBI-Szintigraphie bestätigte die sonographische Verdachtsdiagnose in den meisten Fällen. Auffällig war dagegen, dass bei den Patienten, in denen die Sonographie nicht in der Lage war, ein Adenom zu detektieren, die SESTA-MIBI-Szintigraphie nur in 25 % der Fälle das gesuchte Adenom erfolgreich detektiert hat. Dagegen führte ein 11C- Methionin- oder ein 11C-Cholin PET in 79 % der Fälle ohne sonographisch nachgewiesenes Adenom zur erfolgreichen Detektion des gesuchten Adenoms. Da ein Methionin/Cholin-PET darüber hinaus noch eine geringere Strahlenbelastung als die Szintigraphie aufweist, sollte basierend darauf zur erweiterten Diagnostik ein Methionin/Cholin-PET statt einer Szintigraphie durchgeführt werden. Hier stellt die Verfügbarkeit dieser Diagnostik sicherlich noch ein Problem dar, was die praktische Umsetzung dieses Vorschlags erschweren dürfte [7].
„Offene Parathyreoidektomie“ versus „Offen Minimal Invasive Parathyreoidektomie“ (OMIP) zur Therapie des pHPT
Es existieren mehrere Möglichkeiten, wie ein Nebenschilddrüsenadenom entfernt werden kann. Grundsätzlich kann die Entfernung der erkrankten Nebenschilddrüse über einen fokussierten Zugang im Rahmen einer „offen minimal invasiven Parathyreoidektomie“ (OMIP) erfolgen. Hierbei wird der „Kocher’sche Kragenschnitt“ etwa 2 Querfinger über dem Jugulum nur über eine Länge von 1-2 cm durchgeführt, um darüber die erkrankte Nebenschilddrüse zu entfernen. Der konventionelle Zugang ist etwas länger (3-5 cm). Der Vorteil bei der OMIP beziehungsweise des fokussierten Vorgehens ist neben der besseren Kosmetik durch den kleineren Zugang auch, dass in einer größeren Metaanalyse mit knapp 12.000 Patienten ein geringeres Risiko für eine Recurrensparese und eine postoperative Nachblutung sowie weniger postoperative Hypocalciämien beschrieben wurde [8]. Diese Vorteile des fokussierten Vorgehens wurden allerdings in einem Cochrane Review nur teilweise bestätigt [9]. Voraussetzung für die Durchführung einer OMIP ist die eindeutige präoperative Lokalisation des Adenoms. Technisch ist die Durchführung einer OMIP bei dorsokranial der Schilddrüse gelegenen Adenomen und bei anatomisch „kurzem“ und adipösen Hals häufig wenig sinnvoll und muss mit dem Patienten individuell diskutiert werden. Bei gleichzeitiger Indikation zur Sanierung der Schilddrüse und bei Mehrdrüsenerkrankung ist die Durchführung einer OMIP ebenfalls nicht möglich.
Ablauf einer Nebenschilddrüsenoperation
Die Nebenschilddrüsenoperationen werden in unserem Haus grundsätzlich in Vollnarkose durchgeführt. Hierbei wird zur kontrollierten Beatmung der Patientinnen und Patienten während der Narkose ein endotrachealer „Stimulationstubus“ eingebracht. Dieser wird unter videolaryngoskopischer Kontrolle so platziert, dass eine Ableitung von EMG-Signalen am M. vocalis zum Neuromonitoring des Nervus laryngeus recurrens möglich wird. Im Rahmen der Narkoseeinleitung erfolgt die Abnahme von Blut zur Messung des basalen Parathormonwerts.
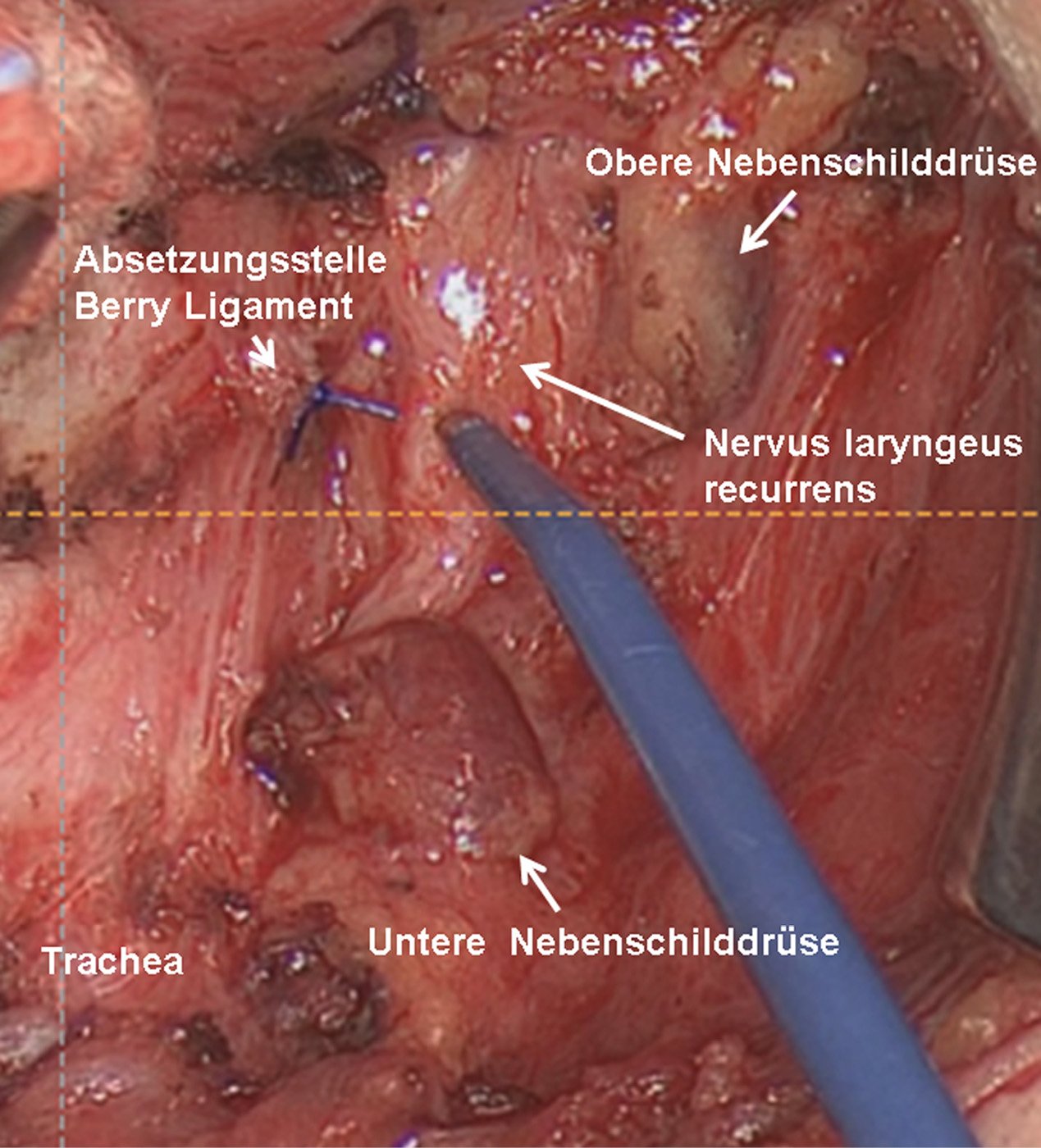
Nach Lagerung des Patienten in leichter Reklination erfolgt der Hautschnitt über einen Kocher’schen Kragenschnitt und nach Eröffnung der Halsfaszie die Darstellung der erkrankten Nebenschilddrüse entsprechend der präoperativen Lokalisationsdiagnostik. Nur wenn die identifizierte Nebenschilddrüse makroskopisch eindeutig verändert erscheint, wird diese exstirpiert. Hierzu erfolgt dann die Ligatur der versorgenden Gefäße. Die entnommene Nebenschilddrüse wird dann immer zur Schnellschnittuntersuchung in die Pathologie geschickt. Diese bestätigt zum einen, dass es sich beim entnommenen Gewebe tatsächlich um Nebenschilddrüsengewebe handelt. Zum anderen kann der Pathologe eine Einschätzung abgeben, ob es sich um adenomatös verändertes Nebenschilddrüsengewebe handelt. Diese Einschätzung ist allerdings mit Unsicherheiten verbunden [10]. Die eindeutige Diagnose eines äußerst seltenen Nebenschilddrüsenkarzinoms ist im Schnellschnitt nur im Ausnahmefall möglich [4].
Wichtiger als der histologische Schnellschnitt ist die Messung des Parathormonwerts nach der Exstirpation. Diese wird auch als „biochemischer Schnellschnitt“ bezeichnet. Hierbei macht man sich die Eigenschaft einer sehr kurzen Halbwertszeit des Parathormons von circa 5-6 Minuten zu Nutze. Um von einer erfolgreichen Adenomexstirpation zu sprechen, muss der Parathormonwert signifikant abfallen. Hierfür existieren verschiedene Kriterien. In unserem Hause wurde festgelegt, dass der Parathormonwert 15-20 min nach Exstirpation des Adenoms auf 10 % des Basalwerts abgefallen sein muss. Andernfalls muss eine Fortsetzung der Operation mit Exploration der übrigen Nebenschilddrüsen erfolgen. Aus diesem Grund bleibt der Patient in unserem Hause immer in Narkose, bis die Messung nach Exstirpation des Adenoms vorliegt und eine biochemische Heilung gesichert ist [11].
Das rechtzeitige Erkennen einer Mehrdrüsenerkrankung kann einen wiederholten Eingriff bei Persistenz der Erkrankung ersparen. Dieser ist in der Regel mit einer deutlich erhöhten Rate von Recurrensparesen oder persistierendem Hypoparathyreoidismus verbunden. Beides führt zu einer deutlichen Einschränkung der Lebensqualität und ist durch die intraoperative Messung des Parathormonwerts vermeidbar.
Postoperativer Verlauf und Nachbehandlung
Im direkten postoperativen Verlauf erfolgt die engmaschige Überwachung der Patienten, um eine etwaige Nachblutung frühzeitig erkennen zu können. Am ersten postoperativen Tag erfolgt eine Messung des Calciums. Gleichzeitig werden etwaige Hypocalciämiesymptome (Kribbelparästhesien, periorales Taubheitsgefühl der Haut, Tetanieneigung etc.) gezielt evaluiert. Gelegentlich kann es zu derartigen Symptomen kommen, bis die Funktion der übrigen gesunden Nebenschilddrüsen wieder adäquat ist oder, wenn ein „Hungry bone“-Syndrom vorliegt. In diesen Fällen sollte eine vorübergehende Substitution mit aktivem Vitamin und Calcium erfolgen. Eine Wundkontrolle sowie die postoperative Kontrolle der regelrechten Stimmlippenbeweglichkeit durch den Hals-Nasen-Ohren-Arzt gehören ebenfalls zu den Untersuchungen am ersten postoperativen Tag. In der Regel erfolgt die Entlassung aus der stationären Behandlung nach 1-2 Tagen.
Da die verbliebenen Nebenschilddrüsen die Regulation des Calcium- und Phosphathaushalts vollständig übernehmen sind normalerweise keine Substitutionstherapien erforderlich. Wir empfehlen über die Hausärzte im Intervall von drei Monaten eine Calcium- und Parathormon durchzuführen, um eine Persistenz definitiv auszuschließen.
Literatur
[1] Weber, T., et al., Management of primary and renal hyperparathyroidism: guidelines from the German Association of Endocrine Surgeons (CAEK). Langenbecks Arch Surg, 2021. 406(3): p. 571-585.
[2] Bilezikian, J.P., et al., Task Force #8: Management of Primary Hyperparathyroidism. J Bone Miner Res, 2022.
[3] Brandi, M.L., et al., Management of Hypoparathyroidism: Summary Statement and Guidelines. J Clin Endocrinol Metab, 2016. 101(6): p. 2273-83.
[4] Lenschow, C., et al., Clinical Presentation, Treatment, and Outcome of Parathyroid Carcinoma: Results of the NEKAR Retrospective International Multicenter Study. Ann Surg, 2022. 275(2): p. e479-e487.
[5] Perrier, N., et al., Surgical Aspects of Primary Hyperparathyroidism. J Bone Miner Res, 2022.
[6] Chandran, M., et al., Cognitive deficits in primary hyperparathyroidism – what we know and what we do not know: A narrative review. Rev Endocr Metab Disord, 2022.
[7] Lenschow, C., et al., Questionable value of [(99m)Tc]-sestamibi scintigraphy in patients with pHPT and negative ultrasound. Langenbecks Arch Surg, 2022.
[8] Singh Ospina, N.M., et al., Outcomes of Parathyroidectomy in Patients with Primary Hyperparathyroidism: A Systematic Review and Meta-analysis. World J Surg, 2016. 40(10): p. 2359-77.
[9] Ahmadieh, H., et al., Minimally invasive parathyroidectomy guided by intraoperative parathyroid hormone monitoring (IOPTH) and preoperative imaging versus bilateral neck exploration for primary hyperparathyroidism in adults. Cochrane Database Syst Rev, 2020. 10: p. CD010787.
[10] Sheu-Grabellus, S.Y. and K.W. Schmid, [Pathology of parathyroid glands: Practical aspects for routine pathological investigations]. Pathologe, 2015. 36(3): p. 229-36.
[11] Lorenz, K., R. Schneider, and M. Elwerr, [Intraoperative measurement of parathyroid hormone in hyperparathyroidism]. Chirurg, 2020. 91(6): p. 448-455.
BDC|Akademie

Facharztseminar ViszeralchirurgieDieses Seminar dient zur Vorbereitung auf die Facharztprüfung für Viszeralchirurgie sowie als Update für Fachärzte. Von gastroenterologischen, endokrinen und onkologischen Erkrankungen über die große onkologische Chirurgie des Gastrointestinaltrakts, Hernienchirurgie, minimal-invasive Chirurgie bis hin zu Koloproktologie und Endoskopie – Referenten aus ganz Deutschland machen Sie in vier Tagen fit für Ihre Prüfung und bringen Sie auf den neuesten Stand der Behandlungsstrategien und Techniken der Viszeralchirurgie.
Facharztseminar Viszeralchirurgie in Hamburg |
Schlegel N: Diagnose und Therapie des primären Hyperparathyreoidismus (pHPT). Passion Chirurgie. 2020 Oktober; 12(10): Artikel 03_03.