01.09.2014 Fachübergreifend
Imagine A World Without Cancer: Neue Anti-Krebs-Strategie vorgeschlagen

Im Jahre 2010 wurde aufgrund demographischer Veränderungen und dem damit resultierenden Wandel um den Herausforderungen für das Sozialsystem gefordert, dass es an der Zeit sei, über Lösungen nachzudenken, damit „das System nicht unvorbereitet von der normativen Wucht des Faktischen getroffen werden“ [1, 2]. Diese Überlegungen und deren Forderung sind nicht nur richtig, sie gelten ebenfalls für Diagnostik, Therapie und Ausrichtung von Krebs und seinen notwendigen Strategien. Gesundheit ist das höchste Gut. Kliniken dienen hierbei der Volksgesundheit, dem individuellen und dem Gemeinwohl, als auch dem öffentlichen Interesse. Die Behandlung Kranker ist die oberste Aufgabe der Kliniken und ihre Finanzierung obliegt zunächst den Trägern und Eigentümern. Selbstverständlich müssen Kliniken wirtschaftlich handeln, sie sind aber keine erwerbswirtschaftlichen Unternehmen. Die Betriebskosten aller Krankenhäuser, inklusive der Unikliniken in Deutschland, werden derzeit durch Fallpauschalen der gesetzlichen Krankenkassen finanziert. Die Investitionskosten hingegen werden durch die Länder getragen (duales System). Eine besondere Aufgabe obliegt in Deutschland den Universitätskliniken, sie fungieren als Motoren von Wissenschaft und Forschung. Daneben gibt es bedeutende hochschulfreie Forschungseinrichtungen, wie unter anderem die Max-Planck-Gesellschaft, die Fraunhofer-Gesellschaft und das Helmholtz-Zentrum. Ihre Finanzierung erfolgt in Deutschland länderspezifisch unterschiedlich durch die Landeshaushalte und Eigenmittel der Kliniken.
In einigen Bundesländern wurde der Versuch unternommen, Unikliniken wie in den USA zu privatisieren. Leider wurde dabei vergessen, dass es in den USA eine komplett andere Spendenkultur gibt, die zurzeit in Deutschland fehlt. Gegenwärtig werden – sowohl in den USA als auch in Deutschland – etwa 80 Prozent der Tumorpatienten nicht in Universitätskliniken und deren national designierten Krebszentren behandelt. Die Grundlagenforschung auf dem Tumorsektor ist dagegen in den Uniklinika beheimatet.
Im Jahre 1971 wurde von Präsident Nixon der „War Against Cancer” deklariert und nach Unterzeichnung des Nationalen Krebs Plans seither ca. $ 300 Milliarden in Krebsforschung allein in den USA investiert [3]. Ein großer Schwerpunkt ist die Rolle von Genomics und Krebs-Therapie. Kohane et al. gaben 2012 den Versuch eines Ausblickes für die nächsten 100 Jahre in Medizin und bemerkten, dass Größe und Komplexität von einer notwendigen multidimensionalen Charakterisierung von Patienten zu weit komplexeren diagnostischen und prognostischen Kategorien führen wird, als bislang in Gebrauch [4].
Rund 1,7 Millionen Menschen werden in den USA 2014 an der Diagnose Krebs erkranken; damit ist im statistischen Durchschnitt fast jeder 200. Einwohner betroffen. In Europa tritt Krebs etwas häufiger auf – allerdings mit einer großen Spannbreite: In der Türkei erkrankt jedes Jahr etwa jeder 340. Bewohner an Krebs, in Frankreich einer von 160. Auch bei den Heilungschancen bestehen große regionale Unterschiede. Zudem sind Prognosen einzelner Krebsarten ebenfalls sehr different: Hoden- und Prostatakrebs sind heute für die meisten Betroffenen eine chronische Krankheit, mit der sie viele (und fast immer viele gute) Jahre leben können. Ähnlich ist es beim Melanom und beim Hodgkin-Lymphom; auch Brustkrebs ist – frühzeitig erkannt – für viele Frauen kein Todesurteil mehr. Anders sieht es nach wie vor bei Lungen- und Leberkrebs sowie bei Karzinomen der Bauchspeicheldrüse und der Speiseröhre aus. Hier war der Zugewinn an Lebenszeit in den letzten Jahrzehnten minimal, und auch die Lebensqualität hat sich kaum verbessert. Auf der einen Seite hat die Krebsforschung Vieles erreicht, in anderen Bereichen tritt sie jedoch auf der Stelle. Weiterhin scheint es geboten, jetzt entscheidende Weichen zu stellen, damit neue Forschungserkenntnisse in die Patientenbehandlung umgesetzt werden können.
Etwa seit der Jahrtausendwende hat eine neue Entwicklung bei Ärzten und Krebskranken Hoffnung geweckt: die Präzisions-Medizin. Damit ist gemeint, dass nur diejenigen Patienten ein Medikament erhalten, die voraussichtlich von ihm profitieren. Dabei werden vor der Behandlung die Tumorzellen daraufhin untersucht, ob sie sogenannte Biomarker tragen, die mit dem Ansprechen auf die Therapie verknüpft sind. Ein Beispiel ist das Eiweißmolekül „HER2/neu“, das nur bei manchen Patienten auf der Oberfläche von Epithelzellen beim Brustkrebs oder gastrointestinalen Tumoren vorkommt. Es verleiht den Zellen die Fähigkeit zur Proliferation und kann durch spezifisch wirksame Medikamente blockiert werden. Eine solche Behandlung ist nur für Patienten sinnvoll, deren Zellen diese Struktur tatsächlich aufweisen. Einige dieser Medikamente haben zwar einen gewissen Fortschritt in der Krebsbehandlung gebracht, doch viele Hoffnungen sind noch nicht erfüllt worden und es ergibt sich die Frage, ob man schon auf dem richtigen Weg ist, oder ob es sich vorwiegend um einen Terminus handelt, der noch mit Leben erfüllt werden muss.
Mit sehr hohem finanziellem, logistischem und personellem Aufwand werden seit ca. zwanzig Jahren genetische Informationen erforscht, und es wurde schon mehrfach gefordert Tumore zukünftig – analog einiger maligner Bluterkrankungen – dahingehend phänotypisch zu klassifizieren. Trotz einiger Erfolge auch seitens Immuntherapie wurde etwas Erhebliches hierbei vergessen. Es wird bislang angenommen, dass ca. fünf bis zehn % der Tumore genetisch, ca. 15 % durch Inflammation getriggert werden und immer noch 80 % sporadisch sind, sprich „unbekannte Ursache“. So verursachen hereditäre (mutationsbedingte) Tumoren nur in fünf bis zehn Prozent Tumore, bei Magentumoren weniger als ein Prozent, bei Dickdarmtumoren drei bis fünf Prozent und bei Brustkrebs lediglich rund acht Prozent. Die Frage, die sich dabei auftut ist eine logische: wie soll eine genetische Determinierung von Tumoren sinnhaft und/oder finanziert werden, wenn die Ursache für die Masse an Tumoren unbekannt ist [5].
Eine Gruppe international renommierter Krebsforscher aus 30 angesehenen Institutionen plädiert dafür, mehr Kriterien zu berücksichtigen als bisher und dies in Behandlungsentscheidung einzubinden. Hierzu ist ein neues Anti-Krebs-Strategie-Papier in der der peer-reviewed Fachzeitschrift BMC Cancer vor kurzem erschienen [4]. Vorschlag der internationalen Experten aus zwölf Ländern und in verschiedenen Tumor Disziplinen beheimatet ist es, in einem personalisierten und individualisierten Ansatz einen differenzierten personalisierte und individualisierte Strategie umzusetzen (Abb. 1).
Abb. 1: Kombinierte Strategie mit Tumor- und Patient-orientierten prädiktiven Krebs-Staging System mit Stratifizierung einer personalisierten Therapie und der Erarbeitung eines standardisierten multivariablen Response Evaluations-Systems mit der Konsequenz zukünftiger standardisierter Therapie-Modifikationen (individualisierte Krebsstrategie).
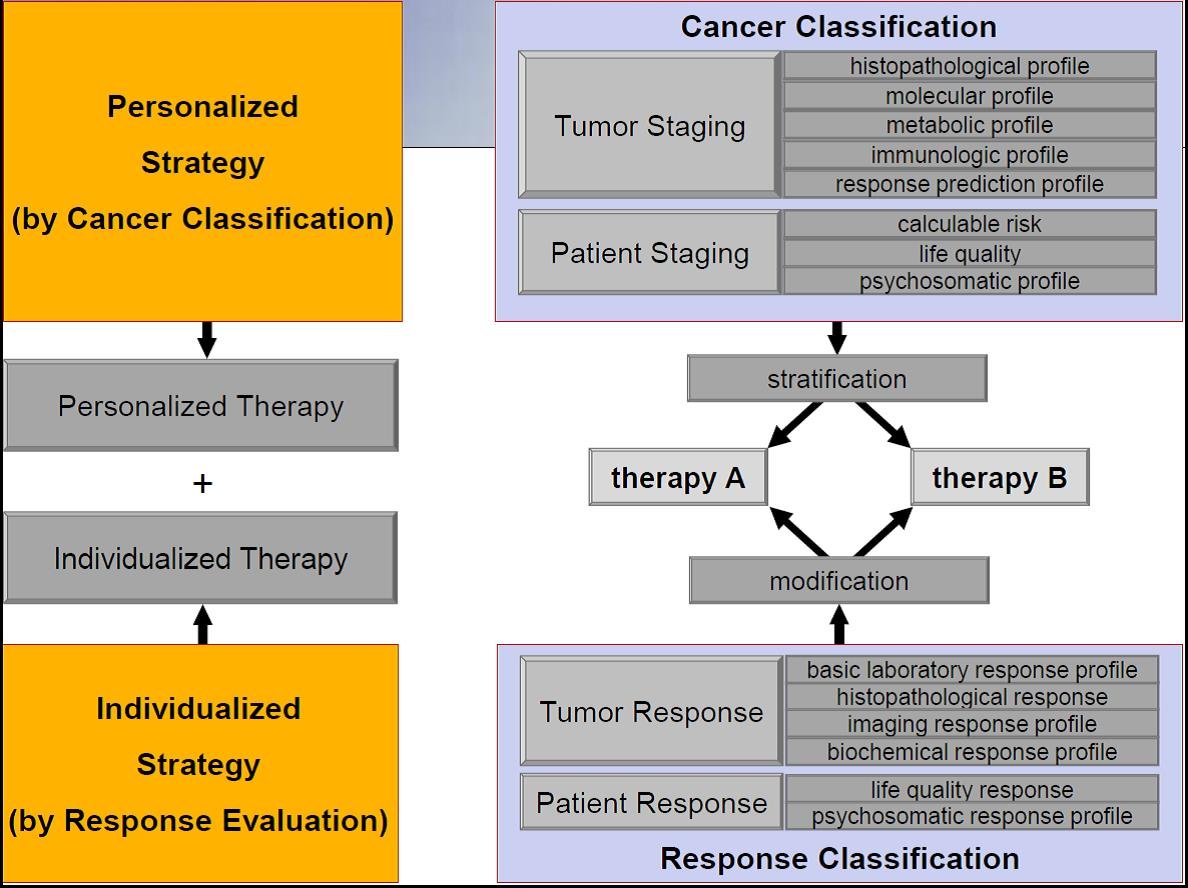
Die personalisierte Antikrebs-Strategie beinhaltet, die Kombination aus histopathologischer Tumorklassifikation (TNM) [6] zusammen mit einem zu erarbeitenden molekularen, metabolischen und immunologischen Profil sodass der Stoffwechsel der Zellen in die Beurteilung einbezogen wird, ebenso wie genetische und epigenetische Merkmale. Dieses soll ergänzt werden durch Biomarker die prädiktiv auf eine Behandlung sind (Voraussage) sowie einem kalkulierbaren Patientenrisiko, der Lebensqualität, sowie dem psychosomatischen Profil. Es wurde schon zuvor zu Recht in Deutschland gefordert, dass die Lebensqualität stärker mit einbezogen werden muss [7]. Weiterhin muss der Pathologe auch zukünftig sowohl Partner in der klinischen Versorgung als auch in der Forschung sein muss, und nicht etwa zum Erfüllungsgehilfen degradiert wird, was gelegentlich administrativ so gesehen wird. Umgekehrt wird im Rahmen einer neuen Anti-Krebs-Strategie der Pathologe nicht zum alleinigen Wächter einer Tumorklassifikation, diese muss vielmehr zu einer gemeinsamen Aufgabe aller betroffenen Fachdisziplinen werden.
Eine individualisierte Antikrebs-Strategie bedeutet, dass zielgerichtet Modifikationen des Therapiekonzepts vorgenommen werden, in Abhängigkeit der genannten Variablen und Parametern. Je nach Ansprechen auf eine Therapie wird diese geändert. Seit ca. 30 Jahren wird ein Ansprechen auf eine multimodale Therapie durch die 1981 veröffentlichten WHO Kriterien geregelt [8]. Diese seit mehr als 30 Jahren zur Anwendung kommenden Kriterien [9, 10] beruhen allerdings lediglich auf einem einzigen Experiment aus den 70er Jahren. Sie wurden weder grundlegend einer Prüfung, noch einer signifikanten Änderung und/oder Erweiterung unterzogen. Schon 2009 wurde dies in einer Veröffentlichung mit multinationaler Autorenbesetzung [11], sowie in einem Editorial im Jahre 2012 [12] gefordert. Beides wurde an die entsprechenden Institutionen übergeben – eine Reaktion blieb bislang aus. Zusammenfassend ist der aktuell zur Anwendung kommende Standard bei weitem nicht ausreichend.
Die wesentliche Konsequenz – neben zu überarbeitenden Kriterien – wird sein, Patientenmanagement-Studien zu generieren und einzufordern, damit eine für Tumorpatienten notwendige Evidenz transparent erarbeitet werden kann, denn die Ergebnisse aus solchen Studien werden selbstverständlich anschließend auf ihre Reproduzierbarkeit überprüft werden müssen. Hier wurde schon Erhebliches hinsichtlich notwendigen Beobachtungsstudien in Deutschland geleistet und kann damit weiter voran gebracht werden [13, 14]. Eine langfristig ausgerichtete individualisierte Tumortherapie wird es ermöglichen, während der Therapie schon früh festzustellen, ob ein Patient auf diese Therapie anspricht. Wenn dies nicht der Fall ist, kann ihm eine belastende Toxizität der Therapie erspart werden und so seine Lebensqualität erheblich verbessert werden.
Gerade weil national als auch international ungefähr 80% an Tumorpatienten in nicht ausgewiesenen Tumorzentren behandelt werden, obliegt es diesen zielgerichtet obige Kriterien so zu erarbeiten, damit diese transparent nachvollziehbar umsetzbar sind. Ein anderer relevanter demographischer Wandel ist die Zunahme des Lebensalters von Patienten [15]. Weiterhin nehmen auch Tumore in Entwicklungs- und Schwellenländern zu. Wenn dortige Voraussetzungen effizienter Gesundheitsstrukturen realisiert werden, ist damit auch eine beschriebene Krebsstrategie dort umsetzbar.
Die Autoren sind der Auffassung, dass nur eine klar definierte personalisierte und individualisierte Antikrebs-Strategie langfristig in eine reale präzisierte Tumor-Therapie und Strategie resultieren kann. Es besteht Hoffnung, dass dies es ermöglicht, die Mikro- und Makro-Interaktionen von Tumoren und ihrer Umgebung (Microenvironment) besser zu verstehen, um so Tumoren von Patienten besser klassifizieren zu können [16]. Überträgt man dies auf Tumore stellt man fest, dass wir noch weit davon entfernt sind, die Vision Krebs zu eradizieren oder zu heilen. Damit ist auch die vorgeschlagene Anti-Krebs-Strategie „Imagine A World Without Cancer“ eine Vision, aber eine anzugehende und realisierbare[13].
Literatur
[1] Polonius MJ: Quo vadis? BDC online 1.4.2010. http://www.bdc.de/index_level3.jsp?documentid=BC7647F4118FE46DC12577060035C26A&form=Dokumente&parent=175CB488D795B325C2256FC50050F2CC&menu_id=null&category=DER BDC-NEWS-BDC-INTERN
[2] Bruch HB: Quo vadis Chirurgia? BDC online 1.4.2011. http://www.bdc.de/index_level3.jsp? documentid=58017A97F9C219C3C1257886002EE7A8&form=Dokumente
[3] Brücher BLDM, Lyman G, van Hillegersberg R, Pollock RE, Lordick F, Yang HK, Ushijima T, Yeoh KG, Skricka T, Polkowski W, Wallner G, Verwaal V, Garofalo A, D’Ugo D, Roviello F, Steinau HU, Wallace TJ, Daumer M, Maihle N, Reid III TJ, Ducreux M, Kitagawa Y, Knuth A, Zilberstein B, Steele SR, Jamall IS (2014): Imagine a World Without Cancer. BMC Cancer 2014;14:186. http://www.biomedcentral.com/1471-2407/14/186
[4] Kohane IS, Drazen JM, Campion EW: A Glimpse of the next 100 years in Medicine. N Engl J Med 2012, 367(26):2358-2539. http://www.nejm.org/doi/full/10.1056/NEJMe1213371
[5] Brücher BLDM, Jamall IS (2014): Epistemology of the Origin of Cancer: A New Paradigm. BMC Cancer 2014;14(1):331. http://www.biomedcentral.com/1471-2407/14/331
[6] Sobin LH, Gospodarowicz MK, Wittekind C: TNM classification of malignant tumors, Volume 7. Oxford: Wiley-Blackwell; 2010.
[7] Burghofer K, Lackner CK, Jauch KW: [Empathy in surgery. Awareness of the quality of life in patients with rectal carcinoma]. Chirurg 2007;78(6):552:554-558,560.
[8] Miller AB, Hoogstraten B, Staquet M, Winkler A: Reporting results of cancer treatment. Cancer 1981;47(1):207–214. http://onlinelibrary.wiley.com/doi/10.1002/1097-0142(19810101)47:1%3C207::AID-CNCR2820470134%3E3.0.CO;2-6/abstract
[9] Therasse P, Arbuck SG, Eisenhauer EA, Wanders J, Kaplan RS, Rubinstein L, Verweij J, Van Glabbeke M, van Oosterom AT, Christian MC, Gwyther SG: New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst 2000;92(3):205–216. http://jnci.oxfordjournals.org/content/92/3/205.long
[10] James K, Eisenhauer E, Christian M, Terenziani M, Vena D, Muldal A, Therasse P: Measuring response in solid tumors: unidimensional versus bidimensional measurement. J Natl Cancer Inst 1999;91(6):523–528. http://jnci.oxfordjournals.org/content/91/6/523.long
[11] Brücher BLDM, Swisher S, Konigsrainer H, Zieker D, Hartmann J, Stein H, Kitagawa Y, Law S, Ajani JA: Response to preoperative therapy in upper gastrointestinal cancers. Ann Surg Oncol 2009;16(4):878–886.
[12] Brücher BLDM, Bilchik A, Nissan A, Avital I, Stojadinovic A: Tumor response criteria: are they appropriate? Future Oncology 2012;8(8):903–906.
[13] Meyer L, Steinert R, Nowak L, Gellert K, Ludwig K, Saeger D, Gastinger I, Lippert H: Prospective multicenter trial of gastric cancer surgery– a contribution to clinical research on quality control. Zentralbl Chir 2005;130(2):97-105. https://www.thieme-connect.com/DOI/DOI?10.1055/s-2005-836491
[14] Ridwelski K, Gastinger I, Ptok H, Meyer F, Dralle H, Lippert H: Surgical treatment of gastric carcinoma. German multicenter observational studies. Chirurg 2013;84(1):46-52.
[15] Jansen M, Schumpelick V: Development of general and visceral surgery over the next 20 years. Chirurg 2009; 80(12): 1095-1098.
[16] Brücher BLDM, Jamall IS (2014): Cell-Cell communication in tumor microenvironment, carcinogenesis, and anticancer treatment. Cell Physiol Biochem 2014;34(2):213-243. http://www.karger.com/Article/FullText/362978
Autor des Artikels
Prof. Dr. Björn Brücher
Professor of SurgeryTheodor-Billroth-Academy®, Munich, Germany – Jerusalem, Israel – Richmond, VA, USA.INCORE, International Consortium of Research Excellence of the Theodor- Billroth-Academy®, Germany – Israel – Serbia - USA Bon Secours Cancer Institute, Richmond, VA, USA kontaktierenWeitere aktuelle Artikel
10.02.2026 BDC|News
Neue Ausgabe der Passion Chirurgie: Perioperatives Management
erioperatives Management steht im Fokus der Januar/Februar-Ausgabe. Drei Fachbeiträge beleuchten das Thema – von den zehn wichtigsten Maßnahmen im perioperativen Management, über den idealisierten Workflow im Zentral-OP bis hin zur Prähabilitation zwischen theoretischem Anspruch und praktischer Umsetzung. Viel Spaß beim Lesen!
20.01.2026 Fachübergreifend
Prähabilitation – vom theoretischen Ideal zur praktischen Umsetzung
Lange wurde dem Allgemeinzustand von Patient:innen vor onkologischen Eingriffen wenig Aufmerksamkeit geschenkt. Es galt die Devise, den Tumor so rasch wie möglich nach Diagnosestellung zu entfernen.
20.01.2026 Fachübergreifend
Prozessmanagement – Der idealisierte WorKFlow in einem Zentral-OP
Der idealisierte Workflow im Zentral-OP ergibt sich aus einer hochgradig standardisierten und zunehmend digital orchestrierten Prozesslandschaft.
20.01.2026 Fachübergreifend
Perioperatives Management – das sind die 10 wichtigsten Maßnahmen
In der modernen Chirurgie spielen viele Maßnahmen bezüglich eines adäquaten prä-, intra- und postoperativen Managements eine relevante Rolle, um die Krankenhausverweildauer sowie die Morbidität und Mortalität der Patient:innen zu reduzieren.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.