01.06.2014 Fachübergreifend
Sulforaphan – eine sinnvolle Ergänzung zur Chemotherapie beim Pankreaskarzinom?

Das Pankreaskarzinom
Das Pankreaskarzinom stellt die vierthäufigste krebsbedingte Todesursache in Deutschland dar. Mit einem gesamten Fünf-Jahres-Überleben von nur 6 % ist das Pankreaskarzinom eines der aggressivsten Malignome in Europa [1, 2, 3]. Trotz Standardisierung und Weiterentwickelung der Tumor-Therapie, ist eine chirurgische Tumorentfernung mit kurativem Ansatz bei nur 20 % der Patienten mit Pankreaskarzinom möglich [4], da die Erkrankung häufig aufgrund der späten Symptome erst in einem sehr fortgeschrittenen Stadium entdeckt wird [1, 5]. In diesen Fällen bleibt derzeit als einzige palliative Therapiemöglichkeit die Chemotherapie. Diese kann in Einzelfällen auch mit einer Bestrahlung (kombinierte Radio-/Chemotherapie) durchgeführt werden.
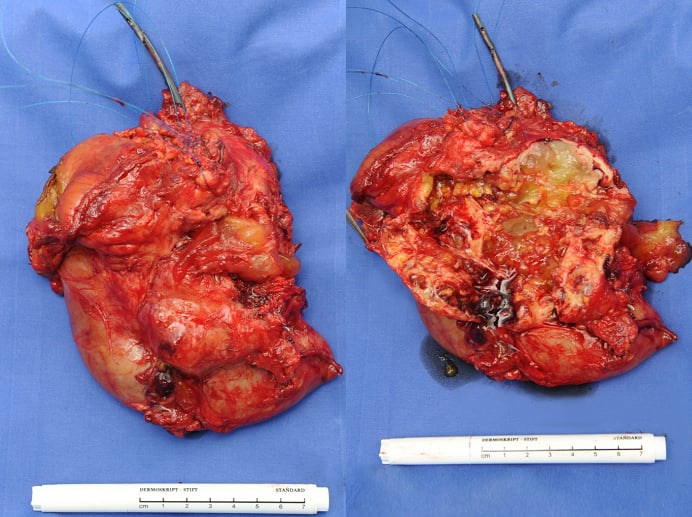
Das Pankreaskarzinom ist durch rasches, benachbarte Strukturen infiltrierendes Wachstum und frühe, vor allem lymphogene, aber auch hämatogene Metastasierung charakterisiert (Abb. 1). Sein molekulärer Modus operandi ist noch immer unvollständig geklärt und die geringe Ansprechrate auf derzeit durchgeführte Chemotherapien ein therapeutisches Dilemma. Neueste wissenschaftliche Daten sprechen für die Existenz einer Subpopulation von Tumor-initiierenden Zellen (TIZ, alternativ Tumorstammzellen (TSZ)), die für eine konventionelle, zytotoxische bzw. zytoreduktive Therapie nicht zugänglich sind [6] und daher die konventionelle Chemotherapie überleben [7]. Neben ihrer Eigenschaft unkontrolliert zu wachsen, ihrer Therapieresistenz und ihres aggressiven Metastasierungsverhaltens, besitzen die TSZ das Potenzial sich selbst zu regenerieren und zu differenzieren [8, 9, 10, 11]. Durch diese Zellpopulation lässt sich das Pankreaskarzinom auch als „Stammzell“-Krankheit definieren [8, 12]. Neue Therapieansätze werden daher dringend benötigt, um gerade den völlig Chemotherapie-resistenten Tumoranteil, die TSZ, behandeln zu können.
Abb. 1: Pankreaskarzinom
Quo vadis Sulforaphan?
Die Pflanzenfamilie Brassicaceae (Cruciferae) und die daraus isolierten Senfölglykoside wurden seit der Antike als natürliche Antibiotika und Hauptkomponenten der antiviralen und antimykotischen Therapie in der Heilkunde eingesetzt [13, 14, 15]. Zudem haben Glucoraphanine (4-Methylsulfinyl Butylglucosinolate) und deren Isothiocyanat-Produkt Sulforaphan eine besonders starke antikanzerogene Wirkung. Sulforaphan wurde zum ersten Mal Jahr 1959 aus Pfeilkresse isoliert [16]. Schließlich wurden weitere sulforaphanreiche Nahrungsmittel wie Brokkoli, Blumenkohl, Rettich, und Kraut identifiziert. Schnell wurde klar, dass Brokkoli und dessen Sprossen die höchste Konzentration von Sulforaphan besitzen [17, 18, 19]. Im Unterschied zu anderen Antioxidantien eliminiert Sulforaphan die freien Radikale indirekt durch eine Steigerung der Aktivität von Phase-II Enzymen, wodurch es zur Erhöhung des Glutahion-Spiegels kommt [20]. Sulforaphan weist außerdem eine langdauernde Wirkung auf. Einen Zusammenhang mit Tumoren konnte im Jahr 1992 aufgezeigt werden, da in Hepatom-Mausmodellen eine Erhöhung der Aktivität von Phase-II Enzymen sowohl in vitro als auch in vivo gefunden wurde, was mit verzögertem Tumorwachstum einherging [20].
Seither wurde der antikanzerogene Effekt von Sulforaphan bei unterschiedlichen Krebsentitäten experimentell und klinisch bestätigt [7, 13, 21, 22]. Außerdem wurde aufgezeigt, dass Sulforaphan gegen die TSZ therapeutisch eingesetzt werden könnte [13, 23, 24]. Es wurde eindeutig gezeigt, dass Sulforaphan die Hemmung der Expression anti-apoptotischer NF-κB Zielgene vermittelt [7, 13]. Mittlerweile ist bekannt, dass NF-κB, ein übergeordneter molekularer Schalter und Mediator von Entzündungen, beim Pankreaskarzinom vermehrt aktiv ist, aber durch Sulforaphan normalisiert wird [7, 13].
Sulforaphan erhöht daher in der präklinischen Pankreaskarzinom-Forschung das Ansprechen einer Chemotherapie mit Sorafenib, 5-Fluorouracil, Doxorubicin, Cisplatin und Gemcitabin auf TSZ ohne Nachweis einer unerwünschten Wirkung auf nichtmaligne Zellen [7, 13, 23, 25, 26].
POUDER Trial
Seit Dezember 2013 läuft an der Klinik für Allgemein-, Viszeral- und Transplantationschirurgie mit dem Europäischen Pankreaszentrum in Heidelberg eine zweiarmige prospektive Pilotstudie (POUDER Trial) zur Nahrungsergänzung während der palliativen Chemotherapie von Patienten mit einem Pankreaskarzinom. Ziel dieser Untersuchung ist es, in der Pilotphase die Machbarkeit der Verabreichung von hochkonzentriertem Sulforaphan in Kapselform zu testen. Patienten mit einem fortgeschrittenen, inoperablen Pankreaskarzinom bekommen begleitend zur palliativen Chemotherapie täglich 90 mg Sulforaphan in Form von gefriergetrocknetem Brokkoli-Keimlingsschrot (400 mg), das in Kapseln verpackt ist (Abb. 2). Als Placebo dienen Kapseln mit Methylcellulose. Vierzig Patienten mit einem nicht resektablen Pankreaskarzinom, die in Heidelberg in Behandlung sind, sollen während der Pilotphase in die Studie eingeschlossen werden.

Abb. 2: Brokkoli-Granulat und Granulat in Kapseln
Sowohl die Tumormarker CEA und CA19-9 als auch die Lebensqualität sollen ausgewertet werden. Eine Bildgebung (CT, MRT), die routinemäßig in dreimonatigem Abstand durchgeführt wird, dient zur Verlaufsbeurteilung der Tumorlast, um damit einen eventuellen Progress bzw. das gewünschte Ergebnis, eine Tumorverkleinerung, zu erfassen. Zum Monitoring der adäquaten Aufnahme und Verstoffwechselung von Sulforaphan werden außerdem im Morgenurin der Patienten Abbauprodukte von Sulforaphan bestimmt. Die Analyse findet durch Zylokondensation mit 1,2-Benzenedithiol statt wie beschrieben [27]. Die Lebensqualität wird mittels standardisiertem EORTC-, QLQ-PAN26-, und QLQ-C30-Fragebogen in dreimonatigen Abständen evaluiert.
Mögliche Nebenwirkungen von Brokkoli und seinen Sprossen
Typische Nebenwirkungen von Kohlgemüse, zu denen auch Brokkoli und seine Sprossen zählen, sind Flatulenz und Schwefelgeruch. Letzterer entsteht bei der Verdauung und basiert auf dem Schwefelgehalt des Sulforaphan und seines Vorläuferstoffs, dem Glucoraphan. Daneben wirkt Sulforaphan als indirektes Antioxidanz und könnte daher theoretisch die Wirkung einer Radio- oder Chemotherapie schwächen – ähnlich wie es kritisch für Vitamine diskutiert wird. An unserer Klinik wurde diese Hypothese an Mäusen getestet, die mit humanen Pankreaskarzinomxenografts transplantiert waren. Sulforaphan alleine oder in Kombination mit Gemcitabin inhibierte zwar stark das Wachstum der Tumore [26], die Wirkung von Gemcitabin wurde aber nicht abgeschwächt, sondern vielmehr verstärkt. Nun wird die Bestätigung dieser vielversprechenden experimentellen Daten durch die hier vorgestellte Patientenstudie erwartet. Erwähnenswert ist auch, dass frische Sprossen durch die warme und feuchte Keimung anfällig für die Kontamination durch gefährliche Darmbakterien sind. Kontaminierte Brokkolisprossen sollen zum Beispiel 2011 die schweren EHEC-Erkrankungen in Deutschland ausgelöst haben. Eine Bakterienkontamination der in der Studie verwendeten Brokkolisprossen ist jedoch nicht zu erwarten, da jede Charge durch ein unabhängiges mikrobiologisches Labor auf Unbedenklichkeit getestet wird. Wichtig zu wissen ist auch, dass Brokkoli neben den heilsamen Stoffen Glucoraphan und Sulforaphan auch die kropferzeugenden Glukosinolate Glukobrassicin und Progoitrin enthält. Jedoch konnte beim Menschen noch keine Veränderung der Schilddrüsenfunktion nach dem Verzehr einer haushaltsüblichen Menge an Brokkoli und sonstigem Kreuzblütergemüse beobachtet werden [28]. Insbesondere die Brokkolisprossen enthalten nur sehr geringe Mengen an Glukobrassicin, da dieses vermehrt nur im reifen Gemüse vorkommt [19]. Außer den üblichen Nebenwirkungen von Kohlgemüse – Flatulenz und Schwefelgeruch – gehen wir daher von keinen weiteren Beeinträchtigungen durch die tägliche Sprossenzufuhr aus.
Schlusswort
Sollte sich die untersuchte Nahrungsergänzung mit Brokkolisprossen als praktikabel erweisen, ist eine randomisiert kontrollierte Folge-Studie geplant, um statistisch verwertbare Aussagen zu einem potenziellen positiven Therapieeffekt zu erhalten.
Literatur
[1] Hariharan D, Saied A, Kocher HM: Analysis of mortality rates for pancreatic cancer across the world, HPB (Oxford) 2008; 10(1):58-62
[2] Witkowski ER, Smith JK, Tseng JF: Outcomes following resection of pancreatic cancer, JSurgOncol. 2013; 107(1):97-103
[3] Schmidt J, Abel U, Debus J, Harig S, Hoffmann K, Herrmann T, Bartsch D, Klein J, Mansmann U, Jäger D, Capussotti L, Kunz R, Büchler MW: Open-label, multicenter, randomized phase III trial of adjuvant chemoradiation plus interferon Alfa-2b versus fluorouracil and folinic acid for patients with resected pancreatic adenocarcinoma, JClinOncol. 2012; 30(33):4077-4083
[4] Tuveson DA, Neoptolemos JP: Understanding metastasis in pancreatic cancer: a call for new clinical approaches, Cell. 2012; 148(1-2):21-23
[5] Li D, Xie K, Wolff R, Abbruzzese JL: Pancreaticcancer, Lancet. 2004;363(9414):1049-1057
[6] Rasheed ZA, Kowalski J, Smith BD, Matsui W: Concise review: Emerging concepts in clinical targeting of cancer stem cells, Stem Cells. 2011; 29:883-887
[7] Kallifatidis G, Rausch V, Baumann B, Apel A, Beckermann BM, Groth A, Mattern J, Li Z, Kolb A, Moldenhauer G, Altevogt P, Wirth T, Werner J, Schemmer P, Büchler MW, Salnikov AV, Herr I: Sulforaphane targets pancreatic tumour-initiating cells by NF-kappa B induced antiapoptotic signalling, Gut. 2009; 58:949-963
[8] Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, Caceres-Cortes J, Minden M, Paterson B, Caligiuri MA, Dick JE: A cell initiating human acute myeloid leukaemia after transplantation into SCID mice, Nature. 1994; 367(6464):645-648
[9] Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF: Prospective identification of tumorigenic breast cancer cells, Proceedings of the National Academy of Sciences of the United States of America. 2003; 100:3983-3988
[10] Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, Henkelman RM, Cusimano MD, Dirks PB: Identification of human brain tumour initiating cells, Nature. 2004; 432(7015):396-401
[11] Simeone DM: Pancreatic cancer stem cells: implications for the treatment of pancreatic cancer, Clinical cancer research: an official journal of the American Association for Cancer Research. 2008; 14:5646-5648
[12] Reya T, Morrison SJ, Clarke MF, WeissmanIL: Stem cells, cancer, and cancer stem cells, Nature. 2001; 414(6859):105-111
[13] Herr I, Lozanovski V, Houben P, Schemmer P, Büchler MW: Sulforaphane and related mustard oils in focus of cancer prevention and therapy, Wien Med Wochenschr. 2013; 163(3-4):80-88
[14] Prochazka Z, Komersova I. Isolation of sulforaphane from Cardariadraba and its antimicrobial effect, Cesk Farm. 1959; 8:373–376
[15] Dornberger K, Böckel V, Heyer J, Schönfeld CH, Tonew M, Tonew E, Untersuchungenüber die IsothiocyanateErysolin und SulforaphanausCardariadraba L. Pharmazie. 1975; 30:792–796
[16] Prochazka Z, Isolation of sulforaphane from hoary cress, Collet Czech ChemCommun. 1959; 24:2429–2430
[17] Fahey JW, Talalay P. Antioxidant functions of sulforaphane: a potent inducer of Phase II detoxication enzymes. Food ChemToxicol. 1999; 37:973–979
[18] Zhang Y, Talalay P, Cho CG, Posner GH, A major inducer of anti- carcinogenic protective enzymes from broccoli: isolation and elucidation of structure, ProcNatlAcadSci U S A. 1992; 89:2399–2403
[19] Fahey JW, Zhang Y, Talalay P. Broccoli sprouts: an exceptionally rich source of inducers of enzymes that protect against chemical carcinogens, ProcNatlAcadSci U S A. 1997; 94:10367–10372
[20] Zhang Y., Kensler T. W., Cho C-G., Posner G. H, Talalay P, Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornylisothiocyanates, Proceedings of the National Academy of Sciences of the U.S.A. 1994; 91, 3147±3150
[21] Forman D, Burley V, Cade J, Greenwood D, Moreton J, Chan D, Tu Y-K, Gordon I, Thomas J, McColl K: The associations between food, nutrition and physical activity and the risk of pancreatic cancer and underlying mechanisms. In: World Cancer Research Fund. Food, nutrition, physical activity, and the prevention of cancer: a global perspective. Washington, DC: AICR; 2007
[22] Li Y, Wicha MS, Schwartz SJ, Sun D: Implications of cancer stem cell theory for cancer chemoprevention by natural dietary compounds, J NutrBiochem, 2011; 22:799-806
[23] Guzman ML, Rossi RM, Karnischky L, et al. The sesquiterpene lactone parthenolide induces apoptosis of human acute myelogenousleukemia stem and progenitor cells, Blood 2005; 105:4163–4169
[24] Myzak MC, Dashwood RH, Chemoprotection by sulforaphane: keep one eye beyond Keap1. Cancer Lett. 2006; 233:208–218
[25] Rausch V, Liu L, Kallifatidis G, Baumann B, Mattern J, Gladkich J, Wirth T, Schemmer P, Büchler MW, Zöller M, Salnikov AV, Herr I: Synergistic activity of sorafenib and sulforaphane abolishes pancreatic cancer stem cell characteristics, Cancer Res. 2010; 70:5004-5013
[26] Kallifatidis G, Labsch S, Rausch V, Mattern J, Gladkich J, Moldenhauer G, Büchler MW, Salnikov AV, Herr I: Sulforaphane increases drug-mediated cytotoxicity towards cancer stem-like cells of pancreas and prostate, MolTher. 2011; 19:188-195
[27] Shapiro TA, Fahey JW, Dinkova-Kostova AT, Holtzclaw WD, Stephenson KK, Wade KL, Ye L, Talalay P: Safety, tolerance, and metabolism of broccoli sprout glucosinolates and isothiocyanates: a clinical phase I study, Nutr Cancer. 2006; 55(1):53-62
[28] Verhoeven DT, Verhagen H, Goldbohm RA, van den Brandt PA and van Poppel G, A review of mechanisms underlying anticarcinogenicity by brassica vegetables. ChemBiol Interact 1997; 103:79-129








