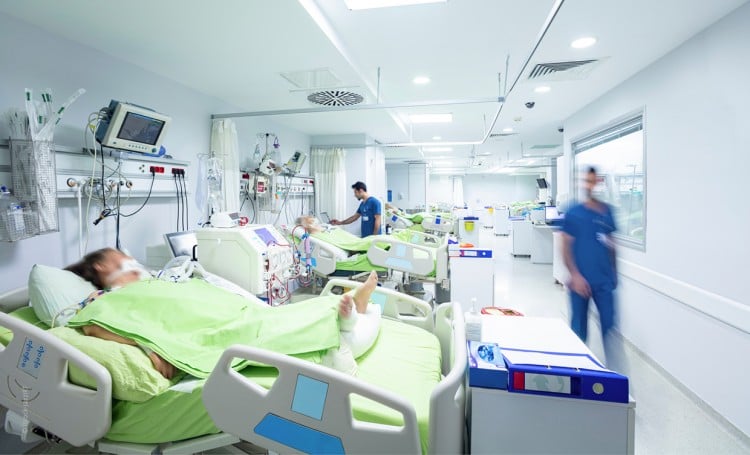
Durch eine zielgerichtete evidenzbasierte Therapie, die einem hohen Standard genügt, kann die Prognose des Intensivpatienten maßgeblich verbessert werden.
Die operative Intensivmedizin ist ein wichtiger Querschnittsbereich, in dem Anästhesiologen und Chirurgen gemeinsam kritisch kranke Patienten behandeln. Dabei müssen nicht nur die unmittelbaren Folgen von Operation oder Trauma therapiert werden, sondern auch die Begleiterkrankungen und eine Vielzahl weiterer intensivmedizinischer Krankheitsbilder, wie Sepsis, Pneumonie, ARDS, kardiale Insuffizienz oder Delir. Die Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) und die Deutsche Gesellschaft für Chirurgie (DGCH) bieten durch fünf Positiv- und fünf Negativempfehlungen eine Hilfestellung zur Gewährleistung eines hohen evidenzbasierten Versorgungsstandards in der operativen Intensivmedizin.
Nur durch die Gewährleistung einer hohen Versorgungsqualität 24/7 kann die Prognose unserer Patienten verbessert werden. Dafür sind Strukturstandards, wie Visitenstruktur, Händehygiene und Physiotherapie, aber auch Versorgungsstandards, wie die Fokussanierung bei Sepsis, hämodynamische Stabilisierung oder die lungenprotektive invasive Beatmung notwendig. Gleichzeitig sollten unnötige Maßnahmen, z. B. im Rahmen der Diagnostik oder der antiinfektiven Therapie, vermieden oder auf die Anwendung potentiell schädlicher Therapien, wie physiologische Kochsalzlösung oder forcierter Diurese beim Nierenversagen, verzichtet werden. Die Positiv- und Negativempfehlungen basieren auf nationalen und internationalen Leitlinien sowie der aktuellen Literatur.
Positivempfehlungen
1. In einer täglichen interdisziplinären und multiprofessionellen Visite definierte Tagesziele festlegen:
In der operativen Intensivmedizin ist die tägliche interdisziplinäre und multiprofessionelle Visite ein wichtiges Qualitätskriterium. Nur durch die tägliche Besprechung der relevanten intensivmedizinischen und chirurgischen Befunde, aber auch pflegerischer, physiotherapeutischer und sozialer Aspekte, können tägliche Therapieziele festgelegt werden und eine individualisierte, umfassende und zielorientierte Behandlung erfolgen.
Den Nutzen einer täglichen multiprofessionellen Visite mit Definition und Kommunikation von spezifischen Zielen zeigten Pronovost et al. bereits 2003, als sie dadurch die Intensivliegedauer reduzieren konnten [1]. Durch eine fokussierte Visite mindestens zwischen den behandelnden Ärzten und den betreuenden Pflegekräften kann die Kommunikation verbessert werden, die Therapieziele besser abgestimmt werden, um so Komplikationen zu vermeiden, und Behandlungskonzepte effektiver und schneller umgesetzt werden. Zusätzlich kann durch die Standardisierung der Visite bezüglich personeller Zusammensetzung, Ort und Uhrzeit, Struktur oder Minimierung von Unterbrechungen, die Effektivität gesteigert und das Patienten-Outcome verbessert werden [2]. Dies konnte auch für Teilaspekte, wie ZVK-assoziierte Blutstrominfektionen [3] oder die Beatmungsentwöhnung gezeigt werden [4]. Durch die Teilnahme von weiteren Spezialisten, wie Pharmakologen oder Infektiologen, kann die Effektivität noch weiter gesteigert werden.
Aufgrund dieser Daten wurde die tägliche multiprofessionelle Visite mit definierten Tageszielen als Qualitätsindikator 1 der Qualitätsindikatoren für die Intensivmedizin von der Deutschen Interdisziplinären Vereinigung für Intensivmedizin (DIVI) festgelegt [5] und sollte auf jeder Intensivstation umgesetzt werden, um die Versorgungsqualität und das Outcome zu verbessern.
2. Bei schweren Infektionen und Sepsis frühzeitig den Fokus identifizieren und innerhalb von 6 Stunden die Fokussanierung durchführen:
Die frühe Fokussanierung bei der Sepsis stellt neben der frühen antiinfektiven Therapie, der mikrobiologischen Diagnostik und der initialen Kreislaufstabilisierung eine zentrale Maßnahme zur Verbesserung des Outcomes dar [6, 7]. Daher fordert die aktuelle Sepsisleitlinie der Surviving Sepsis Campaign ausdrücklich die frühzeitige Identifizierung und Sanierung des Infektionsherdes innerhalb von 6 bis 12 Stunden ab Diagnose [7]. Bei einer postoperativen chirurgisch therapierbaren Komplikation, z. B. einer Wundinfektion, Insuffizienz, Ileus oder Fistel, ist in Abhängigkeit vom Zustand des Patienten eine rasche chirurgische oder interventionelle Revision notwendig (z. B. operative Versorgung/Revision oder CT- oder Ultraschall-gesteuerte Entlastung ggf. mit (Spül-)Drainagen). Falls die definitive chirurgische Versorgung nicht möglich ist, sollen mehrzeitige Konzepte, wie temporäre Wundverschlüsse mit geplanten Revisionsoperationen, Vakuumtherapie mit zweizeitigem Wundverschluss oder die Anlage von Deviationsstomata zur Anwendung kommen.
Patienten mit einem septischen Schock bei gastrointestinaler Perforation zeigen bei chirurgischer Versorgung nach mehr als 6 Stunden ein schlechteres Outcome [8, 9]. Daher gehört zur effektiven leitliniengerechten Sepsistherapie, wie auch zur zielgerechten Therapie von schweren Infektionen, die frühzeitige Fokussanierung innerhalb von 6 Stunden, um die Überlebensrate des Patienten zu verbessern [7, 10].
3. Passive Leg Raising (PLR) als neuer evidenzbasierter Standard zur Indikation und Steuerung der Volumentherapie:
Beim operativen Intensivpatienten kommt es aufgrund perioperativer Flüssigkeits- und Blutverluste, aber auch durch intravasale Volumenverschiebungen, z. B. bei Sepsis und Infektionen, häufig zum intravasalen Volumenmangel. Entsprechend der S3-Leitlinie „Intravasale Volumentherapie beim Erwachsenen“ muss nach der klinischen Diagnose des Volumenmangels aufgrund körperlicher Untersuchung und ergänzenden Laborparametern, wie Lactat, Base Excess, ScvO2 und Hämatokrit sowohl der Volumenmangel als auch die Volumenreagibilität wiederholt mit geeigneten Maßnahmen überprüft werden [11].
Ein Lagerungsmanöver zur Autotransfusion und Überprüfung der nachfolgenden hämodynamischen Effekte (PLR – Passive Leg Raising) ist dabei allen anderen Methoden überlegen, da es sowohl beim spontanatmenden und beatmeten als auch beim Patienten mit Herzrhythmusstörungen Anwendung finden kann [12]. Als Zielgrößen sollten idealerweise dynamische Vorlastparameter, das Schlagvolumen oder initial auch die Veränderung des arteriellen Blutdruckes unter PLR von > 10 Prozent genutzt werden. Der zentrale Venendruck (ZVD) korreliert nicht mit der Volumenreagibilität und sollte daher für diese Indikation nicht genutzt werden [13].
PLR stellt das Standardverfahren zur Diagnose der Volumenreagibilität und Steuerung der Volumentherapie dar und sollte bei allen Patienten mit klinischem Volumenmangel ohne Kontraindikation für dieses Lagerungsmanöver Anwendung finden.
4. Bei Intensivpatienten soll eine lungenprotektive Beatmung erfolgen, die beim ARDS um eine Lagerungstherapie und ggf. extrakorporale Lungenunterstützung ergänzt werden soll:
Grundpfeiler der Beatmungstherapie insbesondere in der operativen Intensivmedizin ist die lungenprotektive Beatmung mit einem kleinen Tidalvolumen von 4 – 8 ml/kg idealem Körpergewicht, der Begrenzung des Plateaudrucks auf 30 mbar und einem ausreichend hohem PEEP (Positive EndExpiratory Pressure). Für die intraoperative Beatmung wird aufgrund einer Reduktion der postoperativen invasiven und nicht-invasiven Beatmung und auch der Pneumonierate inzwischen die Beatmung mit kleinen Tidalvolumen empfohlen [14] und sollte entsprechend auch bei der postoperativen Beatmung fortgeführt werden. Ebenso zeigten auch Intensivpatienten ohne akutes Lungenversagen (ARDS) unter Beatmung mit kleinen Tidalvolumina weniger pulmonale Komplikationen [15]. In der operativen Intensivmedizin ist die lungenprotektive Beatmung mit kleinen Tidalvolumina der Standard bei jeder kontrollierten invasiven Beatmung.
Auch die evidenzbasierte Therapie des akuten Lungenversagens umfasst die lungenprotektive Beatmung mit einem kleinen Tidalvolumen von 4 – 8 ml/kg idealem Körpergewicht, der Begrenzung des Plateaudrucks auf 30 mbar und einem ausreichend hohem PEEP, der bei moderatem oder schwerem ARDS eher höher gewählt werden sollte [16]. Dabei muss beachtet werden, dass entsprechend der Berlin Definition des ARDS bereits bei einem PaO2/FiO2 ≤ 300 mmHg mit einem PEEP ≥ 5 mbar von einem milden ARDS gesprochen wird und somit eine lungenprotektive Beatmung indiziert ist [17].
Zusätzlich sollte beim moderaten und schweren ARDS mit einem PaO2/FiO2 < 150 mmHg eine wiederholte Bauchlagerung von mindestens 16 h Dauer durchgeführt werden, da durch diese Maßnahme die Letalität signifikant gesenkt werden konnte. Die intermittierende Bauchlagerung sollte erst bei anhaltender Verbesserung der Oxygenierung in Rückenlage oder fehlender Verbesserung nach mehreren Versuchen beendet werden. Dabei ist der Effekt auf die Oxygenierung bei kompletter Bauchlagerung stärker als bei inkompletter Bauchlagerung (135°-Lagerung) [18].
Kommt es beim schweren ARDS trotz optimierter protektiver Beatmungstherapie, Lagerungstherapie und ggf. weiterer Maßnahmen, wie der Gabe von inhalativen Vasodilatatoren oder Rekrutierungsmanövern, zu einer anhaltenden Hypoxämie, sollte die Indikation zur extrakorporalen Membranoxygenierung durch ein ECMO-Zentrum (ECMO = extrakorporale Membranoxygenierung) überprüft werden (19). Dabei werden zurzeit ein PaO2/FiO2 < 80 mmHg oder ggf. sogar <60 mmHg oder ein pH < 7,2 unter optimierter ARDS-Therapie als Indikationen für eine ECMO angesehen.
5. Etablierung des Konzepts der Frühmobilisation in der Intensivmedizin:
Durch Frühmobilisation innerhalb von 72 Stunden kann die Beatmungs- und Liegedauer von Intensivpatienten gesenkt und das funktionelle Langzeit-Outcome verbessert werden [18].
Dabei zeigte sich ein definierter Behandlungsalgorithmus mit Nutzung sowohl pflegerischer als auch physiotherapeutischer Ressourcen im Outcome überlegen [20]. Die Intensität der Frühmobilisation muss der Erkrankungsschwere sowie der hämodynamischen und pulmonalen Stabilität angepasst werden. Ebenso sind Kontraindikationen, wie ein kritisch erhöhter Hirndruck, zu beachten.
Zur erfolgreichen Frühmobilisation sind neben einem differenzierten Behandlungskonzept auch ausreichende physiotherapeutische Personalkapazitäten erforderlich, wie es zum Beispiel die DGAI in ihrem modularen Zertifikat Intensivmedizin fordert [21] oder es in der S2e-Leitlinie: „Lagerungstherapie und Frühmobilisation zur Prophylaxe oder Therapie von pulmonalen Funktionsstörungen“ empfohlen wird [18].
Negativempfehlungen
1. Eine perioperative Antibiotikaprophylaxe soll nicht postoperativ fortgeführt werden:
Die perioperative Antibiotikaprophylaxe stellt eine gesicherte effektive Maßnahme zur Reduktion von Wundinfektionen dar. Dabei soll die dem zu erwartenden Keimspektrum angepasste Antibiotikagabe idealerweise vor dem Hautschnitt erfolgen und nur bei mehr als 2 Stunden Operationsdauer bzw. bei einer Operationsdauer von mehr als zwei Halbwertszeiten des Antibiotikums ist die wiederholte intraoperative Gabe indiziert [22, 23].
Eine postoperative Fortführung oder Nachholung der Prophylaxe bei versäumter intraoperativer Gabe kann die Rate an Wundinfektionen nicht reduzieren, hat aber das Risiko sämtlicher antibiotikaassoziierter Nebenwirkungen. Der Patient wird nicht nur durch potentielle Medikamentennebenwirkungen inkl. allergischer Reaktionen gefährdet, sondern hat auch ein erhöhtes Risiko für das Auftreten einer Clostridien-Infektion oder die Selektion multiresistenter Erreger, was nicht nur ein Risiko für den einzelnen Patienten, sondern darüberhinausgehend für die gesamte Umgebung des Patienten darstellt [24].
2. Keine Verwendung von isotoner Kochsalzlösung zum intravenösen Flüssigkeitsersatz:
Isotone Kochsalzlösung (0,9 Prozent NaCl) ist weltweit das am häufigsten verwendete Kristalloid und wird insbesondere bei niereninsuffizienten Patienten klinisch nach wie vor eingesetzt, obwohl der Einsatz von 0,9 Prozent NaCl mit einer gehäuften Inzidenz einer hyperchlorämischen metabolischen Azidose und Nierendysfunktion assoziiert ist [25-27]. In der aktuellen S3-Leitlinie „Intravasale Volumentherapie beim Erwachsenen“ wird mit dem höchsten Empfehlungsgrad von der Anwendung von isotoner Kochsalzlösung bei peri-interventionellen und Intensiv-Patienten klar abgeraten. Demgegenüber wird der Einsatz von balancierten isotonen Vollelektrolytlösungen empfohlen, dabei sollte Azetat oder Malat gepufferten Lösungen dem Laktat aufgrund der fehlenden Interaktion mit der Lactatmessung der Vorzug gegeben werden [11].
3. Vermeidung von Routine-Labordiagnostik, und -Röntgendiagnostik ohne konkrete klinische Fragestellung und keine Behandlung von Laborbefunden (z. B. Gerinnung) ohne entsprechende klinische Befunde:
Durch die Routineblutentnahme bei Intensivpatienten kommt es zu einem relevanten Blutverlust, der bei Langliegern mit einem zusätzlichen Transfusionsbedarf korreliert [28]. Durch eine individualisierte Indikations-induzierte Blutentnahme mit reduziertem Blutvolumen kann dieser Blutverlust ohne erhöhte Rate an Komplikationen oder schlechteres Outcome reduziert werden [29]. Gleiches gilt auch für den Verzicht auf einen routinemäßigen täglichen Röntgen Thorax und dessen Durchführung nur bei spezifischen Fragestellungen auf der Intensivstation [30].
Die prophylaktische Gabe von Gerinnungsprodukten beim nichtblutenden Patienten zeigt keinen Vorteil bei kritisch kranken operativen Intensivpatienten [31], sondern ist mit negativen Effekten assoziiert (z. B: verlängerte Krankenhausverweildauer) [32]. Auch die Transfusion von Erythrozytenkonzentraten beim nichtblutenden Patienten sollte in der Regel erst ab einem Hb von unter 7 g/dl [33] oder aufgrund individueller physiologischer Transfusionstrigger erfolgen [34].
|
Klug entscheiden „Klug entscheiden“ ist eine Initiative der Deutschen Gesellschaft für Innere Medizin (DGIM), die sich gegen Über- und Unterversorgung wendet. Ihr Ziel ist es, eine konkrete Hilfe bei der Indikationsstellung zu diagnostischen und therapeutischen Maßnahmen zu geben. 12 Fachgesellschaften haben an der Initiative unter dem Dach der DGIM teilgenommen und praktische Empfehlungen erstellt, die das Deutsche Ärzteblatt als Serie veröffentlicht hat. Alle bisher erschienenen Beiträge sowie ein Übersichtsartikel über die DGIM-Initiative sind unter www.aerzteblatt.de/klugentscheiden abrufbar. Für die Operative Intensivmedizin möchten die Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin(DGAI) und die Deutsche Gesellschaft für Chirurgie (DGCH) diesem Beispiel folgen. |
4. Beim akuten Nierenversagen soll keine forcierte Diurese erfolgen, da sie den Krankheitsverlauf nicht positiv beeinflussen kann:
Im Rahmen einer intensivmedizinischen Behandlung tritt häufig ein akutes Nierenversagen auf [35]. Während die Sicherstellung der Euvolämie und die Aufrechterhaltung eines ausreichenden renalen Perfusionsdrucks den Verlauf durchaus positiv beeinflussen kann, verbessert die Gabe von Diuretika ggf. mit gleichzeitig erhöhter Flüssigkeitseinfuhr im Sinne einer forcierten Diurese weder die Prognose, noch wird die Häufigkeit an Nierenersatzverfahren reduziert [36]. Einzig bei Flüssigkeitsüberladung können Diuretika bei erhaltener Diurese zur Bilanzierung erwogen werden, um damit assoziierte postoperative Komplikationen (z. B. Wundheilungsstörungen, reduzierte Darmmotilität) zu reduzieren. Insgesamt müssen Diuretika beim akuten Nierenversagen aber restriktiv gegeben werden [37].
5. Unzureichende Compliance bei der Händehygiene:
Die korrekte Anwendung der Händedesinfektion stellt die wichtigste Maßnahme zur Vermeidung von nosokomialen Infektionen nicht nur auf der Intensivstation, sondern im gesamten Krankenhaus dar [38]. Aktuell geht man für die operative Intensivmedizin von ca. 180 bis 190 indizierten Anwendungen zur Händedesinfektion pro Patient und Tag aus [39].
Durch die korrekte Anwendung der fünf Indikationen zur Händehygiene (siehe Tabelle 1) können nosokomiale Infektionen, insbesondere nosokomiale Pneumonien und Katheter-assoziierte Infektionen, reduziert werden. In der INSEP Studie wurde bei 12.000 Patienten gezeigt, dass die Sepsis-auslösende Infektion bei mehr als 50 Prozent nosokomialen Ursprungs ist [40]. Dieses Ergebnis unterstreicht die Bedeutung der Händehygiene, deren Compliance auf der Intensivstation direkt ermittelt und gleichzeitig durch die Erfassung des Händedesinfektionsmittelverbrauchs im Rahmen der Qualitätssicherung erfasst werden sollte [5]. Geeignete Schulungsmaßnahmen können die Compliance der Händehygiene gezielt steigern.
|
1. VOR Patientenkontakt |
|
2. VOR aseptischen Tätigkeiten |
|
3. NACH Kontakt mit potenziell infektiösem Material |
|
4. NACH Patientenkontakt |
|
5. NACH Kontakt mit der direkten Patientenumgebung |
Diskussion
Die operative Intensivmedizin zeichnet sich nicht nur durch hochkomplexe Therapiekonzepte unter Anwendung aller verfügbaren modernen pharmakologischen und medizintechnischen Möglichkeiten aus, sondern gerade auch durch die Anwendung einfacher Standards, die aber mit einer hohen Qualität und Zuverlässigkeit umgesetzt werden. So handelt es sich bei dem Passive Leg Raising um eine einfache und altbewährte Methode, um die Volumenreagibilität zu beurteilen und die Volumentherapie zu steuern, die auch ohne erweitertes hämodynamisches Monitoring zuverlässig einsetzbar ist. Mit den hier dargestellten Empfehlungen kann man insgesamt die Prognose operativer Intensivpatienten maßgeblich verbessern. Die Prognose des einzelnen Patienten kann dann durch zusätzliche individualisierte Diagnostik und Therapie weiter verbessert werden. Der Verzicht auf Therapien aufgrund fehlender Evidenz oder sogar potentiellem Schaden für den Patienten, wie z. B. der Verzicht auf isotone Kochsalzlösung, kann nicht nur die Prognose verbessern, sondern auch Ressourcen freisetzen, die in andere indizierte Maßnahmen investiert werden können.
Die operative Intensivmedizin ist durch die Kombination von Operation/Trauma, Begleiterkrankungen und akuten intensivmedizinischen Krankheitsbildern ein hochkomplexer, zeitkritischer Therapiebereich, der nur durch die interdisziplinäre und multiprofessionelle Zusammenarbeit von Ärzten, Pflegekräften, Physiotherapeuten und weiteren Professionen erfolgreich sein kann. Dafür benötigen wir zuverlässige Kommunikationsstrukturen, aber auch differenzierte standardisierte Therapiekonzepte, die jederzeit und schnell funktionieren.
Kopp R, Wildenauer R, Marx G: Umsichtig und vernünftig handeln auf der operativen Intensivstation. Passion Chirurgie. 2020 Oktober, 10(10): Artikel 04_02.
PD Dr. Kopp und Dr. Wildenauer trugen gleichermaßen zu dieser Arbeit bei.