Deutschland wurden im Jahre 2006 etwa 300 000 perkutane Koronarinterventionen (PCI) durchgeführt. Bei ca. 85 Prozent der PCI wurden Koronarstents implantiert. Das bedeutet jährlich ca. 250.000 neue Stentpatienten, die unter dualer Plättchenhemmung mit Acetylsalicylsäure (ASS) und einem Thienopyridin (meist Clopidogrel) stehen [1]. Bei etwa 5 Prozent der Patienten erfolgt im erstenJahr nach Stentimplantation eine nichtkardiale Operation. Somit werden ca. 12.500 Eingriffe pro Jahr an Patienten mit Koronarstents „jünger“ als 12 Monate durchgeführt [2]. Wegen der Gefahr der perioperativen Blutung wurden und werden in vielen Fällen die Thrombozytenaggregationshemmer vor der Operation abgesetzt. Dies setzt jedoch die Patienten einem erhöhten kardiovaskulären Risiko infolge einer Stentthrombose aus [3]. Die betreuenden Ärzte stehen somit vor der schwierigen Aufgabe, einerseits eine Operation möglichst ohne perioperative Blutungen und Blutverlust durchzuführen, was ein Absetzen der Antiplättchentherapie erfordert. Andererseits müssen sie den Patienten vor einem Herzinfarkt schützen, was am besten mit der Fortsetzung der Thrombozytenaggregationshemmung erreicht wird. Hieraus ergibt sich ein therapeutisches Dilemma, welches eines sehr differenzierten und häufig individualisierten Vorgehens bedarf. Ziel der vorliegenden Übersicht ist es, den derzeitigen Kenntnisstand zu Risikoabschätzung sowie dem perioperativen Management von Patienten mit Koronarstents unter Einbeziehung aktueller Empfehlungen der Fachgesellschaften zusammenzufassen [3,4].
|
ACC |
American College of Cardiology |
|
|
ACCP |
American College of Chest Physicians |
|
|
AHA |
American Heart Association |
|
|
ARC |
Academic Research Consortium |
|
|
ASS |
Acetylsalicylsäure |
|
|
BMS |
Bare-Metal Stent |
|
|
COX-1 |
Zyklooxygenase-1 |
|
|
DES |
Drug-Eluting Stent |
|
|
ESC |
European Society of Cardiology |
|
|
GpIIb/IIIa |
Glykoprotein IIb/IIIa |
|
|
HWZ |
Halbwertszeit |
|
|
LMWH |
niedermolekulares Heparin (low molecular weight heparin) |
|
|
PCI |
perkutane Koronarintervention |
|
|
POC |
Point-of-Care |
|
|
PTCA |
perkutane transluminale Koronarangioplastie |
Koronarstents
Nach einer perkutanen Koronarintervention (PCI) ist das Endothel im Koronargefäß vulnerabel, und thrombogen [5]. Dies hat eine Re-Okklusionrate von 6 bis 8 Prozent 24 Stunden nach perkutanen transluminalen Koronarangioplastie (PTCA) zur Folge [6]. Die hohe Komplikationsrate führte letztlich zur Entwicklung der Koronarstents [7].
1993 wurden unbeschichtete, sogenannte Bare-Metal Stents (BMS; Drahtgeflechthülsen aus Metall) eingeführt, wobei die Frühverschlussrate nach PCI zwar deutlich gesenkt wurde [8] aber es zu einer späteren Stenosierung des Stents kam. Dies führte zu einem Anstieg der kardialen Komplikationsrate etwa sechs Monate nach Implantation. Ursache hierfür sind eine Hyperplasie der Neointima sowie eine überschießende Proliferation von Fibroblasten und glatten Muskelzellen.
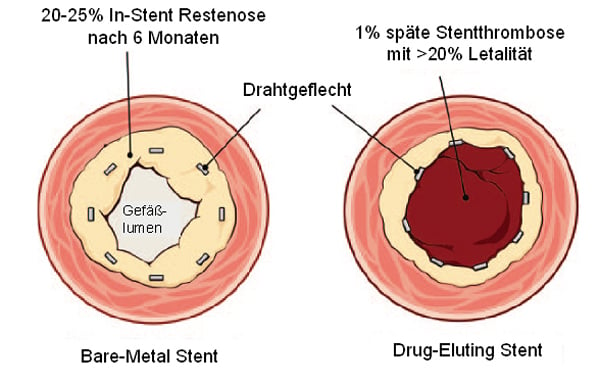
Daraufhin wurden beschichtete, sog. Drug-Eluting Stents (DES) entwickelt und 2002 bzw. 2004 zugelassen. DES sind mit einem antiproliferativen Wirkstoff beschichtet, der kontinuierlich abgegeben wird und damit die Entstehung einer neointimalen Hyperplasie effektiv unterdrückt. Trotz initialer Erfolge erlitt dieses Konzept 2007 einen Rückschlag. Die Inzidenz von späten Stentthrombosen und somit auch die kardiale Letalität und Myokardinfartkrate stieg bei Patienten mit DES nach Absetzen von Clopidogrel 6 Monate nach Implantation im Vergleich zu Patienten mit BMS an [9]. Offenbar kann sich durch die antiproliferative Stentbeschichtung über lange Zeit keine funktionelle Neointima ausbilden. Daher ist die endovaskuläre Oberfläche auch noch nach mehreren Monaten hoch thrombogen [10] (Abb. 1, 2). Dennoch sind die beschichteten Stents nach derzeitiger Datenlage und mit längerer dualer Thrombozytenaggregationshemmung über mindestens 12 Monate insgesamt effektiv und sicher [11-13].
Abb. 1: Verlauf der Endothelialisierung (in Prozent) von BMS und DES in Abhängigkeit vom Zeitpunkt der Stentimplantation. Modifiziert nach [70].
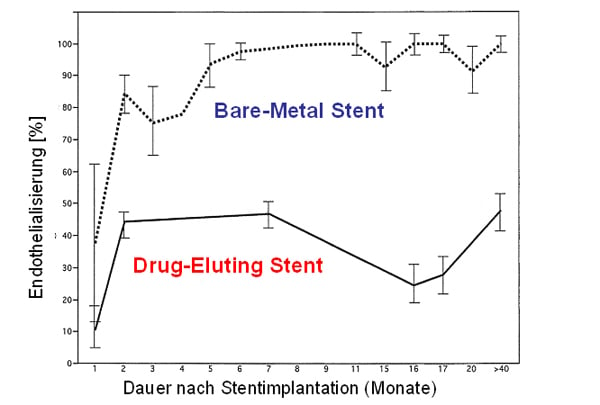
Abb. 2: Für den vaskulären Heilungsprozess und somit die Ausbildung einer antithrombogenen Oberfläche des Stents ist die Auskleidung durch Endothel entscheidend. DES hemmen durch die Zytostatika-Beschichtung nicht nur die unerwünschte Intimahyperplasie, sondern auch die im Grundsatz erwünschte Re-Endothelialisierung und begünstigen so die Entstehung von späten Stentthrombosen. Somit entstehen die typischen Komplikationen der beiden Stenttypen: In-Stent Restenose bei BMS und späte Stentthrombose bei DES. Modifiziert nach [7].
Eine effektive Hemmung der Thrombozytenfunktion ist nach der Implantation der Koronarstents unverzichtbar. Nach den aktuellen Empfehlungen müssen Patienten nach Implantation von koronaren Stents lebenslang mit ASS behandelt werden. Die zusätzliche Gabe von einem Thienopyridin (z. B. Clopidogrel oder Prasugrel) ist für mindestens vier Wochen (Patienten mit BMS) bzw. für mindestens 12 Monate (Patienten mit DES) erforderlich [14].
Thrombozytenaggregationshemmer
Die wichtigsten Thrombozytenaggregationshemmer sind:
– Zyklooxygenase-Hemmer: ASS
– ADP-Rezeptor Antagonisten
– Irreversible Thienopyridine: Clopidogrel, Prasugrel, Ticlopidin
– Reversible Cyclopentyltriazolopyrimidine: Ticagrelor
– GpIIb/IIIa-Rezeptor-Antagonisten: Tirofiban, Eptifibatid, Abciximab (Abb. 3).
Abb. 3: Thrombozytenaggregationshemmer greifen entweder einen spezifischen Aktivierungsweg der Thrombozyten an und verursachen damit eine partielle Aggregationshemmung oder führen zur kompletten Aggregationshemmung durch die Blockierung der gemeinsamen Endstrecke aller Aktivierungswege. Die aktivierten Thrombozyten setzen gerinnungsaktive Substanzen wie z. B. Adenosindiphosphat (ADP) und Thromboxan A2 frei. Diese binden wiederum an ihre Plättchenrezeptoren und führen zur weiteren Aktivierung der Thrombozyten. Die gemeinsame Endstrecke der Thrombozytenaktivierung ist die Aktivierung der Glykoprotein IIb/IIIa (GpIIb/IIIa) Rezeptoren. Über diese Rezeptoren vernetzen sich die aktivierten Thrombozyten mittels zirkulierenden Fibrinogens, was letztlich zur Plättchenaggregation und Bildung eines okkludierenden Thrombus an der Endothelläsion führt. Modifiziert nach [71].
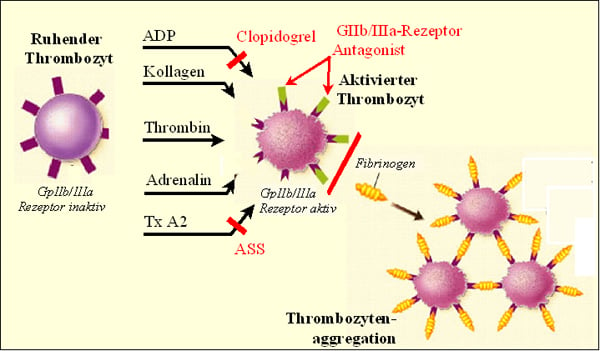
ASS
ASS hemmt irreversibel die Zyklooxygenase-1 (COX-1) und vermindert dadurch die Bildung der proaggregatorisch wirkenden Thromboxan-A2 in den Thrombozyten (Abb. 3). Die Wirkung setzt bereits nach 10 bis 20 Minuten ein und hält für die gesamte Lebensdauer der Thrombozyten an. Die Dosis für die Langzeittherapie beträgt 100 mg pro Tag.
ADP-Rezeptor-Antagonisten
Thienopyridine, wie Clopidogrel (Iscover®, Plavix®), Prasugrel (Efient®) und das nur noch selten eingesetzte Ticlopidin (Tyklid®) sind irreversible ADP-Antagonisten. Die Substanzen werden oral eingenommen und sind inaktive Prodrugs. Somit werden sie erst in der Leber über verschiedene Zytochrom-P450-Isoenzyme zu aktiven Formen konvertiert (15). Die Bioverfügbarkeit von Clopidogrel ist schlecht, weil nach der Absorption etwa 85 Prozent der Substanz schnell durch Esterasen in ein unwirksames Derivat umgewandelt wird. Nur der Rest erreicht die Leber und wird zum aktiven Metabolit. Nach der üblichen Dosis von 75 mg tritt die Wirkung von Clopidogrel erst nach drei bis fünf Tagen ein. Durch Gabe einer Aufsättigungsdosis von 300 bzw. 600 mg ist die Wirkung bereits nach sechs bzw. zwei Stunden klinisch relevant nachweisbar [16]. Prasugrel ist seit 2009 sowohl in Europa (EMEA) als auch in den USA (FDA) zugelassen [17]. Die Wirksamkeit von Prasugrel (60 mg Aufsättigungsdosis, dann 10 mg täglich p.o.) im Vergleich mit der Standardmedikation Clopidogrel (jeweils kombiniert mit ASS) war in der Zulassungsstudie besser [18]. Allerdings war auch die Rate an (auch lebensbedrohlichen) Blutungen – insbesondere bei Patienten über 75 Jahre – höher. Der entscheidende Unterschied verglichen mit Clopidogrel ist, dass die Biotransformation von Prasugrel in seinen aktiven Metaboliten vollständig erfolgt. Dadurch ist die Wirksamkeit von Prasugrel besser und der Wirkeintritt schneller [19]. Die Wirkdauer ist mit der von Clopidogrel vergleichbar.
Ticagrelor (Brilique®) ist die erste zugelassene Substanz der Klasse Cyclopentyltriazolopyrimidine. Grundlage für die Zulassung von Ticagrelor war die PLATO-Studie (PLATelet Inhibition and Patient Outcomes) mit insgesamt mehr als 18.600 Patienten [20]. Hier war Ticagrelor besser wirksam als Clopidogrel, ohne dass es zu einem Anstieg von schweren und tödlichen Blutungen kam.
Wie Clopidogrel und Prasugrel, blockiert auch Ticagrelor ADP-Rezeptoren, jedoch reversibel. Ticagrelor ist kein Prodrug und benötigt für seine Aktivierung keine Leberenzyme. Die HWZ der Substanz ist kurz, daher muss Ticagrelor zweimal täglich á 90 mg eingenommen werden. Die Wirkung tritt schnell ein, ist stärker als bei Clopidogrel und die biologische Wirksamkeit ist trotz der kurzen HWZ deutlich länger. Die Thrombozytenfunktion ist 36 Stunden nach Absetzen von Ticagrelor stärker eingeschränkt, als nach Absetzen von Clopidogrel. Es dauert vier bis fünf Tage, bis nur noch 25 Prozent der Thrombozytenfunktion gehemmt ist. Aufgrund der Reversibilität dürfte Ticagrelor auf den ersten Blick besser steuerbar sein. Jedoch ist im Falle einer Blutungskomplikation diese Eigenschaft problematisch. Bei akuter Blutung werden die Thrombozyten verbraucht und der freiwerdende Wirkstoff bindet sich an die verbleibenden und ggf. auch an die transfundierten Thrombozyten. Während der ersten 36 Stunden haben Thrombozytentransfusionen daher einen eingeschränkten Effekt. Wegen des langsamen Abklingens der biologischen Wirkung von Tricagleror ist für diese Substanz in der perioparativen Situation der gleiche Vorsicht nötig wie für die irreversiblen ADP-Rezeptor-Antagonisten.
GpIIb/IIIa-Rezeptor Antagonisten
Die GpIIb/IIIa-Rezeptor Antagonisten blockieren die Fibrinogen-Bindungsstellen der Thrombozyten. Sie hemmen die Thrombozytenaggregation zu über 80 Prozent und sind somit die stärksten Inhibitoren. Tirofiban (Aggrastat®) und Eptifibatid (Integrillin®) haben eine kurze Wirkdauer von zwei bis vier (Eptifibatid) bzw. vier bis sechs (Tirofiban) Stunden. Abciximab (ReoPro®) ist ein monoklonaler Antikörper mit einer langen Wirkdauer von über 48 Stunden. GpIIb/IIIa Antagonisten sind intravenöse Substanzen und werden ganz überwiegend periprozedural im Rahmen von PCI eingesetzt.
Non- und Low-Responder
Nicht alle Patienten reagieren auf ASS oder Clopidogrel mit einer adäquaten Thrombozytenaggregationshemmung, die individuelle Variabilität ist sehr hoch [21]. Non-Responder oder Low-Responder sind Patienten, bei denen in-vitro Thrombozytenfunktionstests wiederholt zeigen, dass die auf die antithrombozytäre Therapie unzureichend anspricht [22]. Wegen der Vielzahl der Messmethoden wurden in verschiedenen Studien Low-Responder-Raten für ASS von 5 bis 60 Prozent [23-25] und für Clopidogrel von 17 bis 25 Prozent berichtet [26,27].
Die Ursachen dieses Phänomens sind sehr vielfältig, am häufigsten ist jedoch die fehlende Compliance der Patienten. Weiterhin können verschiedene pharmakologische, patientenabhängige und genetische Ursachen zugrunde liegen (Tab. 1)
Tab. 1: Ursachen der verminderten Ansprechbarkeit auf ASS oder Clopidogrel
| Pathomechanismus | Ursachen | Unzureichendes Ansprechen auf |
| Verminderte Bioverfügbarkeit | Fehlende Patientencompliance Inadäquate Dosierung Verminderte Resorption |
ASS und Clopidogrel (27) ASS und Clopidogrel (27) ASS und Clopidogrel (27) |
| Medikamenteninteraktionen | Unterschiedliche Aktivität der Cytochrom-P450-Enzyme | Clopidogrel (28-30) |
| Gesteigerte Aggregabilität der Thrombozyten | Diabetes mellitus Nikotin Hypercholesterinämie Postoperativ |
ASS und Clopidogrel (31) ASS (32), Clopidogrel (33) Clopidogrel (34) ASS und Clopidogrel (35) |
| Genetische Unterschiede, Polymorphismen |
CYP2C19 COX-1 GpIIb/IIIa P2Y12-Rezeptor |
Clopidogrel (15,36) ASS (37) ASS und Clopidogrel (22) Clopidogrel (38) |
Die unzureichende Thrombozytenaggregationshemmung ist mit einem vermehrten Auftreten kardiovaskulärer Ereignisse assoziiert [39]. Bei bekannten Low-Respondern wird eine Dosisanpassung von Clopidogrel und/oder ASS bzw. ein Präparatwechsel zu Prasugrel diskutiert.
Perioperatives Management
Präoperative Risikoeinschätzung
Eingriffe bei Patienten mit Koronarstents stellen eine Herausforderung für Anästhesisten, Chirurgen und Kardiologen dar, weil hier das variable Risiko der Stentthrombose und das ebenfalls variable Blutungsisiko der Operation gegeneinander abgewogen werden müssen. Diese Risiken zusammen mit der Entscheidung über die individuelle Dringlichkeit des Eingriffes bestimmen die perioperative Strategie der Plättchenhemmung (Abb. 4).
Abb. 4: Das perioperative Vorgehen bezüglich der plättchenhemmenden Therapie ist abhängig vom Ausmaß des Thromboserisikos einerseits und des Blutungsrisikos andererseits. Diese Risiken verlaufen reziprok und die Dreiecke zeigen das Ausmaß des Risikos. Die Abbildung symbolisiert die Weitergabe und das Pausieren der Thrombozytenaggregationshemmer. Modifiziert nach [72].
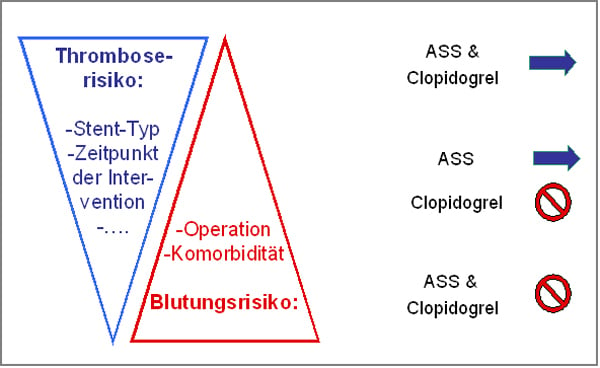
Einschätzung des Stentthromboserisikos
Der plötzlich auftretende thrombotische Verschluss eines Koronarstents ist eine lebensbedrohliche Komplikation. In 25 bis 65 Prozent kommt es zum Myokardinfarkt, der bei 45 bis 75 Prozent der Patienten tödlich verläuft [7,40]. Das Risiko der Stentthrombose ist abhängig von
– dem Typ des Stents,
– der Zeitdauer seit der Stentimplantation und
– zusätzlichen Risikofaktoren (Tab. 2) [41].
Tabelle 2. Zusätzliche Risikofaktoren für eine Stentthrombose. Modifiziert nach [14].
| Patientenabhängige Faktoren | frühzeitiges Absetzen der dualen Plättchenhemmung Diabetes mellitus Niereninsuffizienz hohes Alter verminderte Auswurffraktion Operation |
| Indikation für den Stent | akutes Koronarsyndrom |
| Angiografische Faktoren | lange Stents (>18 mm) dünne Stents (<3 mm) multiples Stenting überlappende Stents Bifurkations- und ostiumnahe Stents suboptimale Stentresultate |
Der wichtigste Risikofaktor für die Stentthrombose ist das frühzeitige Absetzen der dualen Plättchenhemmung mit einem neunzigfachen Risiko für das Eintreffen der Stentthrombose [40,42]. Infolge der intraoperativen hämostatischen Reaktion entwickelt sich außerdem eine postoperative Hyperkoagulobilität und eine gesteigerte Aggregabilität der Thrombozyten für mindestens sieben Tage nach dem Eingriff [43,44]. Der operative Eingriff selbst ist also bereits ein Risiko für die Stentthrombose [45].
Nach der zeitlichen Einordnung für das Auftreten einer Stentthrombose unterscheidet der Academic Research Consortium (ARC) [46]
– frühe Stentthrombosen innerhalb von 30 Tagen nach Implantation,
– späte Stentthrombosen zwischen dem 30. und 365. Tag und
– sehr späte Stentthrombosen nach dem ersten Jahr.
Die frühen Stentthrombosen werden wiererum aufgeteilt in akute Formen innerhalb der ersten 24 Stunden und subakute Formen zwischen dem ersten und 30. Tag. Die Inzidenz der frühen Stentthrombose unter der empfohlenen Thrombozytenaggregationshemmung und ohne Operation liegt bei 0,7 Prozent und die Inzidenz der späten Stentthrombosen 0,4 Prozent [47]. Dies gilt für beide Stenttypen. Sehr späte Stentthrombosen sind bei unbeschichteten Stents äußerst gering, während das Risiko bei den beschichteten Stents über mehrere Jahre fortbesteht [13,48,49]. Die kumulative Inzidenz der Stentthrombose beträgt 1 bis 2 Prozent. Die Inzidenz der Stentthrombose bei Patienten mit Operation und Pausieren der laufenden Plättchenhemmung perioperativ wurde mit 4 bis 5 Prozent angegeben [50,51].
Einschätzung des perioperatives Blutungsrisikos
Für das Blutungsrisiko bei Operationen unter ASS und Clopidogrel liegen Daten aus der Kardiochirurgie vor: Das Risiko für Transfusionen und chirurgische Reinterventionen zeigte sich etwa fünffach erhöht ohne Einfluss auf die Sterblichkeit [52]. Eine aktuelle Metaanalyse konnte zeigen, dass bei Patienten die unter Clopidogrel operiert wurden, zudem auch die Beatmungsdauer und der Krankenhausaufenthalt verlängert war [53]. Das Risiko einer Blutungskomplikation während eines chirurgischen Eingriffs wird durch ASS alleine um den Faktor 1,5 erhöht, ohne dass dadurch die Letalität ansteigt [54].
Bei einigen Operationen sind allerdings selbst quantitativ kleinere Blutungen mit einer so großen Morbidität verbunden, dass das Absetzen jeglicher Thrombozytenaggregationshemmung zwingend ist. Dies gilt für intrakranielle Eingriffe, Operationen am Spinalkanal und Operationen am Augenhintergrund [54]. Die großen Gefäßeingriffe, größere Eingriffe in der Tumorchirurgie und große rekonstruktive plastische Operationen tragen per se ein – auch quantitativ – hohes Blutungsrisiko, so dass viele Chirurgen das Absetzen der Thrombozytenaggregationshemmer oder zumindest eine Reduktion der dualen Plättchenhemmung nur auf ASS hier fordern. In der Allgemein-, Gefäß-, Unfallchirurgie und Orthopädie wurde ein um 4 Prozent erhöhter Transfusionsbedarf bei Operationen unter Aspirin und Clopidogrel beschrieben [51]. Bei diesen Operationen verursachen Blutungskomplikationen jedoch einen viel kleineren Schaden als ein Myokardinfarkt aufgrund einer Stentthrombose. Vor diesem Hintergrund sollten, soweit möglich, Eingriffe innerhalb des kritischen Intervalls unter dem Schutz der dualen Plättchenhemmung erfolgen. Eingriffe mit einem geringen Blutungsrisiko bzw. solche mit einer einfach zu behebenden Blutung (z. B. Kataraktoperation, Zahnextraktion, Hautbiopsie und Nävusentfernung) können in der Regel problemlos unter dualer Plättchenhemmung erfolgen [55].
Einschätzung der Dringlichkeit des Eingriffes
Elektive Operationen müssen außerhalb eines sogenannten „kritischen Intervalls“ erfolgen [3,4]. Nach den neuesten Leitlinien für die präoperative Risikoevaluation und das kardiale Management bei nicht-kardialen Operationen der European Society of Cardiology (ESC) vom September 2009 sollten elektive Eingriffe frühestens sechs Wochen, idealerweise jedoch drei Monate nach der Implantation eines Bare-Metal Stents und frühestens 12 Monate nach der Implantation eines Drug-Eluting Stents durchgeführt werden (Abb. 5) [4]. Abweichend zu den davor gültigen Leitlinien des American College of Cardiology (ACC) und der American Heart Association (AHA) aus dem Jahr 2007 wurde damit das kritische Zeitintervall bei BMS (vier bis sechs Wochen nach AHA/ACC) weiter ausgedehnt, während sich das Vorgehen bei DES nicht verändert hat [3]. Insgesamt scheint das kardiale Risiko umso geringer zu sein, je später eine Operation nach erfolgter Stent-Implantation durchgeführt wird (56,57).
Abb. 5: Empfehlung der Europäischen Society of Cardiology (ESC) zum Management von elektiven Eingriffen bei Patienten mit Koronarstents in Abhängigkeit von Stent-Typ und Zeitpunkt der Implantation. Modifiziert nach [4].
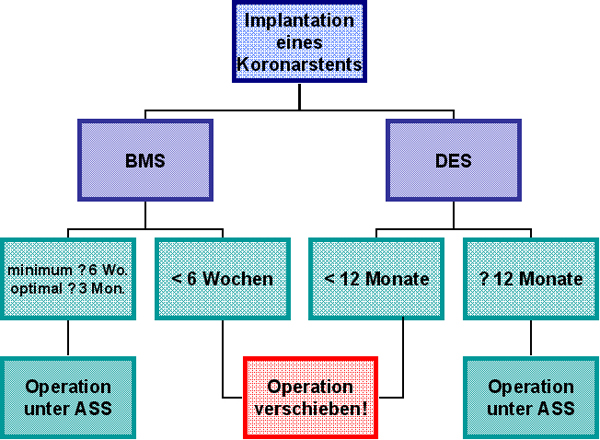
Bei dringlichen Operationen (z. B. wegen eines bösartigen Tumors) innerhalb der kritischen Intervalle nach Stent-Implantation muss zunächst individuell diskutiert werden, ob eine Verschiebung des Eingriffes außerhalb des kritischen Intervalls aus chirurgischer Sicht vertretbar ist [58]. Dies gilt vor allem dann, wenn die duale Thrombozytenaggregationshemmung teilweise oder ganz unterbrochen werden muss. Eine Wartezeit von drei bis 12 Monaten kann dabei medizinisch, aber auch psychologisch problematisch sei. Chirurg, Anästhesist und Kardiologe müssen hier das Risiko einer verzögerten operativen Therapie gegen das Risiko einer erhöhten kardialen Morbidität (und Letalität) abwägen und zusammen mit dem Patienten über den besten Operationszeitpunkt bzw. auch über die Reihenfolge der durchzuführenden Maßnahmen entscheiden.
Notfalloperationen sind weder verschiebbar noch kann die bestehende antiaggregatorische Medikation präoperativ verändert werden. Unabhängig vom verwendeten Stent ist die Rate schwerer kardialer Komplikationen bei Notfalleingriffen höher als bei elektiven Operationen [56].
Im Vordergrund steht hier die Beherrschung der Blutungskomplikationen. Bei Auftreten einer klinisch-relevanten Blutung unter ASS besteht als erste Behandlungsoption die Gabe des synthetischen Vasopressin-Analogons DDAVP (Minirin®) [59]. DDAVP führt u. a. zu einer gesteigerten Mobilisierung des von-Willebrand-Faktors aus dem Endothel und damit zu einer Verbesserung der Thrombozytenadhäsion und -aggregation. Eine weitere Option ist der Einsatz von Tranexamsäure zur Reduktion intraoperativer Blutungen. Zur Therapie einer sehr starken oder gar lebensbedrohlichen Blutung unter dem Einfluss einer plättchenhemmenden Medikation, insbesondere Clopidogrel, müssen Thromboyztenkonzentrate verabreicht werden, evtl. auch in Kombination mit DDAVP und / oder Antifibrinolytika [60,61].
Perioperative Strategien der Thrombozytenaggregationshemmung
Präoperatives Absetzen bzw. Weiterführen der dualen Antiplättchentherapie
Alle einschlägigen Leitlinien empfehlen die perioperative Fortführung der dualen Thrombozytenaggregationshemmung, wenn die Operation innerhalb des kritischen Zeitfensters durchgeführt wird [3,4,60]. Falls dies aus chirurgischer Sicht nicht vertretbar ist (vor Eingriffen in geschlossenen Höhlen, vor großen Operationen mit relevantem Blutungsrisiko), sollten Clopidogrel bzw. Prasugrel fünf bis sieben Tage und Ticlopidin zehn Tage präoperativ abgesetzt werden [62]. Bei Ticagrelor gibt es derzeit keine eindeutigen Empfehlungen für die Karenzzeit. Da das Medikament stark wirksam und seine biologische Wirksamkeit verlängert ist, sollten chirurgische Eingriffe nicht früher als fünf Tage nach Absetzen vorgenommen werden. Eine Bestimmung der Restwirkung dieser Substanzen ist mit Thrombozytenfunktionstests möglich [63].
Eine bestehende Medikation mit ASS sollte – außer bei Vorliegen absoluter Kontraindikationen (z. B. intrakranielle OP, manifeste Blutung o. ä.) – in der perioperativen Phase gar nicht mehr unterbrochen werden [45]. Auch die aktuellen Leitlinien der ESC empfehlen grundsätzlich eine perioperative Weitergabe von ASS [4].
Perioperatives Bridging der Plättchenhemmung
Das Bridging ist eine überbrückende intravenöse Thrombozytenaggregationshemmung mit kurzwirksamen GpIIb/IIIa-Antagonisten während der perioperativen Phase [64-66]. Angewandt wird es bei Eingriffen innerhalb des kritischen Intervalls nach Stentimplantation mit hohem operativen Blutungsrisko. Das Bridging ermöglicht es, die Thrombozytenaggregationshemmung nur sehr kurzzeitig zu unterbrechen und damit die vulnerable Phase zu verkürzen. Allerdings bietet es keinen kompletten Schutz, da das höchste Risiko für eine Stentthrombose während und kurz nach der Operation besteht. Das Bridging ist kostenintensiv und logistisch aufwändig. Die Hospitalisationsdauer ist verlängert. Der Nutzen ist bislang nicht prospektiv klinisch untersucht.
Eine weitere Möglichkeit der Bridgingtherapie für Patienten vor einem herzchirurgischen Eingriff stellt die Gabe von Cangrelor (einem intravenösem reversiblem ADP-Rezeptor-Antagonisten) dar [67]. Heparin allein oder auch andere Hemmstoffe der plasmatischen Gerinnung können die protektiven Wirkungen von Thrombozytenaggregationshemmern nicht ersetzen und sind daher – als Monosubstanz – für ein „Bridging“ ungeeignet.
Postoperative Wiederaufnahme der dualen Thrombozytenaggregationshemmung
Falls ASS bzw. ADP-Antagonist präoperativ abgesetzt worden sind, müssen sie postoperativ schnellstmöglich wieder angesetzt werden. Hier spielt die individuelle Blutungssituation des Patienten eine entscheidende Rolle. Dies gilt auch nach Notfalleingriffen. Standardmäßig wird die präoperative Dosierung (bei Clopidogrel i.d.R. 75 mg/Tag) weitergegeben.
In der postoperativen Phase ist jedoch die Rate der Low-Responder aus folgenden Gründen erhöht:
- durch den operativen Eingriff selbst induzierten prothrombotischen Status und hyperreagible Thrombozyten,
- aufgrund des Rebound-Phänomens nach abrupter Unterbrechung der thrombozyten-aggregationshemmenden Medikation [68].
Durch eine postoperative Aufsättigungsdosis von 300-600 mg kann die Frequenz der Low-Responder minimiert werden [45].
Postoperative Überwachung
Die postoperative Phase bedeutet eine besonders hohe Gefährdung bezüglich kardialer Ereignisse für Stentpatienten. Daher bedürfen alle Patienten, die innerhalb der kritischen Zeitintervalle nach Implantation von BMS bzw. DES operiert werden, einer intensiven postoperativen Überwachung [69]. Wenn die Operation die Unterbrechung der dualen Plättchenhemmung erforderlich gemacht hat, sollte die Monitorüberwachung bis zur Wiederaufnahme der Thrombozytenaggregationshemmung erfolgen. Bei einem Verdacht auf eine akute Stentthrombose sollte der Patient nach Stabilisierung der Hämodynamik rasch an eine interventionelle kardiologische Einheit transferiert werden, wo die Möglichkeit zur PCI und Wiedereröffnung des thrombosierten Stents besteht.
Zusammenfassung
Patienten nach Implantation von koronaren Stents müssen lebenslang mit ASS sowie für mindestens vier Wochen (Patienten mit BMS) bzw. für mindestens 12 Monate (Patienten mit DES) mit einem ADP-Antagonisten (z. B. Clopidogrel) behandelt werden.
- Die vorzeitige Unterbrechung der dualen Hemmung der Thrombozytenaggregation mit ASS und Clopidogrel bei Patienten mit Koronarstents erhöht das Risiko für eine Stentthrombose um das 90-fache.
- DES weisen im Gegensatz zu BMS aufgrund ihrer verzögerten Endothelialisierung ein wesentlich höheres Risiko für sehr späte Stentthrombosen auf.
- Nach der individuellen Einschätzung des Risikos für eine Stentthrombose, perioperative Blutungskomplikationen und Einschätzung der Aufschiebbarkeit des Eingriffes muss die Strategie der perioperativen Plättchenhemmung festgelegt werden.
- Nach den aktuellen Leitlinien der European Society of Cardiology (ESC) sollen nicht-herzchirurgische Eingriffe frühestens sechs Wochen (optimal drei Monate) nach einer BMS-Implantation bzw. 12 Monate nach einer DES-Implantation durchgeführt werden.
- Bei Operationen innerhalb der o. g. kritischen Zeitintervalle nach Stent-Implantation sollte die Therapie mit Thrombozytenaggregationshemmern im Allgemeinen perioperativ – ggf. auch unter Inkaufnahme eines erhöhten Blutverlustes – fortgeführt werden.
- Insbesondere darf eine Medikation mit ASS – außer bei Vorliegen absoluter Kontraindikationen (neurochirurgische OP, Operationen am Spinalkanal, am Augenhintergrund, manifeste Blutung) – perioperativ nicht unterbrochen werden.
- Vor Operationen mit relevantem Blutungsrisiko sollten Clopidogrel, Prasugrel und Tricagrelor fünf bis sieben Tage (bzw. Ticlopidin zehn Tage) präoperativ abgesetzt werden.
- Bei Eingriffen mit hohem Blutungs- und Stentthrombose-Risiko kann die orale Thrombozytenaggregationshemmung mit ASS und Thienopyridinen perioperativ durch kurzwirksame intravenöse GpIIb/IIIa-Antagonisten ersetzt werden (Bridging der Plättchenhemmung).
- Eine präoperativ unterbrochene Therapie mit Thrombozytenaggregationshemmern sollte postoperativ baldmöglichst weitergeführt werden.
- Einige Patienten sprechen nur unzureichend auf die Gabe von Thrombozytenaggregationshemmern an. Die Ursachen hierfür sind meist multifaktoriell.
Die Autoren weisen darauf hin, dass diesem Beitrag wesentliche Teile der Publikation „Jámbor C, Spannagl M, Zwissler B. Perioperatives Management von Patienten mit Koronarstents bei nichtherzchirurgischen Eingriffen. Anaesthesist 2009;58:971-85” zugrunde liegen und nun aktualisiert wurden. Mit freundlicher Genehmigung von Springer Science and Business Media.
Interessenkonflikt: Frau Dr. Cs. Jámbor hat von den Firmen IL und Dynabyte Honorare für wissenschaftliche Vorträge bzw. Beratertätigkeit erhalten. Herr Prof. Michael Spannagl erhielt Vortragshonorare von den Firmen Sanofi, Eli Lilly und Daiichi-Sankyo. Die Präsentation des Themas ist unabhängig und in der Darstellung der Inhalte produktneutral.
Literatur erhalten Sie auf Nachfrage, schreiben Sie an: passion_chirurgie@bdc.d