12.02.2016 Thoraxchirurgie
Herausforderung Mesotheliom
Herausforderungen in der Diagnostik
Obwohl es schon seit 1993 ein Verbot für Asbest in Deutschland gibt, steigt die Inzidenz des MPMs weiter an, man veranschlagt eine Verdoppelung der Inzidenz zwischen den 1990er Jahren bis 2015 [5]. Insgesamt haben Männer ein höheres Risiko an einem MPM zu erkranken, da sie beruflich häufiger Kontakt mit dem Schadstoff Asbest hatten. Die regionale Verteilung des MPM in Deutschland variiert hauptsächlich wegen der unterschiedlichen Asbestexpositionen in der Industrie [6]. Die höchsten Neuerkrankungsraten treten in Gebieten mit Schiffbau und Kraftwerken auf [7].
Es gibt kein allgemein vereinbartes Protokoll für das Screening von Personen, die Asbest ausgesetzt waren. Sowohl die Computertomographie (CT) als auch serologische Marker haben bisher keine Verbesserung der Früherkennung erbracht [8]. Dies schließt jedoch nicht aus, dass man gerade in Regionen mit Industriebetrieben mit historisch klassischem Asbestkontakt (s. o.) bei Patienten mit Dyspnoe und thorakalem Schmerz auch differentialdiagnostisch das MPM einbeziehen sollte.
Die Diagnose des MPM ergibt sich durch eine Zusammenschau klinischer, radiologischer, thorakoskopischer sowie histologischer Befunde. Die CT gilt als empfohlenes Standardverfahren für das primäre Staging und in der Beurteilung der Ausdehnung des Mesothelioms. Ergänzend können eine Positronenemissions- und Magnetresonanztomographie zur Beurteilung der Ausbreitung der Tumorerkrankung (z. B. peritoneal) bzw. einer Brustwandinfiltration durchgeführt werden. Bei allen Patienten sollte im Rahmen eine Pleurapunktion zur Festlegung der Zytologie durchgeführt werden, wobei nur in 25 bis 33 Prozent der Patienten in der Ergussmenge MPM Zellen gefunden werden. Da das MPM einem Adenokarzinom mit Pleurakarzinose oder reaktiv veränderten Mesotheliomzellen ähnelt, kann sich die genaue Diagnosestellung als schwierig erweisen. Selbst bei histologischer Untersuchung wird bis zu 13 Prozent eine falsche Diagnose gestellt [5]. Der Standard in der Diagnostik eines MPM sollte die internistische Thorakoskopie oder die videoassistierte thorakoskopische Chirurgie (VATS) sein, da hier der komplette Hemithorax betrachtet werden kann und somit auch die Möglichkeit besteht, die lokoregionäre Tumorausbreitung zu beurteilen. Außerdem können dabei größere Gewebeproben an unterschiedlichen Stellen des Thorax entnommen werden, wodurch in sehr vielen Fällen erfolgreich die Diagnose des MPM gestellt werden kann. Die Differenzierung in einen der histologischen Subtypen (epitheloid, biphasisch, sarkomatös) ist von besonderer prognostischer und therapeutischer Bedeutung.
Herausforderungen in der Therapie
Für die Behandlung des MPM gibt es keine Standardtherapie. Empfohlene Therapiekonzepte reichen von alleiniger symptomatischer Behandlung („best supportive care“) oder unimodaler Therapie bis hin zu einer aggressiven multimodalen Behandlung aus Operation, Chemotherapie und Bestrahlung.
Chemotherapie
Patienten mit einem MPM sprechen meist sehr schlecht auf eine Chemotherapie an (Ansprechraten liegen bei 30 bis 40 Prozent), die Therapieerfolge sind von kurzer Dauer und komplette Remissionen sind kaum zu sehen. Kombinationschemotherapien haben im Vergleich zu Monotherapien bessere Ansprechraten erreicht. Die Kombination aus Cisplatin und Pemetrexet wurde in den letzten Jahren als Standard eingeführt und zeigt bisher die besten Ansprechraten, die längsten progressionsfreien Intervalle und das beste Überleben.
Im Rahmen der multimodalen Therapie wird die Chemotherapie (Cisplatin/Pemetrexed) neoadjuvant appliziert. Ein radiologisches Ansprechen auf die Induktionshemotherapie zeigte einen Überlebensvorteil. Dabei scheinen vor allem Patienten ohne Befall der mediastinalen Lymphknoten, von der neoadjuvanten Chemotherapie zu profitieren [9]. Eine adjuvante Chemotherapie, die nach einer erweiterten Pleuropneumonektomie (EPP) gleichzeitig mit einer Bestrahlung durchgeführt wurde, hat eine hohe Toxizität gezeigt [10].
Radiotherapie
Das MPM ist wenig strahlensensibel [11]. Strahlendosen, die zu einer Tumorkontrolle führen könnten, dürfen nicht angewendet werden, da unmittelbar an den Tumor angrenzende Organe wie Lunge, Herz, Speiseröhre und Rückenmark durch die Strahlung geschädigt werden würden. Nach einer EPP kann der betroffene Hemithorax mit einer höheren Strahlendosis bestrahlt werden, da die Lungentoxizität reduziert ist.
Nach diagnostischer VATS des MPM kann es in bis zur Hälfte der Patienten zu einer Tumoraussaat im Stichkanal kommen [12]. Die prophylaktische Stichkanalbestrahlung dient der Verhinderung von Impfmetastasen und wird in der Regel gut vertragen, sie sollte routinemäßig nach invasiver Diagnostik des MPMs durchgeführt werden.
Operation
Die operativen Möglichkeiten zur Therapie von Patienten mit einem MPM können einen potentiell kurativen oder rein palliativen Charakter besitzen.
Palliative Operationsverfahren
Das primäre Behandlungsziel von MPM-Patienten mit einem fortgeschrittenen Tumor und begleitendem Pleuraerguss ist in den meisten Fällen die Palliation durch Minderung der klinischen Beschwerden. Bei diesen Patienten steht die Dyspnoe häufig im Vordergrund. Die chirurgische Behandlung besteht im ersten und wichtigsten Schritt im Ablassen des Pleuraergusses und sekundär in einer Prävention eines Nachlaufens des Ergusses.
Häufig erfolgt das erste Absaugen eines Pleuraergusses während der Diagnostik (Pleurapunktion, VATS). Die Anwendung der thorakoskopischen Pleurodese (fast ausschließlich mit Talkum) ist auf Patienten beschränkt, bei denen es intraoperativ zur vollständigen Ausdehnung der Lunge kommt. Bei Pleurapunktion und nachfolgender Einlage einer Thoraxdrainage ist auch die Talkumgabe als Aufschwemmung über die Thoraxdrainage möglich. Die Erfolgsraten von thorakoskopischer Talkumpoudrage und Talkaufschwemmung sind vergleichbar.
Die VATS inklusive Pleurodese kann mit Nebenwirkungen und Komplikationen (Fieber, Schmerzen) verbunden sein. Für Talkumpleurodese ist in einigen Studien die Auslösung eines ARDS (Acute Respiratory Distress Syndrome) beschrieben. Zusätzlich ist die VATS mit Talkumpleurodese meist mit einem Krankenhausaufenthalt von einigen Tagen verbunden.
Als Alternative zur Talkumpleurodese hat sich die Einlage von dauerhaften, getunnelten Pleurakathetern (PleurX) zur palliativen Behandlung von malignen Pleuraergüssen etabliert. Besonders bei fehlender Lungenentfaltung, rezidivierendem Pleuraerguss und reduziertem Allgemeinzustand empfiehlt sich die Anlage einer solchen permanenten Pleuradrainage. Durch das regelmäßige Ablassen des Ergusses über den Katheter kann eine deutliche Verbesserung der Lebensqualität und Minderung der Dyspnoe erreicht werden. Patienten können mit diesem speziellen Kathetersystem weniger invasiv und sehr gut ambulant versorgt werden. In einigen Fällen wird durch die Anlage eines solchen Katheters sogar eine spontane Pleurodese erzielt, sodass dieser dann wieder entfernt werden kann.
Potentiell kurative Operationsverfahren
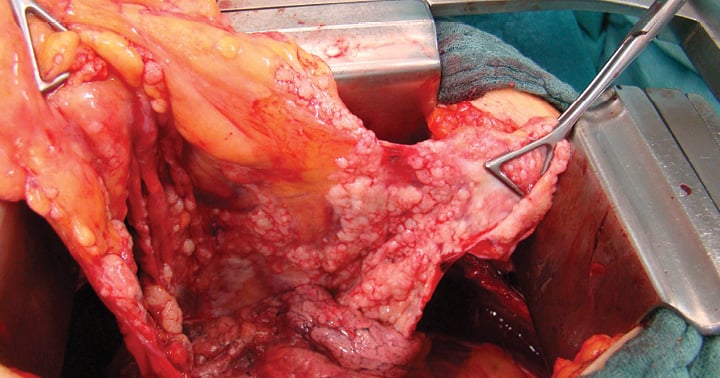
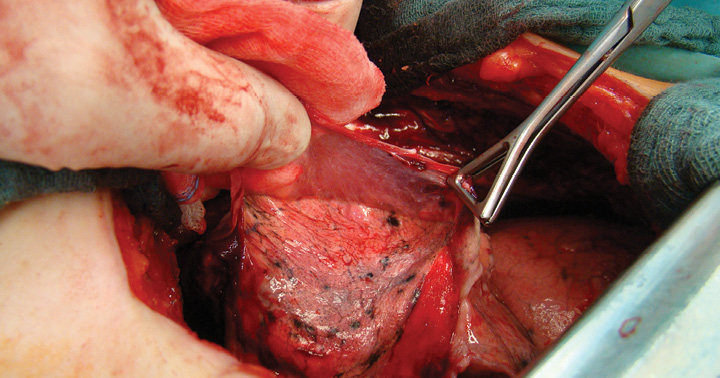
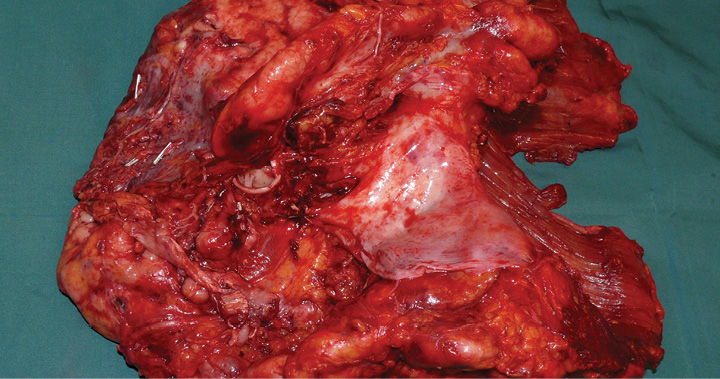
Die möglichst komplette chirurgische Resektion des MPM ist die Grundlage für eine erfolgreiche Behandlung bei resektablen Tumoren. Als chirurgische Resektionsverfahren kommen die Pleurektomie/Dekortikation (P/D) sowie die erweiterte Pleuropneumonektomie (EPP) infrage. Bei der P/D wird die parietale (Abb. 1a) und viszerale Pleura (Abb. 1b) unter Erhalt der Lunge reseziert. Bei einer erweiterten P/D kann das Perikard und/oder das Zwerchfell partiell oder komplett mitreseziert werden. EPP bedeutet die en bloc Resektion der Pleura parietalis, der Lunge, des ipsilateralen Zwerchfells und des Perikards (Abb. 2). Beide Operationsverfahren stellen trotz makroskopsicher Radikalität in der Tumorentfernung nur einen potentiell kurativen Therapieansatz dar, da die Einschätzung einer R0 Resektion durch den Pathologen aufgrund des diffusen Wachstums auf der Basis der Absätzungsränder fast nie getroffen werden kann. Es wird daher häufig auch nur von makroskopischer Tumorfreiheit gesprochen. Durch die EPP kann zwar eventuell die Tumorlast stärker reduziert werden als bei der P/D, aber durch den Umfang des Eingriffs ist die postoperative Morbidität und Mortalität nach EPP erhöht.
Die Rate an Lokalrezidiven ist nach der radikalen P/D deutlich höher im Vergleich zur EPP (65 versus 33 Prozent), während Fernmetastasen signifikant häufiger nach der EPP auftreten (35 versus 66 Prozent) [13]. Die Lokalisation des ersten Rezidivs eine MPMs ist zu ca. 50 Prozent der ipsilaterale Hemithorax und das Mediastinum. Um residuale, mikroskopische Mesotheliomzellen noch effektiver therapieren zu können, wird seit einigen Jahren nach chirurgischer Tumorresektion zusätzlich eine hypertherme intrathorakale Chemotherapieperfusion (HITHOC) durchgeführt. Die HITHOC kann sowohl nach radikaler P/D als auch EPP mit einer niedrigen Komplikationsrate durchgeführt werden, wobei die Art des Resektionsumfangs einen Einfluss auf die systemische Konzentration des Chemotherapeutikums und entsprechenden toxischen Komplikationen hat [14, 15]. Bisher gibt es jedoch keine randomisierten Studien, welche einen Vorteil der HITHOC gegenüber anderen multimodalen Behandlungen zeigen konnten. Sugarbaker et al. konnten jedoch für Patienten mit HITHOC im Vergleich zu einer Gruppe von Patienten ohne HITHOC ein signifikant verlängertes rezidivfreies Intervall als auch ein signifikant verlängertes Gesamtüberleben nachweisen [16].
Sowohl die P/D als auch die EPP haben ihre Vor- und Nachteile und sollten in Abhängigkeit vom Alter und Allgemeinzustand des Patienten, der Tumorausbreitung und der chirurgischen Expertise bei ausgewählten Patienten als potentiell kurative Therapie Anwendung finden.
Multimodale Therapie
Mit monotherapeutischen Ansätzen hatte man anfangs eher enttäuschende Ergebnisse. So konnte die rezidivfreie Zeit durch eine chirurgische Resektion zwar verlängert werden, im Vergleich zur Chemotherapie fand sich jedoch häufig kein Überlebensvorteil [14].
Die ersten multi(tri-)modalen Therapieansätze wurden durch die Arbeitsgruppe um Sugarbaker ab 1980 am Brigham and Woman’s Hospital in Boston erforscht und 1993 veröffentlicht [16]. Vor allem Patienten mit einem epithelialen MPM, tumorfreien Resektionsrändern und nicht befallenen extrapleuralen Lymphknoten zeigten nach trimodaler Behandlung (EPP, fortlaufende Chemotherapie und Bestrahlung) einen signifikanten Überlebensvorteil.
Ein einheitliches Therapiekonzept existiert heute jedoch noch nicht. So wird der Zeitpunkt der Chemotherapie (neoadjuvant/adjuvant) von einigen Kliniken auch in Abhängigkeit vom geplanten operativen Umfang (P/D versus EPP) gewählt. Auch die Bestrahlung der Thoraxwand ist wie oben dargestellt nur nach EPP indiziert. Leider fehlen auch in der multimodalen Behandlung des MPM randomisierte Studien.
Zusammenfassung
Das Auftreten des MPM ist in Abhängigkeit von asbestassoziierten Industriestandorten regional unterschiedlich, was einer erhöhten Aufmerksamkeit von Risikopatienten in diesen Regionen bedarf. Unter den Neuerkrankungen ist die Rate an fortgeschrittenen Tumoren aufgrund von geringen oder zu spät erkannten Symptomen mit ca. 75 Prozent deutlich höher als bisher in rein chirurgischen oder pathologischen Studien vermutet. Da auch fortgeschrittene MPM nicht per se ein Ausschlusskriterium für eine Therapie sind, sollten möglichst alle Patienten einer Diagnostik inklusive Histologie- und Stadienbestimmung zugeführt werden.
Die Chirurgie stellt sowohl in der Diagnostik (VATS mit Biopsie) als auch in der Therapie (P/D oder EPP) die Basis für eine erfolgreiche Behandlung ausgewählter Patienten im Rahmen eines multimodalen Therapiekonzeptes (HITHOC, Chemo- und Radiotherapie) dar. Durch eine chirurgische Pleurodese oder Anlage eines dauerhaften Pleurakatheters kann auch in fortgeschrittenen Stadien eine Symptomreduktion erzielt werden.
Die Literaturliste erhalten Sie auf Anfrage via passion_chirurgie@bdc.de.
Hofmann H.-S. Herausforderung Mesotheliom. Passion Chirurgie. 2016 Februar, 6(02): Artikel 02_03.
Autor des Artikels
Prof. Dr. med. Hans-Stefan Hofmann
Abteilung für ThoraxchirurgieUniversitätsklinikum RegensburgFranz-Josef-Strauß-Allee 1193053Regensburg kontaktierenWeitere aktuelle Artikel
09.02.2022 Aus-, Weiter- & Fortbildung
Brustkorb-OPs künftig an 3D-Druck-Modellen trainieren
Nach einem Bericht des Deutschen Ärzteblattes vom 8.2.2022 wurde an der Otto-von-Guericke-Universität Magdeburg ein Ausbildungs- und Trainingsmodell für Operationen am menschlichen Brustkorb entwickelt.
01.11.2020 Thoraxchirurgie
Thoraxchirurgie in Lokalanästhesie
Das anästhesiologische Standardsetting für thoraxchirurgische Eingriffe ist die Doppellumenintubation mit Einlungenventilation während des Eingriffes in Allgemeinnarkose. Der Einsatz der maschinellen Beatmung im Allgemeinen und der Einlungenventilation im Speziellen ab den 1960er Jahren hat die anatomischen, onkologischen und erweiterten Resektionen der Lunge vereinfacht oder erst ermöglicht.
01.01.2019 Thoraxchirurgie
Beste Karrierechancen in der Viszeralchirurgie und in der Thoraxchirurgie
Die Schwierigkeiten, ärztliche Führungspositionen zu besetzen, nehmen zu. Wollen Krankenhäuser heutzutage eine Oberarztstelle besetzen, brauchen sie häufig einen langen Atem. Dass Vakanzen auf der zweiten Führungsebene länger als ein Jahr bestehen bleiben, ist keine Seltenheit mehr. Und auch Chefarztbesetzungen laufen in einigen Bereichen nicht mehr ganz reibungslos.
09.10.2017 BDC|News
Passion Chirurgie: Thoraxchirurgie
Pleura, Lunge, Tracheo-Bronchialsystem, Mediastinum und Thoraxwand sind „Spielfelder“ der aktuellen Ausgabe PASSION CHIRURGIE: Die Thoraxchirurgie steht im Fokus. Denn in diesem Monat findet die 26. Jahrestagung der Deutschen Gesellschaft für Thoraxchirurgie (DGT) unter dem Schlagwort „Horizonte“ in München statt. Gerade für ein kleines, aber hoch spezialisiertes Fachgebiet wie die Thoraxchirurgie ist die Kooperation mit anderen chirurgischen Disziplinen wichtig.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.