01.03.2025 CME-Artikel
CME: Neues aus der aktualisierten S3-Leitlinie zur Diagnostik, Therapie und Nachsorge der peripheren arteriellen Verschlusskrankheit

Erweitern Sie Ihre CME-Punkte, indem Sie nach dem Lesen des Artikels die Fragen dazu auf der BDC|eAkademie beantworten!
Der Artikel „S3-Leitlinie zur Diagnostik, Therapie und Nachsorge der peripheren arteriellen Verschlusskrankheit“ ist für BDC-Mitglieder drei Monate kostenlos in ihr Konto gebucht! Loggen Sie sich auf www.bdc-eakademie.de ein: Einfach starten!
Die periphere arterielle Verschlusskrankheit (pAVK) ist eine häufige Erkrankung, die mit einer signifikanten Morbidität und Mortalität einhergeht. Sie betrifft ca. 237 Millionen Menschen weltweit und jeden vierten Einwohner zwischen 45 und 74 Jahren in Deutschland [1-3]. Das Vorliegen dieser Marker-Erkrankung ist eng mit zahlreichen kardiovaskulären Risikofaktoren verbunden. In den letzten Jahren hat sich das Verständnis der Erkrankung sowie der diagnostischen und therapeutischen Ansätze erheblich weiterentwickelt. Zwischen 2019 und 2024 sind ca. zehn internationale Praxisleitlinien unterschiedlicher Fachgesellschaften veröffentlicht worden. Die in diesem Jahr aktualisierte Version der interdisziplinären S3-Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) zur Diagnostik, Therapie und Nachsorge der pAVK spiegelt diese Fortschritte wider und bietet evidenzbasierte Empfehlungen für die klinische Praxis in Deutschland. Sie wurde in interdisziplinärer Zusammenarbeit aller beteiligten Fachdisziplinen entworfen und im September 2024 final veröffentlicht [4]. Erstmals sind der Leitlinie Schlüsselfragen vorangestellt, die den inhaltlichen Fokus der Literaturrecherche und des Leitlinienupdates darstellen.
Dieser Übersichtsartikel beleuchtet die wesentlichen Änderungen und Neuerungen der Leitlinie und analysiert deren klinische Relevanz für die Versorgung von Patienten mit pAVK in Deutschland. Ziel ist es, ein vertieftes Verständnis der aktuellen Standards zu vermitteln und die Implementierung dieser Leitlinien in die tägliche Praxis zu fördern.
Diagnostik
Das aktualisierte Kapitel zur Diagnose der pAVK legt größeren Wert auf die Spezifizierung der chronischen extremitätengefährdenden (kritischen) Durchblutungsstörung mit dem Ziel, sich stärker auf das Amputationsrisiko zu konzentrieren und dieses möglicherweise abwendbare Ergebnis zu vermeiden. Zu diesem Zweck wurde der Begriff „chronic limb-threatening ischemia“ (CLTI) anstelle des weniger spezifischen und teilweise irreführenden Begriffs „critical limb ischemia“ (CLI) an die internationale Terminologie angepasst. Hierdurch kann der spezifische Verlauf und die Pathogenese der CLTI im Gegensatz zur akuten Extremitätenischämie besser abgegrenzt werden. Sobald der Verdacht auf eine CLTI besteht, sollte eine weiterführende stufenweise Gefäßdiagnostik eingeleitet werden, um die Festlegung des weiteren Vorgehens zu unterstützen. In diesem Zusammenhang hat sich seit mehreren Jahren auch der „Wound, Ischemia, and Foot Infection“ (WIfI) Score etabliert, der neben der Beurteilung der Wunde auch funktionelle Parameter wie Knöchel-Brachial-Index (ABI), Zehen-Brachial-Index (TBI) und transkutanen Sauerstoffpartialdruck (tcPO2) berücksichtigt und somit eine Hilfestellung für die Indikationsstellung als auch eine Prognose für das Amputationsrisiko liefert.
Ein Überblick über den in der Leitlinie empfohlenen Algorithmus zum diagnostischen Vorgehen wird in Abbildung 1 gegeben.
Konservative Therapie
Aufgrund der zunehmenden Überalterung der Gesellschaft (demografische Entwicklung) und der Zunahme der Prävalenz anerkannter Risikofaktoren wie Diabetes mellitus, arterielle Hypertonie, Übergewicht und Dyslipidämie ist in den nächsten Jahren mit einem weiteren Anstieg der Prävalenz der pAVK zu rechnen [5]. Es gilt außerdem als anerkannt, dass ca. 7 % der asymptomatischen Betroffenen innerhalb von fünf Jahren eine Claudicatio intermittens bzw. von diesen wiederum etwa 21 % eine CLTI entwickeln werden, was den potenziell progressiven Charakter dieser Erkrankung illustriert [6]. Nur durch ein konsequentes Management der etablierten Risikofaktoren und eine optimale Arzneimitteltherapie lässt sich diese Progression verlangsamen oder sogar aufhalten.
Die Säulen der Behandlung der pAVK sind die Wiederherstellung und Aufrechterhaltung des arteriellen Blutflusses zu den Extremitäten und die Behandlung der kardiovaskulären Risikofaktoren und Begleiterkrankungen. Zu diesem Zweck wird in erster Linie eine konservative Therapie eingesetzt, die alle invasiven Maßnahmen flankieren muss.
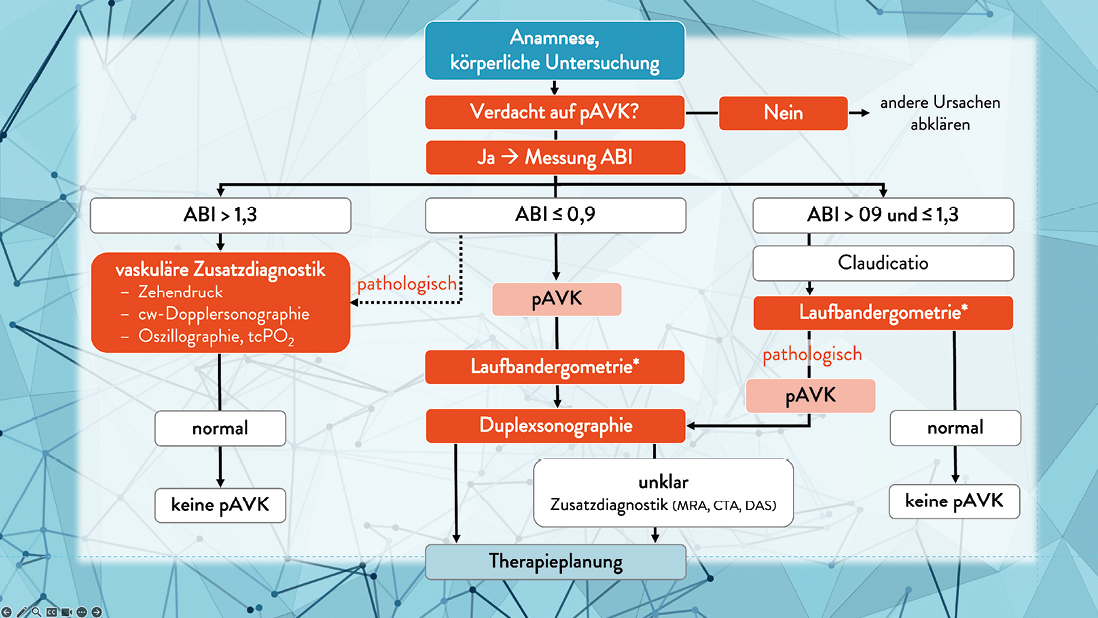
Abb. 1: Diagnostischer Algorithmus aus [4]
Die Basisbehandlung umfasst die Anleitung zu körperlicher Aktivität und systematischem Gehtraining, Gewichtsreduktion bei übergewichtigen Patienten, Rauchentwöhnung und die Behandlung von relevanten Komorbiditäten, wie arterielle Hypertonie, Dyslipidämie und Diabetes mellitus.
Aufgrund fehlender Informationen und daraus resultierenden Fehleinschätzungen wird die Adhärenz von Menschen mit pAVK oft als gering eingeschätzt. Dies macht die konservative Behandlung besonders schwierig, da erwartete positive Effekte (z. B. Erhöhung der Mobilität, Linderung von Schmerzen) nicht unmittelbar bzw. spürbar einsetzen. Das systematische Gefäßtraining als anerkannte Grundlage der Gefäßtherapie wird nur von etwa 10 % der Patienten regelmäßig und effektiv durchgeführt [7]. Eine begleitete Rauchentwöhnungsmaßnahme wird nur in ca. 30 % der Fälle angeboten bzw. wahrgenommen. Warnsignale hinsichtlich einer symptomatischen Verschlechterung der pAVK werden häufig falsch interpretiert oder negiert. Der Grundsatz jeglicher Therapie der pAVK ist ein streng stadiengerechtes Vorgehen.
Spezielle Neuerungen der konservativen Therapie spiegeln sich in folgenden Empfehlungen wider.
Rauchen
Patientinnen und Patienten mit pAVK sollen das Tabakrauchen (in jeglicher Form) einstellen. (Grad A LoE 1)
Raucherinnen und Rauchern soll ein Programm aus ärztlicher Betreuung, Gruppentherapie, Nikotinersatz sowie evidenz-basierten Rauchentwöhnungspräparaten (Varenicline, Bupropion) angeboten werden. (Grad A LoE 1)
Dyslipidämie
Bei Patientinnen und Patienten mit pAVK soll eine lipidsenkende Therapie durchgeführt werden. Dabei soll ein High-Intensity-Statin angewandt werden. (Grad A LoE 1)
Der LDL-Zielwert sollte kleiner 55 mg/dl bzw. kleiner 1,4 mmol/l und ≥ 50 % Senkung des Ausgangswertes bei Erkrankten mit pAVK betragen. (Konsensempfehlung)
Antithrombotische Therapie
Für die antithrombotische Therapie stabiler Patienten sowie zur postoperativen bzw. postinterventionellen Behandlung fehlen bis heute robuste und einheitliche Daten aus hochwertigen randomisierten kontrollierten Studien. Neben der grundsätzlichen Empfehlung zur Einleitung einer thrombozytenaggregationshemmenden Therapie bei allen symptomatischen Patienten konkurrieren daher heute zahlreiche Alternativstrategien, teilweise auf dem Boden einer schwachen Evidenzbasis: Einfache vs. duale Thrombozytenaggregationshemmung, therapeutische Antikoagulation (z. B. mit Vitamin-K-Antagonisten) und die Kombination von ASS 100mg mit Rivaroxaban in vaskulärer Dosis (2,5mg) [8–10]. Bei allen Therapieerwägungen sollte grundsätzlich das individuelle Blutungsrisiko erhoben werden, wobei bis heute nur ein extern mehrfach validierter Risikoscore zur Verfügung steht ([11]). Folgende Empfehlungen haben Einzug erhalten:
- Patientinnen und Patienten mit symptomatischer pAVK sollen mit einem Thrombozytenaggretationshemmer behandelt werden. (Grad A LoE 1)
- Dabei sollte Clopidogrel 75 mg/d gegenüber ASS 100 mg/d bevorzugt werden. (Grad B LoE 2)
- Bei vaskulären Hochrisikopatientinnen und -patienten sollte unter Beachtung von Blutungsrisiken eine kombinierte antithrombotische Therapie (Dual-Pathway Inhibition) mit ASS 100 mg/d und Rivaroxaban 2x 2,5 mg/d erwogen werden. (Grad B LoE 1)
- Bei frisch operierten Gefäßpatientinnen und -patienten mit pAVK sollte unter Beachtung von Blutungsrisiken eine kombinierte antithrombotische Therapie (mit ASS 100 mg/d und Rivaroxaban 2x 2,5 mg/d) erwogen werden. (Konsensempfehlung)
Gefäßspezifisches Bewegungstraining
Zum Konzept der stadienadaptierten Behandlung der pAVK gehört, dass allen Patientinnen und Patienten mit pAVK im Stadium II (Claudicatio intermittens) als Initial-Therapie ein Gehtraining, idealerweise in strukturierter und angeleiteter Form, einschließlich einer Best Medical Therapy (BMT), empfohlen wird. Die Dauer der konservativen Therapie (Gehtraining+BMT) soll mindestens drei bis sechs Monate betragen und anschließend reevaluiert werden. Bei Verbesserung der Claudicatio intermittens Symptomatik ist die Fortführung der konservativen Therapie empfohlen, bei Stagnation oder Verschlechterung kann eine Revaskularisation erwogen werden. Entsprechend dieses Vorgehens haben sich folgende Empfehlungen ergeben:
Strukturiertes Gehtraining unter qualifizierter Anleitung ist wirksamer als unstrukturiertes Gehtraining und soll allen Patientinnen und Patienten mit Claudicatio als Bestandteil der Basisbehandlung angeboten werden. (Grad A LoE 1)
Alternatives Bewegungstraining unter Anleitung ist hinsichtlich der schmerzfreien und maximalen Gehstrecke dem traditionellem Gehtraining unter Anleitung gleichwertig und sollte erwogen werden, wenn überwachtes Training nicht möglich ist. (Grad A LoE 2)
Ein gefäßspezifisches Bewegungstraining bei Patientinnen und Patienten mit Claudicatio soll mindestens dreimal wöchentlich in Übungseinheiten von 30 bis 60 Minuten über einen Zeitraum von mindestens drei Monaten erfolgen. (Grad A LoE 2)
Neuere Ansätze zur Erhöhung der Erfolgswahrscheinlichkeit eines Gehtrainings sind z. B. Aktivitätssensoren und Fitness-Apps die sich zum Monitoring von körperlicher Aktivität und als Mittel zur Steigerung der schmerzfreien und maximalen Gehstrecke bei Patientinnen und Patienten mit pAVK eignen.
Ergänzend muss aber erwähnt werden, dass trotz der überragenden Evidenz für die Wirksamkeit eines strukturierten Gehtrainings bundesweit eine Unterversorgung an Angeboten spezieller Gefäßsportgruppen besteht. Idealerwiese sollten Rahmenbedingungen geschaffen werden, die häusliches strukturiertes Training mit entsprechendem Monitoring des Trainingsfortschritts und Begleitung des Trainings ermöglichen, um damit eine Alternative zum strukturierten Bewegungstraining in Gefäßsportgruppen zu eröffnen.
Revaskularisierende Therapie
Das Kapitel „Revaskularisierende Therapie“ wurde in der aktualisierten Form der Leitlinie neu strukturiert und umfasst nun erstmals die endovaskulären und offenen chirurgischen Therapieformen in einem Kapitel. Hierdurch wird dem behandelnden Team ein besserer Überblick über die möglichen Revaskularisationsoptionen und deren Evidenzbasis in den verschiedensten Patientenkonstellationen ermöglicht. Untergliedert ist das Kapitel dabei anhand der verschiedenen anatomischen Regionen (aorto-iliakal, Leistenregion, femoro-popliteal und crural). Dabei ist gerade die Frage der bestmöglichen Revaskularisation im Falle einer CLTI durch neue Evidenz belegt. Hierzu wurden im Rahmen der Leitlinienerstellung zwei neue randomisiert kontrollierte Studien veröffentlicht (BEST-CLI und BASIL-2), die in die Empfehlungen Einzug hielten [12, 13]. Diese beiden Studien, die auf den ersten Blick konträre Schlussfolgerungen zogen wurden diskutiert sowie bewertet. Folgende Empfehlungen sind dabei besonders relevant:
Aorto-ilikale Strombahn
Die Wahl des Behandlungsverfahrens bei aorto-iliakalen Läsionen soll unter Hinzuziehung endovaskulärer und offen-operativer Expertise interdisziplinär erfolgen. Die Entscheidung soll unter Berücksichtigung der Gefäßmorphologie, der Begleiterkrankungen und der Prognose getroffen werden. (Grad A LoE 3)
Femoralisgabel
Verschlussprozesse der Femoralisgabel sollen primär gefäßchirurgisch behandelt werden. (Grad A LoE 3)
Bei Patientinnen und Patienten mit hohem patientenspezifischem Risiko bei offen-chirurgischem Vorgehen sollte ein endovaskuläres Vorgehen zur Behandlung von Läsionen der A. femoralis communis erwogen werden. (Grad B LoE 2)
Femoro-Poplitale/Crurale Strombahn
Patientinnen und Patienten im Stadium der kritischen Ischämie mit komplexen, langstreckigen infrainguinalen Verschlussläsionen können primär offen-chirurgisch oder interventionell therapiert werden.
Hierbei sind zu berücksichtigen: Vorhandensein einer geeigneten Vene, Gefäßmorphologie, Begleiterkrankungen, Lebenserwartung sowie die lokale Expertise. (Grad 0 LoE 2)
Im Bereich der endovaskulären Verfahren werden Empfehlungen zu den jeweils technisch sinnvoll zur Verfügung stehenden Verfahren gegeben. Hierzu zählen u. a.:
- Bei endovaskulärer Behandlung femoropoplitealer Läsionen sollen adjuvant Paclitaxel-beschichtete Ballons eingesetzt werden, da sie nachweislich die Restenoserate sowie die Reinterventionsrate im Vergleich zu Angioplastie mit unbeschichteten Ballons senken. (Grad A LoE 1)
- Bei der Behandlung langstreckiger (> 20 cm) oder stark verkalkter femoropoplitealer Läsionen können aufgrund höherer Offenheitsraten im Vergleich zu herkömmlichen Nitinolstents heparinbeschichtete Stentgrafts eingesetzt werden. (Grad 0 LoE 3)
Im Falle eines offen-chirurgischen Vorgehens sind speziell folgende Empfehlungen von Relevanz:
- Bei gegebener Indikation eines femoro-poplitealen Bypasses soll die Vena saphena magna (möglichst aus einem Segment bestehend) verwendet werden, sowohl bei Claudicatio als auch bei kritischer Ischämie, da sie alternativem Bypassmaterial überlegen ist. (Grad A LoE 1)
- Falls keine geeignete Vena saphena magna vorhanden ist, sollte alternatives Material (körpereigene Venen, PTFE, Dacron) als Bypassmaterial verwendet werden. (Grad B LoE 2)
Fußarterien
Die offen-chirurgische pedale Revaskularisierung soll bei anders nicht revaskularisierbarer CLTI angeboten werden. (Konsensempfehlung)
Weiterhin behandelt dieses Kapitel erstmals das Vorgehen im Rahmen von Infekt Situationen und gibt Empfehlungen im Falle der Notwendigkeit von Amputationen. Folgende Empfehlungen sind dabei hervorzuheben.
Vor jeder Amputation soll durch eine gefäßmedizinische Facharztbeurteilung ein Gefäßstatus erhoben, ein lokaler Infekt saniert und im Falle einer Ischämie eine Revaskularisation durchgeführt werden. (Konsensempfehlung)
Die Amputationshöhe sollte durch die Perfusion, die zu erwartende Mobilität und Funktionalität der Extremität sowie die orthopädische Belastbarkeit des Stumpfes bestimmt werden. (Konsensempfehlung)
Der geriatrische Patient
Ein komplett neues Kapitel der Leitlinie beschäftigt sich erstmals mit Aspekten in der Behandlung von geriatrischen Patienten. Im Fokus steht hierbei im Speziellen die für diese Patienten typische Multimorbidität, welche sich durch folgende Merkmale auszeichnet: Immobilität, Sturzneigung und Schwindel, kognitive Defizite wie Demenz, Inkontinenz, Dekubitalulcera, Fehl- und Mangelernährung, Störungen im Flüssigkeits- und Elektrolythaushalt, Depression und Angststörungen, chronische Schmerzsyndrome, Sensibilitätsstörungen, Seh- und Hörbehinderungen, Medikationsprobleme. Daher ist gerade bei geriatrischen Patienten mit einer CLTI die Frage einer Revaskularisation individuell zu beantworten, wobei eine patientenzentrierte Festlegung realistischer Therapieziele maßgeblich ist. Hierzu haben folgende Empfehlungen Einzug gehalten:
Das Tasten der Fußpulse soll bei geriatrischen Patientinnen und Patienten im Rahmen der Gesundheitsuntersuchung auch ohne Symptome der pAVK-Bestandteil der körperlichen Untersuchung sein, um das Gefährdungspotential vor allem für pedale Druckläsionen zu erkennen. Bei nicht tastbaren Fußpulsen sollte bei Risikopatientinnen und -patienten eine nicht-invasive weitere Abklärung der arteriellen Perfusion erfolgen. (Konsensempfehlung)
Bei geriatrischen Patienten mit CLTI soll überprüft werden, ob ein Frailty- Syndrom vorliegt. Ist dies der Fall, soll die Indikation revaskularisierender Maßnahmen restriktiv gestellt werden unter Berücksichtigung der zu erwartenden Invasivität des Eingriffs und im Einklang mit dem primären Therapieziel einer Beschwerdelinderung. (Konsensempfehlung)

Abb. 2: Epidemiologischer Hintergrund der pAVK
Bei geriatrischen Patienten mit pAVK sollten nach Hospitalisierung oder invasiven Eingriffen die Voraussetzungen für eine indikationsübergreifende geriatrische (Früh) Rehabilitation geprüft werden. (Konsensempfehlung)
Zusammenfassung
Die vorliegende Leitlinie zur Diagnostik, Therapie und Nachsorge der pAVK stellt einen interdisziplinären Konsens dar, der sich mit den zahlreichen Facetten und Herausforderungen des oftmals kritisch kranken Patientenguts beschäftigt. Die aktuell vorhandene Evidenz wird kritisch bewertet und versucht, dies in praktisch relevante Handlungsempfehlungen für den Alltag zu übersetzen. Nicht zuletzt auch aufgrund demographischer Entwicklungen wird die Häufigkeit arteriosklerotisch bedingter Erkrankungen jedoch auch zukünftig weiter zunehmen und die zu behandelnden Patientinnen und Patienten aufgrund ihrer Multimorbidität insgesamt „komplexer“, sodass die vorliegende Leitlinie nur den aktuellen Status optimaler Handlungsempfehlungen darstellen kann. Ob und wenn ja, wie neue technische Entwicklungen, wie z. B. medikamentöse und minimalinvasive Therapien sowie therapieunterstützende Maßnahmen, wie z. B. der Einsatz von KI und „Wearables“ zur individuellen Überwachung und Steuerung gesundheitsbezogener Maßnahmen diese Handlungsempfehlungen zukünftig beeinflussen werden, bleibt abzuwarten. Gleichwohl – eine ganzheitliche, optimierte und stadiengerechte der pAVK ist und bleibt eine interdisziplinäre Aufgabe, die es weiterhin gemeinsam interdisziplinär zu bewältigen gilt!
LITERATUR
[1] Fowkes, F.G., et al., Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Lancet, 2013. 382(9901): p. 1329-40.
[2] Diehm, C., et al., High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients: cross-sectional study. Atherosclerosis, 2004. 172(1): p. 95-105.
[3] Song, P., et al., Global, regional, and national prevalence and risk factors for peripheral artery disease in 2015: an updated systematic review and analysis. Lancet Glob Health, 2019. 7(8): p. e1020-e1030.
[4] S3-LEITLINIE ZUR DIAGNOSTIK, THERAPIE UND NACHSORGE DER PERIPHEREN ARTERIELLEN VERSCHLUSSKRANKHEIT. 2024, Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF).
[5] Sogaard, M., et al., Epidemiological Trends and Projections of Incidence, Prevalence, and Disease Related Mortality Associated With Peripheral Arterial Disease: Observations Using Nationwide Danish Data. Eur J Vasc Endovasc Surg, 2023. 66(5): p. 662-669.
[6] Nordanstig, J., et al., Editor‘s Choice — European Society for Vascular Surgery (ESVS) 2024 Clinical Practice Guidelines on the Management of Asymptomatic Lower Limb Peripheral Arterial Disease and Intermittent Claudication. Eur J Vasc Endovasc Surg, 2024. 67(1): p. 9-96.
[7] Li, Y., et al., A prospective survey study on the education and awareness about walking exercise amongst inpatients with symptomatic peripheral arterial disease in Germany. Vasa, 2023. 52(4): p. 218-223.
[8] Bonaca, M.P., et al., Rivaroxaban in Peripheral Artery Disease after Revascularization. N Engl J Med, 2020. 382(21):
p. 1994-2004.
[9] Committee, C.S., A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet, 1996. 348(9038): p. 1329-39.
[10] Debus, E.S., et al., Effect of Rivaroxaban and Aspirin in Patients With Peripheral Artery Disease Undergoing Surgical Revascularization: Insights From the VOYAGER PAD Trial. Circulation, 2021. 144(14): p. 1104-1116.
[11] Behrendt, C.A., et al., The OAC(3)-PAD Risk Score Predicts Major Bleeding Events one Year after Hospitalisation for Peripheral Artery Disease. Eur J Vasc Endovasc Surg, 2022. 63(3): p. 503-510.
[12] Farber, A., et al., Surgery or Endovascular Therapy for Chronic Limb-Threatening Ischemia. N Engl J Med, 2022. 387(25): p. 2305-2316.
[13] Bradbury, A.W., et al., A vein bypass first versus a best endovascular treatment first revascularisation strategy for patients with chronic limb threatening ischaemia who required an infra-popliteal, with or without an additional more proximal infra-inguinal revascularisation procedure to restore limb perfusion (BASIL-2): an open-label, randomised, multicentre, phase 3 trial. Lancet, 2023. 401(10390): p. 1798-1809.

Korrespondierender Autor:
PD Dr. med. Ulrich Rother
Gefäßchirurgische Abteilung
Universitätsklinikum Erlangen
Friedrich-Alexander Universität Erlangen-Nürnberg
PD Dr. med. Nasser Malyar
Sektion Angiologie, Klinik für Kardiologie I, Universitätsklinikum Münster
Dr. med. Hartmut Görtz
Fachbereich Kardiologie und Gefäßmedizin
Fachklinik Bad Bentheim
Prof. Dr. med. Markus Steinbauer
Klinik für Gefäßchirurgie
Barmherzige Brüder Regensburg
Prof. Dr. med. Andreas Maier-Hasselmann
Klinik für Gefäßchirurgie
Klinik Bogenhausen, München
Dr. med. Hinrich Böhner
Klinik für Chirurgie
St. Rochus-Hospital in Castrop-Rauxel
Prof. Dr. med. Tomislav Stojanovic
Klinik für vaskuläre und endovaskuläre Gefäßchirurgie
Klinikum Wolfsburg
Prof. Dr. med. Mathias Wilhelmi
Klinik für Gefäßchirurgie
St. Bernward Krankenhaus Hildesheim
PD Dr. med. Christian-Alexander Behrendt
Abteilung für Allgemeine und Endovaskuläre Gefäßchirurgie
Asklepios Klinik Wandsbek
Asklepios Medical School Hamburg
Chirurgie
Rother U, Malyar N, Grözinger G, Görtz H, Steinbauer M, Maier-Hasselmann A, Böhner H, Stojanovic T, Wilhelmi M, Behrendt CA: CME-Artikel: Neues aus der aktualisierten S3-Leitlinie zur Diagnostik, Therapie und Nachsorge der peripheren arteriellen Verschlusskrankheit. Passion Chirurgie. 2025 März; 15(03/I): Artikel 03_07.
Mehr CME-Artikel finden Sie auf BDC|Online (www.bdc.de), Rubrik Wissen | Aus-, Weiter- und Fortbildung | CME-Artikel.
Weitere aktuelle Artikel
01.06.2025 Aus-, Weiter- & Fortbildung
CME-Artikel: Aktueller Stand der minimalinvasiven Viszeralchirurgie – Was hat bereits Einzug in den klinischen Alltag erhalten?
Die minimalinvasive Chirurgie (MIC) hat in den letzten Jahrzehnten einen revolutionären Wandel in der operativen Medizin eingeleitet. Einen bedeutenden Meilenstein stellt die Laparoskopie dar, deren Anfänge bis ins frühe 20. Jahrhundert zurückreichen.
01.12.2023 CME-Artikel
CME-Artikel: Der Thoraxmagen
Ein Thoraxmagen tritt selten auf. Daher wird die Diagnose oft erst spät gestellt und eine entsprechende Therapie eingeleitet. Am Universitätsklinikum Augsburg wurden in den letzten 20 Jahren (von 2003 bis 9/2023) insgesamt 690 Patienten mit Thorax- bzw. Upside-down-Magen operiert. Basierend auf der aktuellen Literatur sowie eigenen Erfahrungen und Publikationen [1–3] ist dies ein Überblick zu Diagnostik, Operationsindikation und OP-Technik.
01.05.2023 CME-Artikel
CME-Artikel: Rückenschmerzen – Interventionelle Schmerztherapie
Erweitern Sie Ihre CME-Punkte, indem Sie nach dem Lesen des Artikels die Fragen dazu auf der eAkademie des BDC beantworten! Der Artikel „Rückenschmerzen – interventionelle Schmerztherapie“ ist für BDC-Mitglieder drei Monate kostenlos in ihr Konto gebucht! Loggen Sie sich auf www.bdc-eakademie.de ein: Einfach starten!
01.09.2022 CME-Artikel
CME-Artikel: Subtrochantäre Femurfrakturen: eine operative Herausforderung?
Subtrochantäre Femurfrakturen gehören zu den hüftgelenknahen Frakturen und liegen definitionsgemäß in einem Bereich von bis zu fünf Zentimeter unterhalb des Trochanter minor. Die operative Behandlung subtrochantärer Femurfrakturen stellt nach wie vor eine Herausforderung dar, weil dieser Frakturtyp einige Besonderheiten aufweist, welche maßgeblich auf die Anatomie und ortsständige Biomechanik zurückzuführen sind. Ziel dieses Beitrages ist es, diese Besonderheiten darzustellen und nachfolgend bei der Planung und Durchführung der operativen Behandlung berücksichtigen zu können, um Komplikationen zu vermeiden.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.