01.12.2023 CME-Artikel
CME-Artikel: Der Thoraxmagen

Überblick über Diagnostik, Operationsindikation und OP-Technik anhand eigener Erfahrungen bei 690 Operationen
Ein Thoraxmagen tritt selten auf. Daher wird die Diagnose oft erst spät gestellt und eine entsprechende Therapie eingeleitet. Am Universitätsklinikum Augsburg wurden in den letzten 20 Jahren (von 2003 bis 9/2023) insgesamt 690 Patienten mit Thorax- bzw. Upside-down-Magen operiert. Basierend auf der aktuellen Literatur sowie eigenen Erfahrungen und Publikationen [1–3] ist dies ein Überblick zu Diagnostik, Operationsindikation und OP-Technik.
|
Erweitern Sie Ihre CME-Punkte, indem Sie nach dem Lesen des Artikels die Fragen dazu auf der BDC|eAkademie beantworten! Der Artikel „Der Thoraxmagen“ ist für BDC-Mitglieder drei Monate kostenlos in ihr Konto gebucht! Loggen Sie sich auf www.bdc-eakademie.de ein: Einfach starten! |
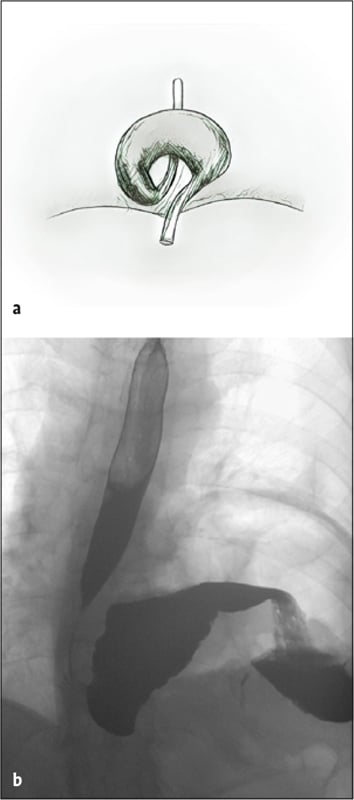
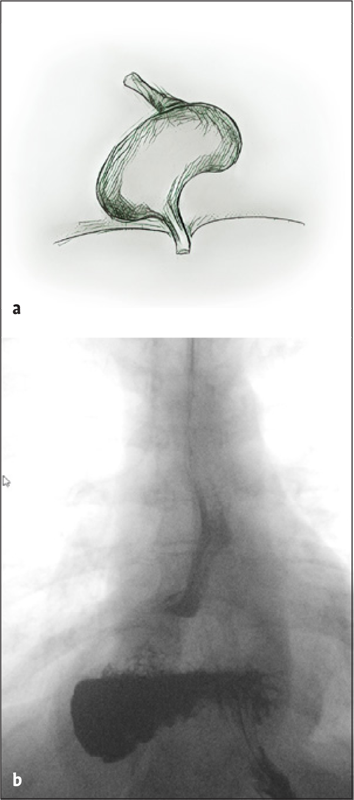
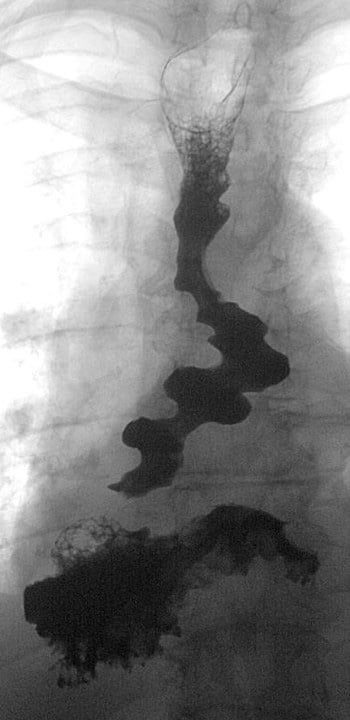
Aufgrund klinischer und therapeutischer Konsequenzen werden axiale von paraösophagealen Hiatushernien unterschieden. Erstere sind bei nahezu jedem zweiten Menschen über dem fünfzigsten Lebensjahr nachweisbar und manifestieren sich wegen eines unzureichenden Verschlusses des unteren Ösophagussphinkters häufig mit einer Refluxkrankheit. Demgegenüber ist der Anteil paraösophagealer Hernien mit einem Anteil von fünf Prozent der Hiatushernien weitaus geringer. Maximalformen paraösophagealer Hernien sind der Upside-down-Magen, bei dem sich die mobile Major-Seite des Magens um die Kardia als Fixpunkt dreht (Abb. 1) sowie der Thoraxmagen, bei dem Magen und Kardia nach mediastinal hernieren (Abb. 2) [2–4].
Den Hiatushernien liegt pathogenetisch eine Bindegewebsschwäche des ligamentären Bandapparats des gastroösophagealen Übergangs zugrunde, wodurch sich der Hiatus im Laufe der Zeit erweitert. Das physiologische abdominothorakale Druckgefälle begünstigt eine Verlagerung des Magens in den Thorax und wird durch Faktoren wie Adipositas, Schwangerschaft und Alter verstärkt. Dabei kann ein Thoraxmagen mit einem „short esophagus“ assoziiert sein, was operationstechnisch relevant ist.
|
|
|
Die klinische Symptomatik reicht von retrosternalem Druckgefühl, Herzrhythmusstörungen, postprandialem Völlegefühl, Kurzatmigkeit und Anämie bis hin zu einer lebensbedrohlichen Inkarzeration [5].
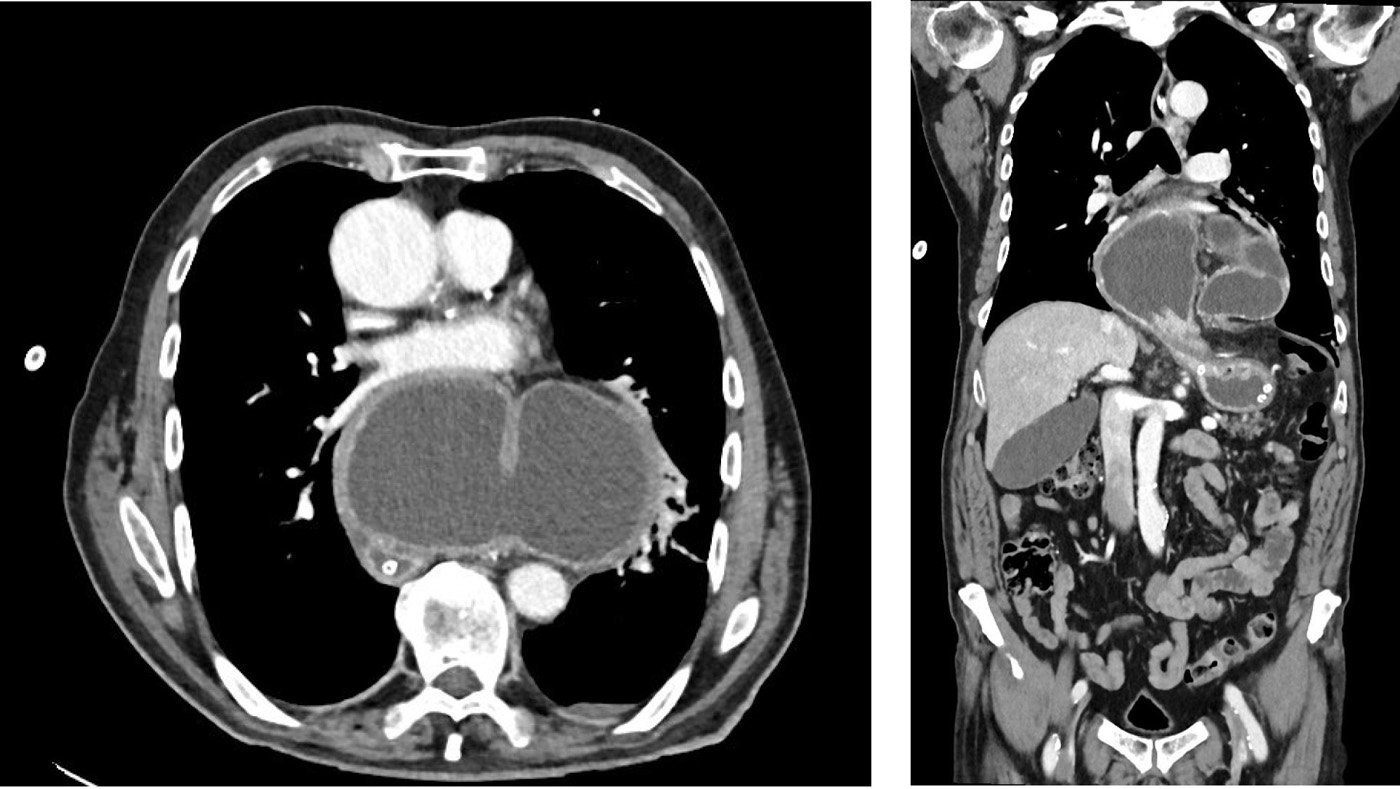
Ältere Patienten schreiben die Symptome oft dem physiologischen Alterungsprozess zu. Die Beschwerden verstärken sich postprandial durch die intrathorakale Verdrängung der Lunge und eine Kompression des linken Herzvorhofs durch den gefüllten Magen, ähnlich dem Roemheld-Syndrom (Abb. 3). Es kommt zu einer gesteigerten Herz-Vorlast, was sich auch in erhöhten BNP-Werte widerspiegeln kann [6]. Ein anfangs bestehender Reflux weicht mit zunehmendem Hernierungsgrad durch Abknicken des Magen einer Magenentleerungsstörung. Erste Symptome sind bei über 30 % der Patienten eine Eisenmangelanämie, manchmal einhergehend mit einer Synkope. Ursache hierfür können okkulte gastrointestinale Blutungen aus Cameron lesions darstellen [7], aber auch Störungen der Hämatopoese durch eine verminderte Resorption von Eisen und Vitamin B12 könnten eine Rolle spielen. Komplikationsstadien mit akuter Inkarzeration und Magenvolvulus sind selten, dann jedoch vital bedrohlich. Bei 50 unserer Patienten hernierten zusätzlich zum Magen noch Dünndarm, Dickdarm oder andere Organe, was als Enterothorax bezeichnet wird.
Diagnostik
Eine Bildgebung mit Magen-Durchleuchtung oder CT ist für die Operationsplanung hilfreich.
Die Diagnose kann oft schon anhand der typischen Symptome vermutet werden oder ergibt sich zufällig im Rahmen einer Bildgebung. Pathognomonisch ist in der Röntgenübersichtaufnahme eine retrokardiale Luftsichel mit einem Flüssigkeitsspiegel in der Magenblase. Mit einer Magendurchleuchtung (Abb. 1+2) oder einer Computertomografie (Abb. 3) kann die Diagnose gesichert werden. Während Erstere zudem Aussagen zu Magenein- und Magenabstrom des Kontrastmittels macht, klärt eine Computertomografie die Lagebeziehung von Ösophagus, Kardia, Magen und ggf. weiteren hernierten Organen. Eine Magenspiegelung ist obligat, um einen Tumor auszuschließen. Funktionsuntersuchungen wie pH-Metrie und Manometrie haben allenfalls bei kombinierten Hernien mit Refluxbeschwerden einen Stellenwert [4].
Da bei Patienten mit Thoraxmagen die Lebensqualität klinisch relevant reduziert ist, sollte diese routinemäßig im Verlauf kontrolliert werden.
Mit dem Gastrointestinalen Lebensqualitätsindex nach Eypasch kann die subjektive Lebensqualität quantifiziert und sowohl prä- als auch postoperativ mittels eines standardisierten Fragebogens erfasst werden [8].
Bei 36 Fragen sind maximal 144 Punkte möglich, wobei die Normalbevölkerung einen Durchschnittswert von 125,8 erreicht [8]. Patienten mit Thoraxmagen weisen in unserem Patientengut erniedrigte Werte zwischen 80 und 100 auf [1, 3].
Indikation
Auch ältere Patienten profitieren von der Operation des Thoraxmagens – gerade im Hinblick auf Dyspnoe [9] und Anämie [10].
Patienten mit Thoraxmagen sind in der Regel in einem fortgeschrittenen Lebensalter. Von unseren 690 Patienten waren 70 % Frauen und 30 % Männer, das Durchschnittsalter betrug 67,7 ± 12,9 Jahre. Dennoch ist selbst bei über 80-jährigen Patienten die Operation mit der Diagnosestellung indiziert, wenn keine Multimorbidität vorliegt. Außer einer Verlängerung der Liegezeit um 1,6 Tage konnten wir beim Outcome keinen Unterschied zwischen Patienten über und unter dem achtzigsten Lebensjahr feststellen [1]. Auch beschwerdearmen Patienten sollte die Operation empfohlen werden, da etwa ein Drittel der Patienten mit Thoraxmagen ein kompliziertes Stadium mit Anämie oder Passagestörungen bis hin zur Inkarzeration entwickeln können. Stark adipösen Patienten (BMI ≥ 40) ist ein primär bariatrischer Eingriff (Hiatoplastik plus Roux-en-y-Magenbypass) anzuraten, da bei diesen die alleinige Versorgung der Hiatushernie häufig zu einem Rezidiv führt und dann einen späteren bariatrischen Eingriff erschwert.
Operation
Über 90 % der Operationen können minimalinvasiv in laparoskopischer oder robotischer Technik vorgenommen werden.
Analog zur allgemeinen Hernienchirurgie besteht das Operationsziel in einer dauerhaften Reposition des Thoraxmagens durch eine sichere Einengung der Bruchlücke am Hiatus. Abdominelle Zugangswege haben sich gegenüber thorakalen durchgesetzt, da sie eine bessere Reposition, Hiatoplastik und intraabdominelle Magenfixation gestatten und mit einer deutlich geringeren Morbidität und Letalität einhergehen.
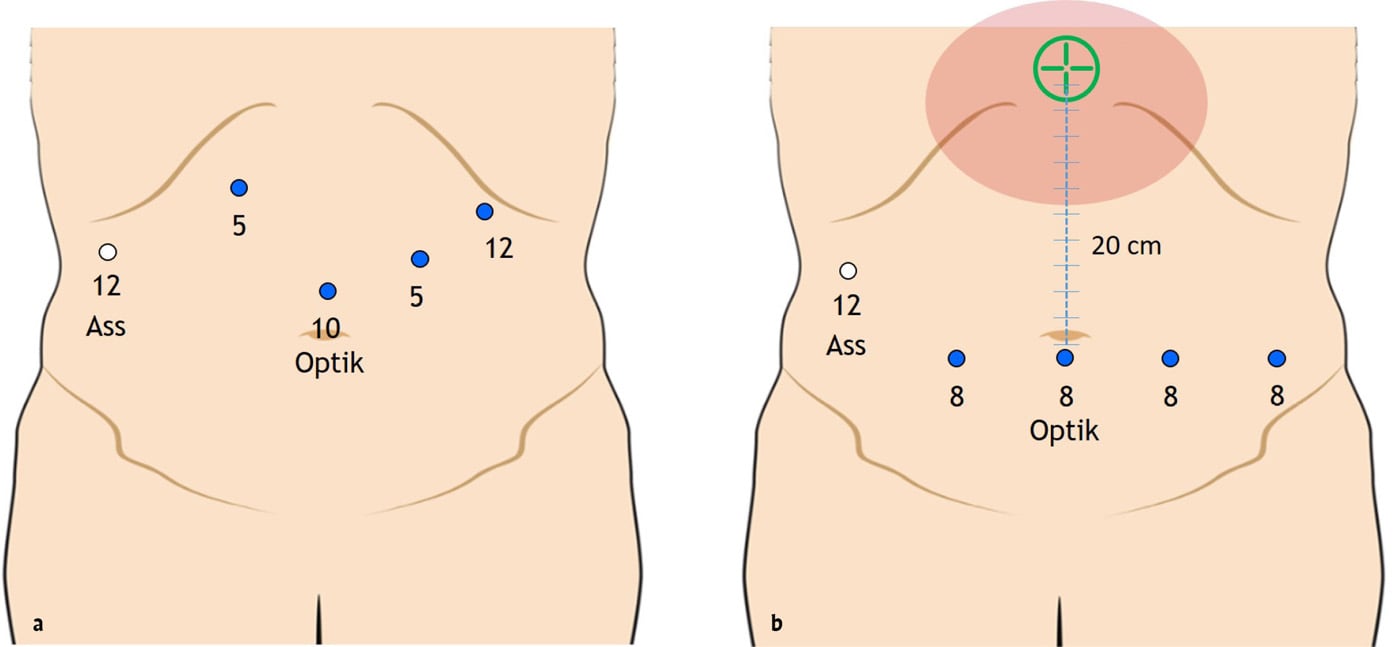
Unkomplizierte paraösophageale Hernien können elektiv laparoskopisch in Beach-chair-Lagerung oder robotisch in Rückenlage operiert werden. Beim laparoskopischen Zugang steht der Operateur zwischen den Beinen des Patienten, wodurch sich ein optimaler Arbeitswinkel zum Hiatus ösophagei ergibt. Fünf Trokare mit einem Durchmesser von 5 bis 12 mm werden im Oberbauch platziert (Abb. 4a). Durch Anheben des linken Leberlappens mit einem Retraktor wird der Hiatus exponiert. Die robotische Chirurgie gewinnt zunehmend an Bedeutung. Vorteile sind insbesondere ein optimales ruhiges 3D/HD-Bild in zehnfacher Vergrößerung, intuitive Bewegungen mit hohem Freiheitsgrad insbesondere beim Nähen, eine präzise Präparation und autarkes Operieren [11]. Als Zugangswege dienen vier 8-mm-Trokare auf einer Linie in bzw. unter der Nabelhöhe (Abb. 4b). Operationen, die voraussichtlich eine Resektion des gastroösophagealen Übergangs oder Magens erforderlich machen, erfolgen am besten über eine quere Oberbauchlaparotomie in Rückenlage.
Die Operation beinhaltet folgende fünf operative Knotenpunkte:
- Reposition des Bruchinhalts
- Präparation und Resektion des Bruchsacks
- Mobilisieren des Ösophagus ggf. mit Verlängerungsplastik
- Hiatoplastik
- Fixation des Magens
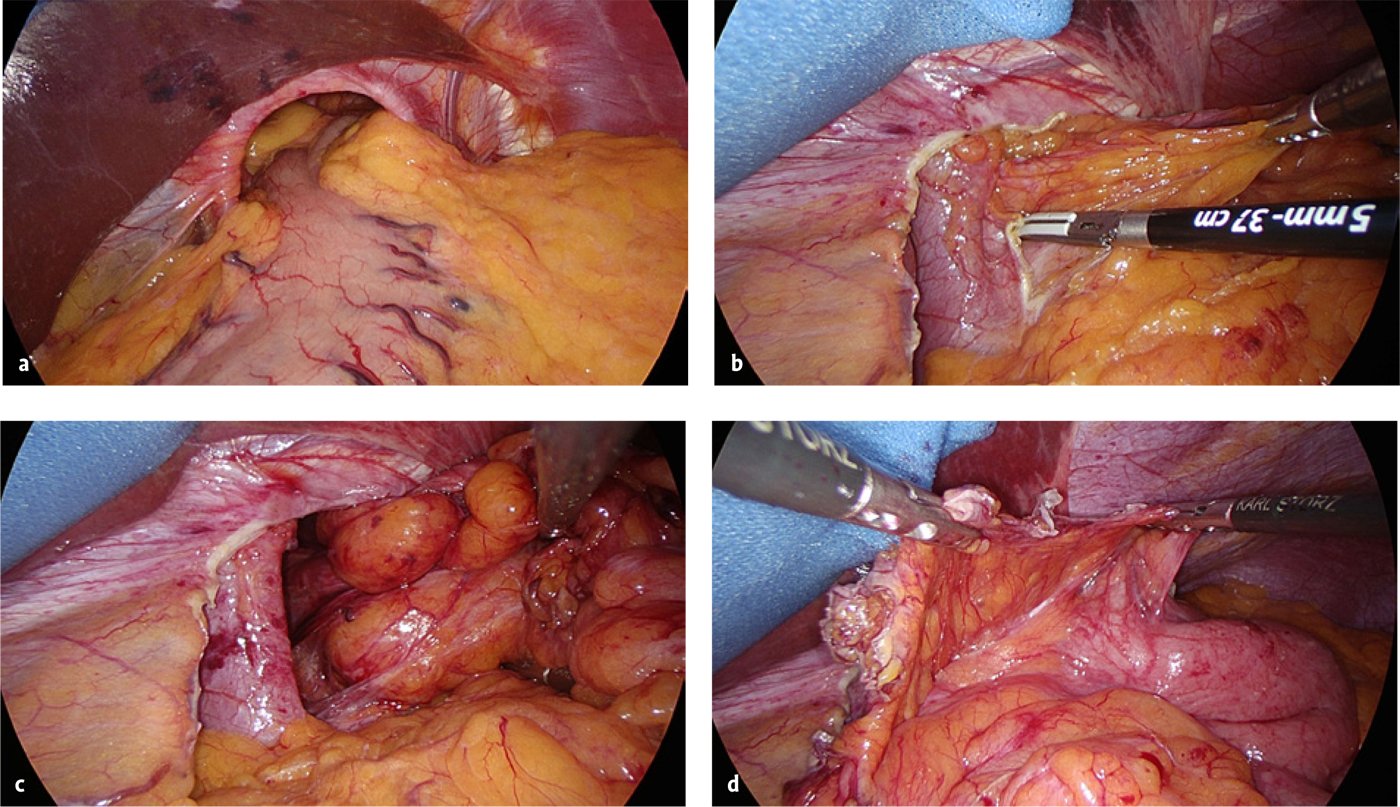
Die Reposition des Bruchinhalts gelingt meist unproblematisch, da selbst bei großen Hernien (Abb. 5a) und ausgedehnter Hernierung – bis hin zum Enterothorax – Bruchsack und Bruchinhalt beim Ersteingriff nicht miteinander verklebt sind. Ein guter Einstieg in die avaskuläre Präparationsschicht findet sich am rechten Zwerchfellschenkel nach Durchtrennung des Peritoneums (Abb. 5b). Das Absetzen kranialer Vasa gastricae breves ermöglicht einen einfachen Zugang zum linken Zwerchfellschenkel. Bei der Präparation und Gefäßversiegelung haben sich Dissektionsgeräte auf bipolarer Strombasis oder Ultraschall-Scheren bewährt, die auch robotisch zur Verfügung stehen. Im Anschluss an die Präparation des Bruchsacks müssen retroösophageale Lipome (Abb. 5c) und der Bruchsack selbst (Abb. 5d) reseziert werden, da ein Belassen als Schrittmacher für ein Rezidiv fungieren kann [5].
Ein verkürzter Ösophagus stellt den wichtigsten Risikofaktor für die Entstehung eines Hernienrezidivs dar.
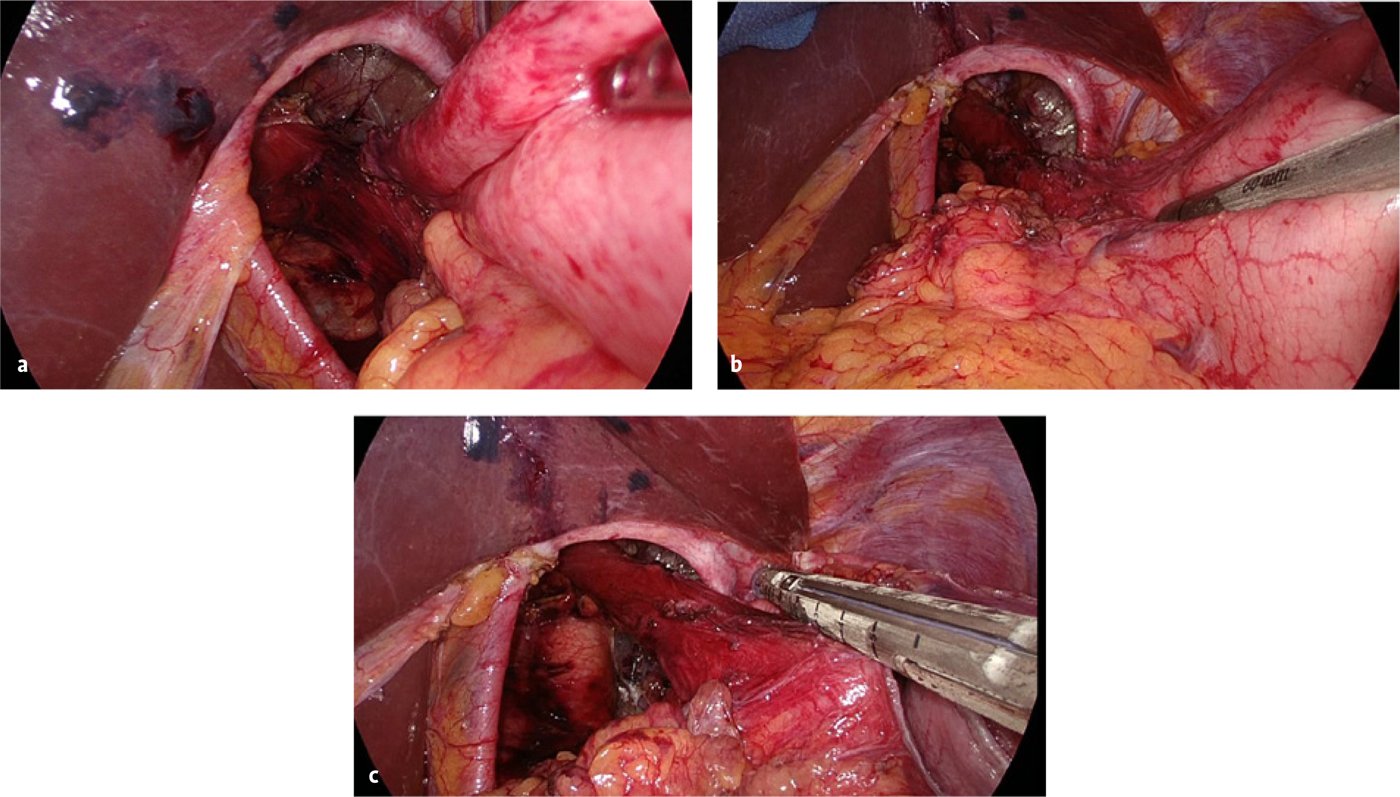
Bei lange bestehender Hernierung kann sich der Muskelschlauch des Ösophagus verkürzen (sog. „Short Esophagus“) [12]. Die Häufigkeit wird uneinheitlich mit null bis 60 % beim Thoraxmagen angegeben [12]. Durch einen „Short Esophagus“ wird die Gefahr eines Hernienrezidivs nachweislich erhöht. Durch eine mediastinale Mobilisierung der Speiseröhre über 6 bis 8 cm und komplettes Herauspräparieren des Bruchsacks (Abb. 5d) gelingt es meist, den gastroösophagealen Übergang dennoch nach abdominal zu positionieren [12, 13]. Verbleibt trotz dieses Vorgehens der gastroösophageale Übergang oberhalb des Hiatus (Abb. 6a), kann eine Verlängerungsplastik der Speiseröhre nach Collis-Nissen Abhilfe schaffen [13–15]. Dabei wird der proximale Fundus mit einem Stapler (ca. drei bis vier Magazine à 60 mm) parallel zum distalen Ösophagus reseziert, der mit einem 12 bis 14 mm dicken Magenschlauch kalibriert ist (Abb. 6b und c). Unsere Erfahrungen mit 53 Collis-Nissen-Gastroplastiken in den letzten fünf Jahren waren hier durchweg positiv: Es zeigten sich bislang weder Leckagen noch Früh- oder Spätrezidive. Auch langfristig war in Studien die Dysphagie- und Rezidivrate gering [16].
Der hintere Nervus vagus wird dargestellt und bestmöglich geschont, da ca. 10 % der unbeabsichtigt vagotomierten Patienten ein Postvagotomiesyndrom mit Magenentleerungsstörungen oder Diarrhöen entwickeln. In diesen Fällen können Botox-Injektionen in den Pylorus (ggf. gefolgt von einer gastralen peroralen endoskopischen Pyloromyotomie) den Magenabfluss verbessern.
Ein alloplastischer Bruchlückenverschluss des Hiatus kann das Rezidiv-Hernierungsrisiko senken.
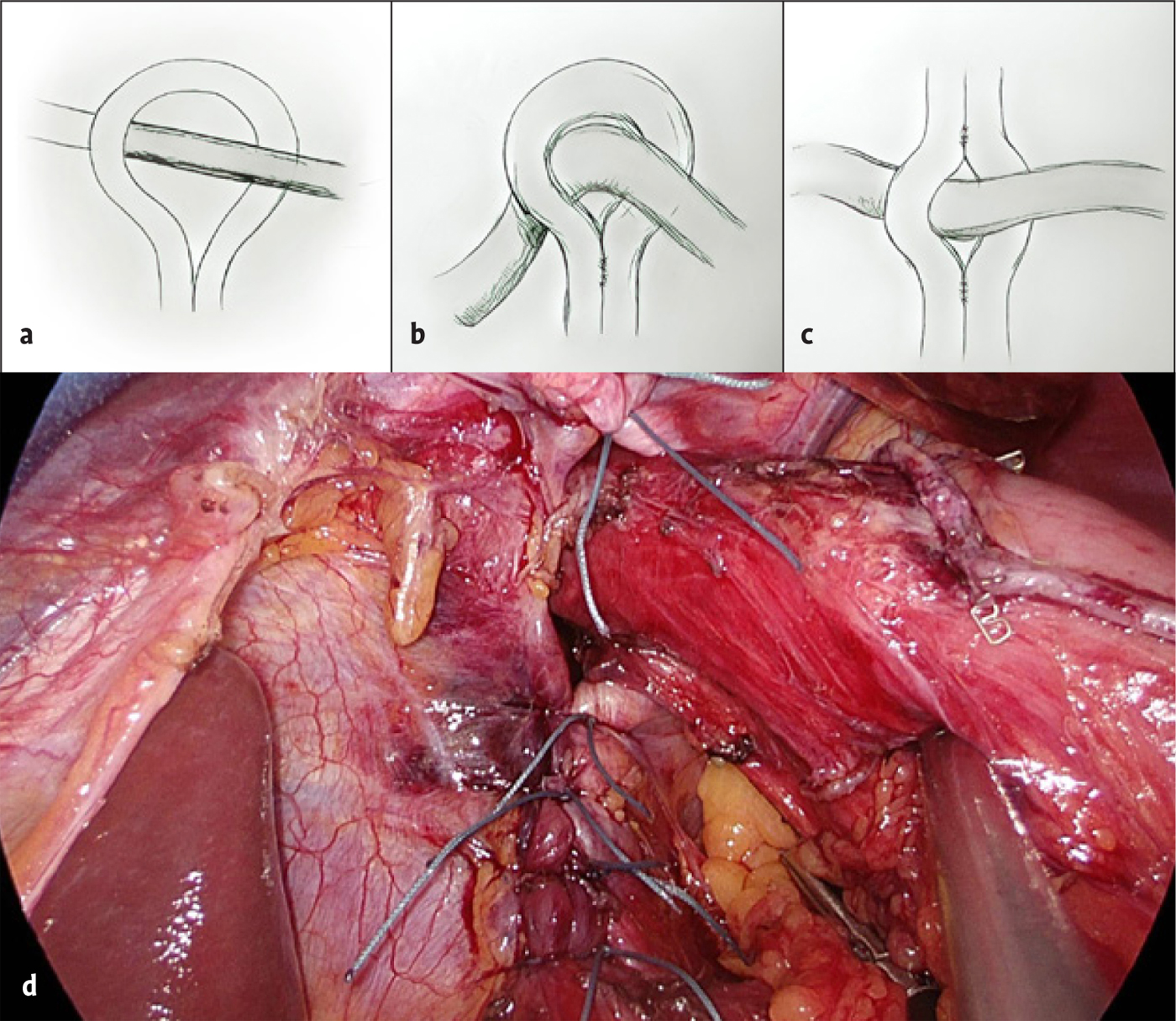
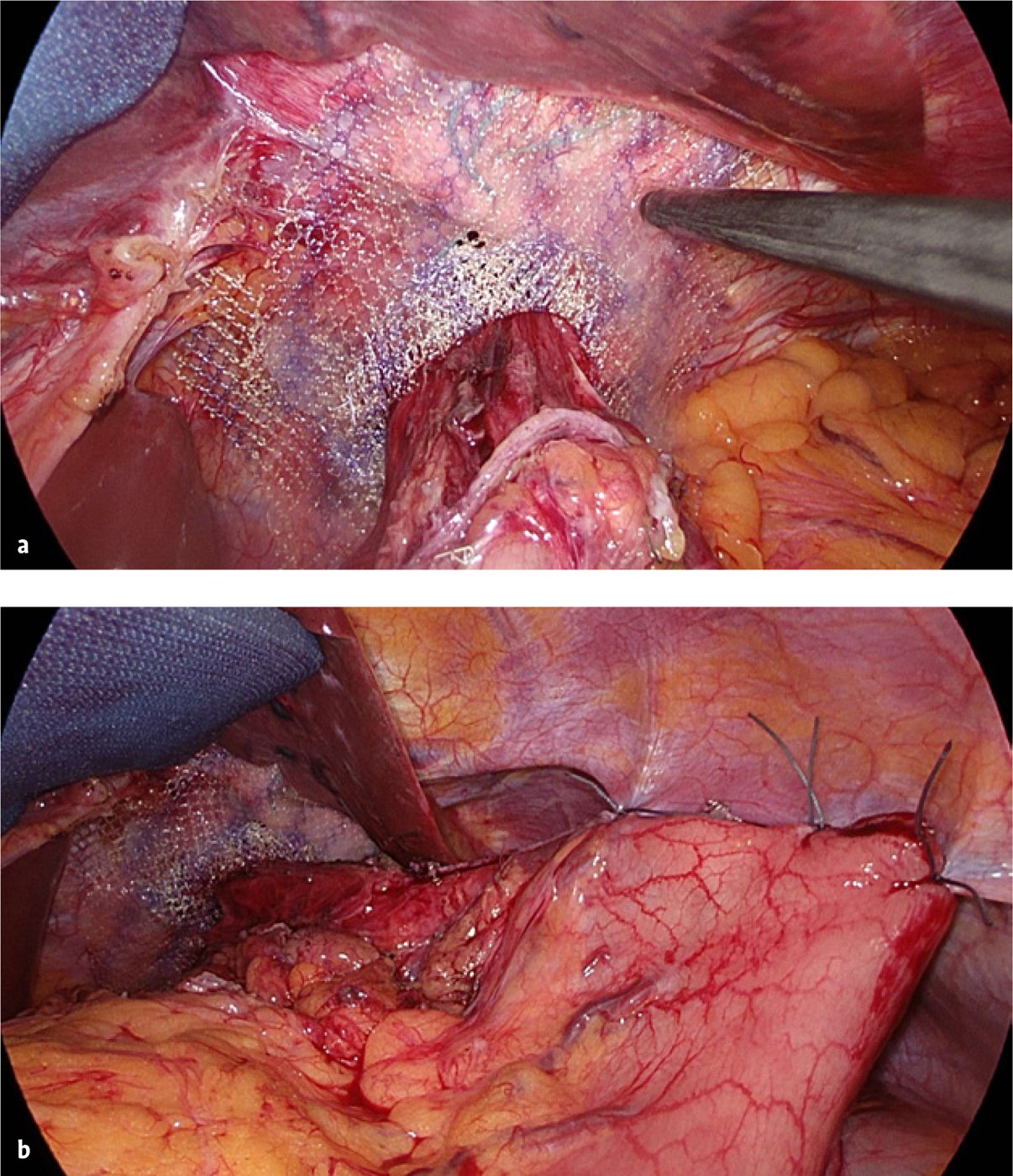
Dorsal des Ösophagus wird die Zwerchfelllücke als hintere Hiatoplastik mit nicht resorbierbaren Fäden unter Kalibrierung der Speiseröhre mit einem 12 bis 14 mm dicken Magenschlauch reduziert. Dabei empfiehlt es sich, den peritonealen Überzug auf den Zwerchfellschenkeln als Nahtlager zu erhalten. Um eine zu starke Angulierung des Ösophagus nach ventral zu vermeiden, sollte bei sehr großen Hernien neben der hinteren auch eine vordere Hiatoplastik erfolgen (Abb. 7a–d). Kontrovers und oftmals emotional diskutiert wird der Einsatz von Kunststoffnetzen bei der Hiatoplastik, wobei bei einer Umfrage 67 % von 503 befragten europäischen Chirurginnen und Chirurgen hier prinzipiell Netze einsetzen [17]. Die alloplastische Bruchlückenversorgung konnte das Rezidivrisiko signifikant von 15 % auf 2,6 % reduzieren [18]. Jedoch wurden Komplikationen im Zusammenhang mit implantierten Kunststoffnetzen am Hiatus beschrieben, wie Stenosen, Fibrosen und der Penetration von Netzen nach intraluminal [19, 20]. Allerdings stammen die beschriebenen Komplikationen größtenteils aus einer Zeit, in der schwergewichtige und scharfkantige Polypropylen- oder PTFE-Netze eingesetzt wurden, die zur Schrumpfung und Migration neigten. Aktuelle leichtgewichtige, grobmaschige Netze können auch an der mobilen Region des Hiatus ösophagei risikoarm implantiert werden (Abb. 8a) [21]. Empfehlenswert ist, dass bei Implantation eines nicht resorbierbaren Netzes Anteile des aus dem Mediastinum nach intraabdominell verlagerten Bruchsacks, so technisch möglich, zwischen dem Ösophagus und dem Netz platziert und fixiert werden. Bei einer eigenen Untersuchung bestand die Indikation zu einem alloplastischen Bruchlückenverschluss bei Hiatushernien mit einer Größe über 8 cm, schwachen Zwerchfellschenkeln und Rezidivhernien [1]. Knapp die Hälfte der Patienten erfüllten diese Kriterien, wodurch die klinische Rezidivrate in 6.281 Anwendungsmonaten ohne netzbedingte Komplikationen von 7,4 auf 1,4 % reduziert werden konnte [1]. Obsolet ist das Fixieren des Netzes ventral am Hiatus mit Tackern, da durch das dünne Zwerchfell der Herzbeutel oder Koronararterien verletzt werden können [22]. Man sollte die Patienten darüber informieren, dass laut größeren Nachuntersuchungen ein radiologisches Rezidiv auch trotz Netzverstärkung auftreten kann [21, 23]. Resorbierbare Netze schnitten hier in einer Metaanalyse etwas schlechter ab als nicht resorbierbare Netze (17,1 % vs. 12,6 %) [17], haben aber den potenziellen Vorteil, dass bei Re-Operationen weniger Verwachsungen zu erwarten sind.
Der Magen wird intraabdominal mit einer ventralen oder dorsalen Hemifundoplikatio und/oder einer Gastropexie fixiert.
Für die abdominelle Fixierung des Magens stehen verschiedene Optionen zur Verfügung. Ein sehr effektiver Hiatusverschluss kann durch eine ventrale Hemifundoplikatio nach Dor mit zusätzlicher Gastropexie am linken Zwerchfell mittels nicht resorbierbarer Nähte erzielt werden. Bei Reflux-Anamnese ist auch eine dorsale 270° Fundoplikatio nach Toupet geeignet. Bei kleinem Magenfundus ist oft auch das alleinige Wiederherstellen des Hiss‘schen Winkels mit einer langstreckigen Gastropexie ausreichend. Insbesondere nach einer Collis-Nissen-Plastik bieten hier die Klammernähte am Magen ein sehr stabiles Nahtlager (Abb. 8b). Da paraösophageale Hernien nicht selten mit Motilitätsstörungen von Ösophagus und Magen einhergehen (Abb. 9), kann eine 360°-Nissen-Manschette bereits zu einer Dysphagie führen [24], zumal wenn die Manschette im Verlauf hernieren sollte. Eine Revision ist dann meist unvermeidlich, weswegen wir die Indikation zur Nissen-Manschette eher zurückhaltend stellen. Die amerikanische Leitlinie der SAGES gibt für eine Gastropexie eine starke und für eine Fundoplikatio lediglich eine schwache Empfehlung ab [5].
Ergebnisse
Morbidität und Letalität für elektive laparoskopische Eingriffe sind sehr gering.
Für die Beurteilung des operativen Erfolgs sind die entscheidenden kurzfristigen Parameter die postoperative Morbidität und Letalität sowie langfristig das klinische Ergebnis und die Rezidivrate. Intraoperative Komplikationen können eine Eröffnung von Ösophagus oder Magen sein. Falls dies sofort erkannt wird, ist eine Übernähung in der Regel problem- und folgenlos möglich, gegebenenfalls mit Deckung des Defekts mit Magenfundus oder einer Manschette. Unerkannt können diese Verletzungen allerdings lebensbedrohlich sein. Da die Wahrscheinlichkeit für derartige Verletzungen vor allem bei Rezidiv-Operationen erhöht ist, kann zur Klärung schwieriger anatomischer Gegebenheiten eine intraoperative Gastroskopie hilfreich sein. Blutungen aus dem Milzparenchym sind selten und können in der Regel minimalinvasiv gestillt werden. Bei der Dissektion eines großen Bruchsacks im Mediastinum kann es zu einer Eröffnung der Pleura kommen, was sich meist in einem erhöhten Beatmungsdruck teils mit begleitendem Hautemphysem manifestiert. Durch Druckminderung des Pneumoperitoneums ist die Anlage einer Thoraxdrainage jedoch nur ausnahmsweise erforderlich, zumal CO2 sehr gut absorbiert wird.
Die stationäre Verweildauer beträgt für elektive minimalinvasive Eingriffe zwei bis vier Tage, während sie für offene Operationen im komplizierten Stadium auf 25 Tage ansteigt [1].
Die Letalität laparoskopischer Hiatuseingriffe wird mit 1,4 % angegeben im Gegensatz zu 3 % bei offenen Operationen [1]. Bei uns sind in 20 Jahren von 690 Patienten einschließlich aller Notfälle und Re-Operationen vier Patienten verstorben, was 0,3 % nach laparoskopischen bzw. 2,5 % nach offenen Operationen entspricht.
Die Operation verbessert klinisch relevant und statistisch signifikant die Lebensqualität.
In zahlreichen Publikationen wurde eine signifikante Verbesserung von Brustschmerz, Regurgitation, Dyspnoe, Anämie und Lebensqualität durch die operative Korrektur der Hiatushernie belegt [3]. Mit dem gastrointestinalen Lebensqualitätsindex nach Eypasch lässt sich das klinische Befinden quantifizieren [8]. In eigenen Untersuchungen stieg der mittlere Wert von präoperativ 89 auf postoperativ 111 signifikant an und blieb im Langzeitverlauf bei 106 [1, 3]. Interessanterweise besserten sich dabei in einer Untergruppenanalyse nicht nur rein physische, sondern auch emotionale Symptome wie Trauer, Angst oder Frustration [3]. Bei Patienten mit klinisch manifestem Rezidiv verschlechterte sich der Index wieder auf den Ausgangswert vor der Operation. Die Messung der Lebensqualität stellt somit einen einfachen, kostengünstigen und validen Verlaufsparameter dar.
Mit einer postoperativen Magendurchleuchtung können Frührezidive rechtzeitig erkannt und behandelt werden.
Der wichtigste langfristige Parameter zur Beurteilung des Operationserfolgs ist die Rezidivrate. Zeitlich kann man Früh- und Spätrezidive unterscheiden. Klinisch finden sich asymptomatische und symptomatische Rezidive. Bereits bei der postoperativen Durchleuchtung, die an unserer Klinik routinemäßig innerhalb der ersten beiden postoperativen Tage durchgeführt wird, sind Frührezidive nachweisbar und vermutlich bedingt durch einen erhöhten intraabdominellen Druck, wie er z. B. beim Würgen bei der Extubation oder postoperativem Erbrechen auftreten kann [5]. Durch die enorme Kraftentfaltung beim Erbrechen können die Nähte der Hiatoplastik ausreißen. Eine Propofol-Narkose mit „sanfter“ Extubation mit PONV-Prophylaxe ist deshalb anzustreben. Bei einem Frührezidiv sind operative Revisionen innerhalb der ersten ein bis zwei Tage problemlos laparoskopisch möglich, da noch keine Verwachsungen vorliegen [1]. Hierdurch lässt sich die Rate an Spätrezidiven senken. Wir stellten bei 22 der 690 Patienten revisionspflichtige Frührezidive fest, die technisch wenig aufwendig minimalinvasiv korrigiert werden konnten.
Im langfristigen Verlauf auftretende radiologisch nachweisbare Hernienrezidive können asymptomatisch oder klinisch symptomatisch sein. Die radiologische Rezidivrate wird in der Literatur mit bis zu 42 % angegeben [25], wobei als unabhängige Risikofaktoren neben Übergewicht und Herniengröße insbesondere ein short esophagus gilt. Bei einer Metaanalyse hatten 25,5 % von 965 Patienten im Verlauf ein radiologisches Rezidiv, während von diesen nur 10,2 % symptomatisch waren [26]. In unserem Patientengut entwickelten im Zeitverlauf 4,4 % ein operationspflichtiges symptomatisches Rezidiv nach einer durchschnittlichen Latenzzeit zur Erstoperation von 814 Tagen (147-3122 Tage) [data unpublished]. Die lange Latenzzeit zeigt, dass die Entstehung von Rezidiven auch eine Funktion der Zeit ist.
Versorgung der Rezidive
Während asymptomatische Spätrezidive keiner Therapie bedürfen, sollten klinisch manifeste Rezidive in einem Zentrum mit entsprechender Erfahrung operiert werden [5].
In die Entscheidung zur Therapie eines Spätrezidives gehen Voroperation, Begleiterkrankungen, Alter, radiologischer Befund und klinische Symptomatik ein. Solange die Voroperation minimalinvasiv vorgenommen wurde, kann auch die Revision meist minimalinvasiv erfolgen.
Der Einsatz von Netzen ist bei Wiederholungsoperationen mit niedrigem Risiko möglich [5]. Eine intraoperative Gastroskopie sollte allerdings genauso verfügbar sein wie die Expertise zu OP-Erweiterungen bis hin zur Major-Resektion [4], weshalb eine entsprechende Erfahrung für Rezidiv-Operationen vorteilhaft ist. Eine Untersuchung in den USA an über 60.000 Hiatuseingriffen zeigte Vorteile beim Outcome, wenn die Operationen in High-volume-Zentren (> 20 Eingriffe/Jahr) erfolgten [27].
Zusammenfassung
Mit der Diagnosestellung eines Thorax- oder Upside-down-Magens ist in der Regel die Indikation zur Operation gegeben. Die Operation erhöht nachweislich die gastrointestinale Lebensqualität, was mit dem gastrointestinalen Lebensqualitätsindex nach Eypasch einfach und valide gemessen werden kann. Ein zuwartendes Vorgehen kann für multimorbide Patienten eine Option sein. Die minimalinvasive laparoskopische oder robotische Versorgung des Thorax- oder Upside-down-Magens ist heutzutage das Standardverfahren. Bei entsprechender Indikation und geeigneter Technik können resorbierbare oder nichtresorbierbare Kunststoffnetze am Hiatus implantiert werden, wodurch das Rezidivrisiko gesenkt werden kann. Hierzu kann ebenfalls eine Collis-Nissen-Verlängerungsplastik des Ösophagus beim short esophagus beitragen. Postoperativ empfiehlt sich eine Durchleuchtung, um Frührezidive rechtzeitig erkennen und noch im gleichen stationären Aufenthalt korrigieren zu können. Später auftretende, radiologisch nachweisbare, aber asymptomatische Rezidive können verlaufsbeobachtet werden. Klinisch manifeste Spätrezidive sollten in einem erfahrenen Zentrum operiert werden.
Die Literaturliste erhalten Sie auf Anfrage via [email protected].

Chirurgie
Geissler B, Anthuber M: CME-Artikel: Der Thoraxmagen. Passion Chirurgie. 2023 Dezember; 13(12): Artikel 03_04.
Autoren des Artikels
Dr. med. Bernd Geißler
Leitender OberarztKlinik für Allgemein-, Viszeral- und TransplantationschirurgieUniversitätsklinikum AugsburgStenglinstraße 286156Augsburg kontaktierenProf. Dr. med. Matthias Anthuber
Vorsitzender Landesverband BDC|BayernDirektor der Klinik für Allgemein-, Viszeral- und TransplantationschirurgieKlinikum AugsburgStenglinstr. 286156Augsburg kontaktierenWeitere Artikel zum Thema
01.05.2023 CME-Artikel
CME-Artikel: Rückenschmerzen – Interventionelle Schmerztherapie
Erweitern Sie Ihre CME-Punkte, indem Sie nach dem Lesen des Artikels die Fragen dazu auf der eAkademie des BDC beantworten! Der Artikel „Rückenschmerzen – interventionelle Schmerztherapie“ ist für BDC-Mitglieder drei Monate kostenlos in ihr Konto gebucht! Loggen Sie sich auf www.bdc-eakademie.de ein: Einfach starten!
01.09.2022 CME-Artikel
CME-Artikel: Subtrochantäre Femurfrakturen: eine operative Herausforderung?
Subtrochantäre Femurfrakturen gehören zu den hüftgelenknahen Frakturen und liegen definitionsgemäß in einem Bereich von bis zu fünf Zentimeter unterhalb des Trochanter minor. Die operative Behandlung subtrochantärer Femurfrakturen stellt nach wie vor eine Herausforderung dar, weil dieser Frakturtyp einige Besonderheiten aufweist, welche maßgeblich auf die Anatomie und ortsständige Biomechanik zurückzuführen sind. Ziel dieses Beitrages ist es, diese Besonderheiten darzustellen und nachfolgend bei der Planung und Durchführung der operativen Behandlung berücksichtigen zu können, um Komplikationen zu vermeiden.
29.07.2022 Wissen
International Surgical Week demnächst in Wien
Vom 15. bis zum 18. August 2022 findet in der Hofburg in Wien die International Surgical Week ISW 2022, der 49. Weltkongress der International Society of Surgery ISS/SIC, statt.
03.07.2022 Aus-, Weiter- & Fortbildung
CME-Artikel: Lipödem: Diagnostik, Therapie und Kostenübernahmen
Bis vor einigen Jahren war das Lipödem noch ein eher unbekanntes Erkrankungsbild. Dann rückte diese Erkrankung in den wissenschaftlichen aber vor allem in den medialen Fokus, insbesondere in den Sozialen Medien. Dadurch wurden nicht nur Medizinerinnen und Mediziner auf das Lipödem aufmerksam, sondern auch viele vermeintlich Betroffene.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.