01.11.2021 Herzchirurgie
Herztransplantation und mechanische Kreislaufunterstützung – der aktuelle Stand
Hintergrund
Trotz enormer Fortschritte in der medikamentösen Therapie der Herzinsuffizienz bleibt im Endstadium der Erkrankung nur die Herztransplantation oder bei nicht rechtzeitig verfügbarem Spenderorgan die permanente mechanische Kreislaufunterstützung. Die Entwicklung der permanent implantierbaren mechanischen Kreislaufunterstützung hat zu Beginn des 21. Jahrhunderts einen signifikanten Fortschritt durch die Entwicklung kleiner elektrisch betriebener Pumpen erlebt, die relativ geräuscharm einen kontinuierlichen Blutfluss erzeugen.
Permanent implantierbare Kreislaufunterstützungssysteme stellen wegen des Organmangels heutzutage eine unverzichtbare Behandlungsalternative zur Herztransplantation bei terminaler Herzinsuffizienz dar. Diese komplexe Therapie sollte möglichst an einem erfahrenen Zentrum mit aktivem Herztransplantationsprogramm erfolgen.
Herztransplantation
Im Jahr 2020 wurden 340 Herztransplantationen in 21 Kliniken durchgeführt (Abb. 1) [1].
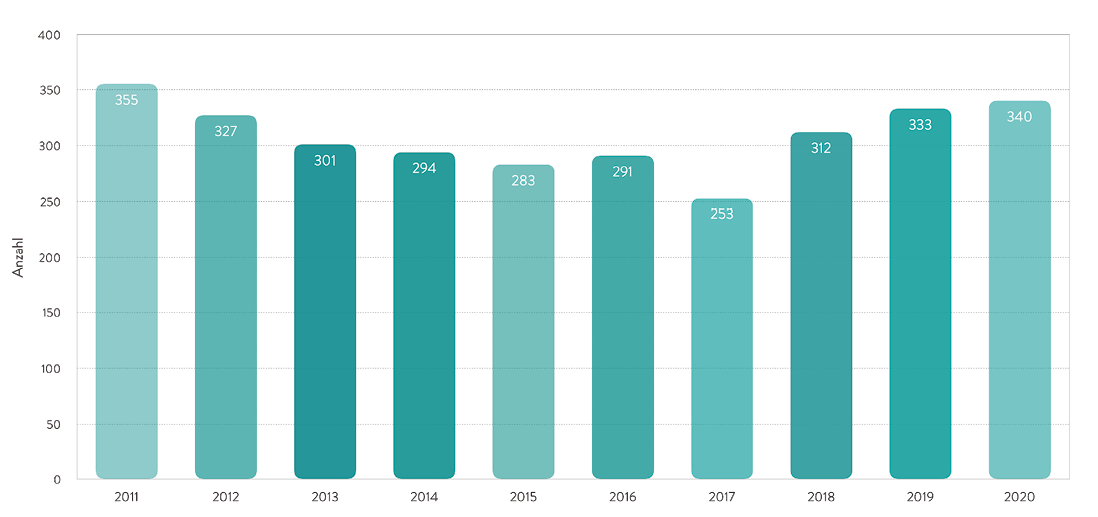
Abb. 1: Anzahl der in Deutschland durchgeführten Herztransplantationen in den Jahren 2011 bis 2020, gemäß der Leistungsstatistik der Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie (DGTHG) [1].
Die Allokation der Spenderherzen erfolgt in Deutschland durch die Eurotransplant Foundation in Leyden, Niederlande. Eine Richtlinie der Bundesärztekammer definiert dazu die Kriterien für hohe Dringlichkeit (HU – „high urgency“). Die Wartezeit auf ein Spenderorgan beträgt im HU-Status in Abhängigkeit von Blutgruppe und Körpergröße ungefähr zwei bis vier Monate. Die akzeptable Ischämiezeit für das Spenderorgan beträgt bis zu vier Stunden. Bei längerer Ischämiezeit steigt das Risiko eines primären Graftversagens exponentiell an. Daher werden derzeit Verfahren der maschinellen Perfusion von Spenderherzen evaluiert.
Die Transplantation des Spenderherzens erfolgt in orthotoper Technik via medianer Sternotomie. Die bicavale Implantationstechnik kann die Rate von postoperativen Rhythmusstörungen und Trikuspidalklappeninsuffizienzen günstig beeinflussen.
Die postoperative Immunsuppression stützt sich auf einen Calcineurininhibitor, einen Antimetaboliten und in der Frühphase nach Transplantation auf Glukokortokoid. Die Hinzunahme eines m-TOR Inhibitors kann die Reduktion des Calcineurininhibitors erlauben und somit einer Nephrotoxizität begegnen. Wesentliche früh-postoperative Komplikationen sind das primäre Graftversagen, akute Abstoßungsreaktionen und Infektionen, vor allem bei Risikotransplantionen bei Patienten mit infizierten mechanischen Kreislaufunterstützungssystemen. Den Langzeitverlauf limitieren die durch chronische Abstoßung hervorgerufene Transplantatvaskulopathie, Infektionen und Tumorerkrankungen.
Das Überleben nach Herztransplantation wird mit etwa 60 % nach zehn und 23 % nach 20 Jahren angegeben.
Mechanische Kreislaufunterstützung
Bei den permanent implantierbaren Systemen wird grundsätzlich zwischen ventrikulären Unterstützungssystemen (ventricular assist devices, VADs) und Kunstherzen unterschieden. Während bei den Kunstherzen das erkrankte Herz bis auf die Vorhofebene entfernt wird, werden VADs in die linken und/oder rechten Herzhöhlen zur Unterstützung implantiert. Je nach System wird zwischen para- und intrakorporalen Systemen mit pulsatilem oder kontinuierlichem Fluss unterschieden. Angetrieben werden die Systeme entweder durch Druckluft oder Strom, welche über ein perkutan ausgeleitetes Kabel zugeführt werden [2]. Die Zahl der pro Jahr permanent implantierten mechanischen Kreislaufunterstützungssysteme hat in den letzten Jahren leicht abgenommen (Abb. 2). Dies sind mit weit über 90 % linksventrikuläre Unterstützungssysteme.
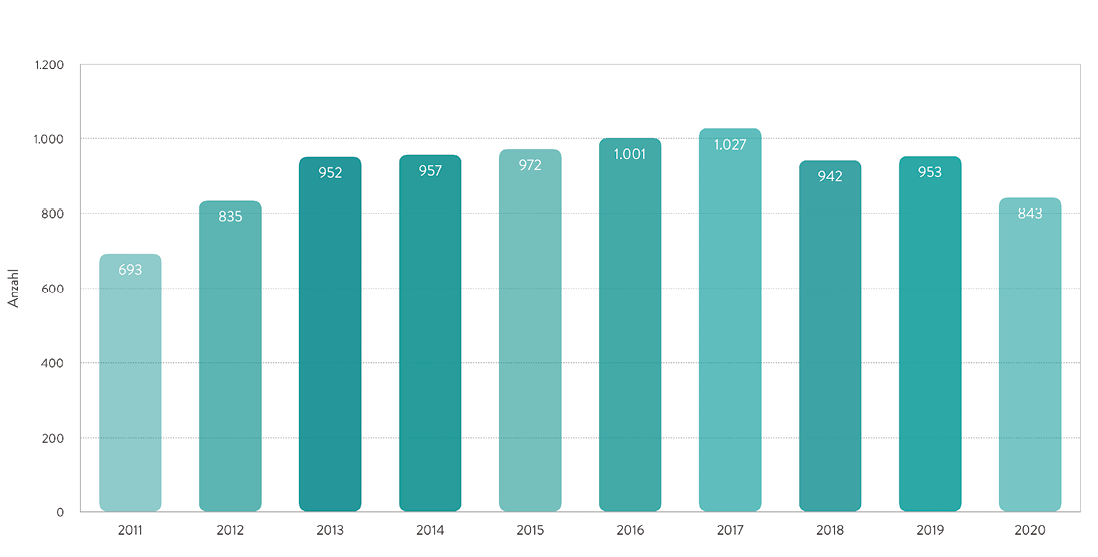
Abb. 2: Anzahl der in Deutschland permanent implantierten mechanischen Kreislaufunterstützungssysteme in den Jahren 2011 bis 2020, gemäß der Leistungsstatistik der Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie (DGTHG) [1].
Parakorporale Systeme
Das derzeit einzig verfügbare parakorporale System (Berlin Heart Excor®) kann univentriukulär links oder rechts, sowie biventrikulär eingesetzt werden (Abb. 3A). Es erzeugt pulsatilen Blutfluss und ist das einzige für den pädiatrischen Bereich und zur rechtsventrikulären Unterstützung zugelassene System.
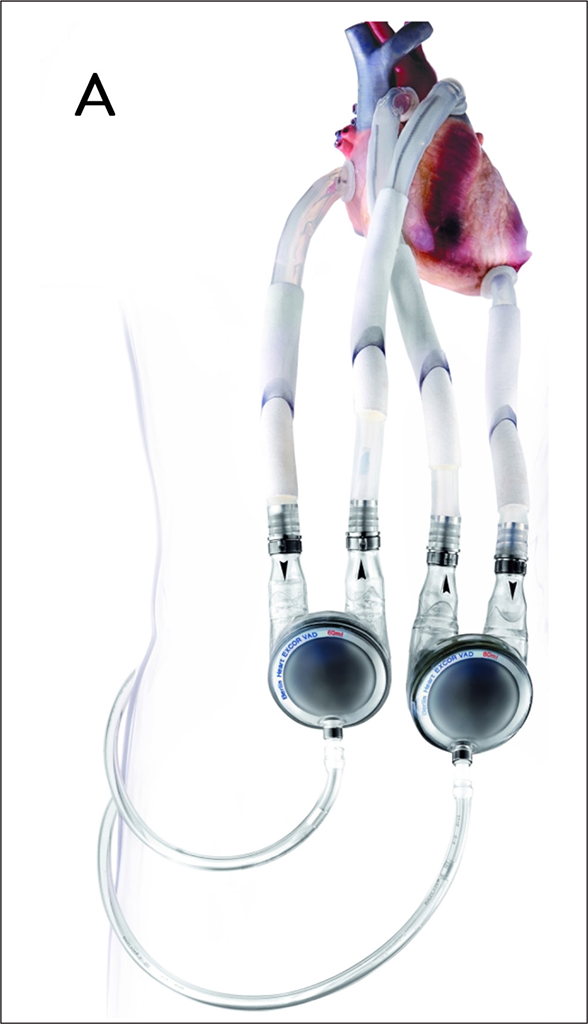
Abb. 3 A: Das Berlin Heart GmbH EXCOR® ist eine mit Druckluft angetriebene Verdrängungspumpe und generiert pulsatilen Blutfluss. Es ist für die links- und rechtsventrikuläre Unterstützung sowie für den pädiatrischen Einsatz zugelassen.
Implantierbare Unterstützungssysteme
Das Heartmate 3® der Firma Abbott ist derzeit das meistgenutzte LVAD System (Abb. 3B). Medtronic hat kürzlich das Wettbewerbsprodukt, das Heartware ventricular assist device (HVAD), wegen zu hoher Komplikationsraten vom Markt genommen. Es handelt sich um eine intraperikardial implantierbare Zentrifugalpumpe mit kontinuierlichem Blutfluss. Sie wird von einem extrakorporalen Controller über ein perkutan geführtes Kabel (Driveline) gesteuert. Das Heartmate 3 ist nur als LVAD zugelassen, funktioniert aber auch zur Unterstützung des kleinen Kreislaufs.
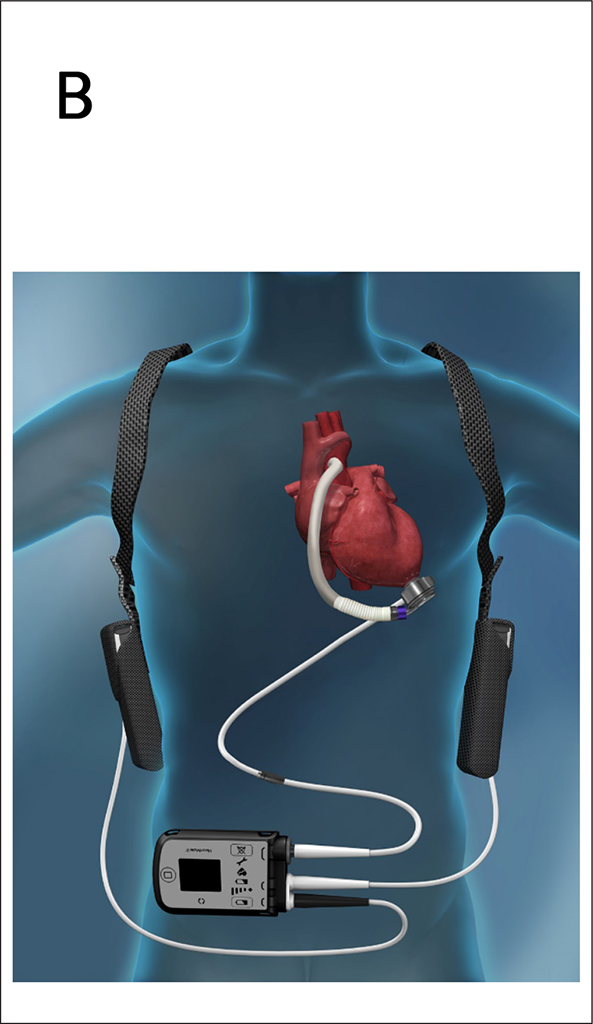
Abb. 3 B: Das Heartmate 3® ist das modernste und gängigste LVAD System mit einem vollständig magnetisch gelagerten Impeller. Die Zentrifugalpumpe generiert kontinuierlichen Blutfluss.
Kunstherzen (Total artificial heart, TAH)
Zwei Kunstherzsysteme stehen in Deutschland klinisch zur Verfügung. Bei dem schon lange eingesetzten Syncardia TAH® werden die implantierten Kunstventrikel durch Druckluft angetrieben und erzeugen einen pulsatilen Blutfluss. Mobile Kompressoren ermöglichen auch eine ambulante Betreuung der Patienten. Die Lebensqualität ist aber durch die erhebliche Lärmkulisse beeinträchtigt (Abb. 3C).
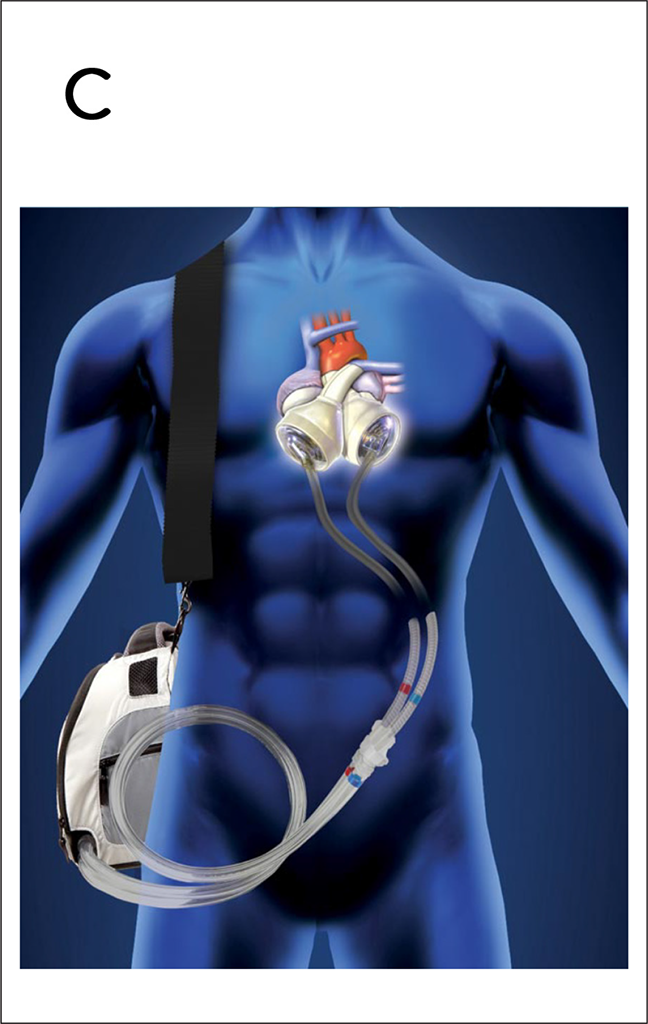
Abb. 3 C: Das Syncardia TAH® ist eine biventrikuläre, intrakorporale druckluftangetriebene Verdrängungspumpe für den Vollherzersatz. Der Blutstrom wird durch mechanische Klappenprothesen in den Kunstventrikeln geleitet.
Das Carmat TAH® (Abb. 3D) hat seit 2021 eine CE Zulassung und wurde dreimal in Deutschland implantiert (Stand 4.9.2021).
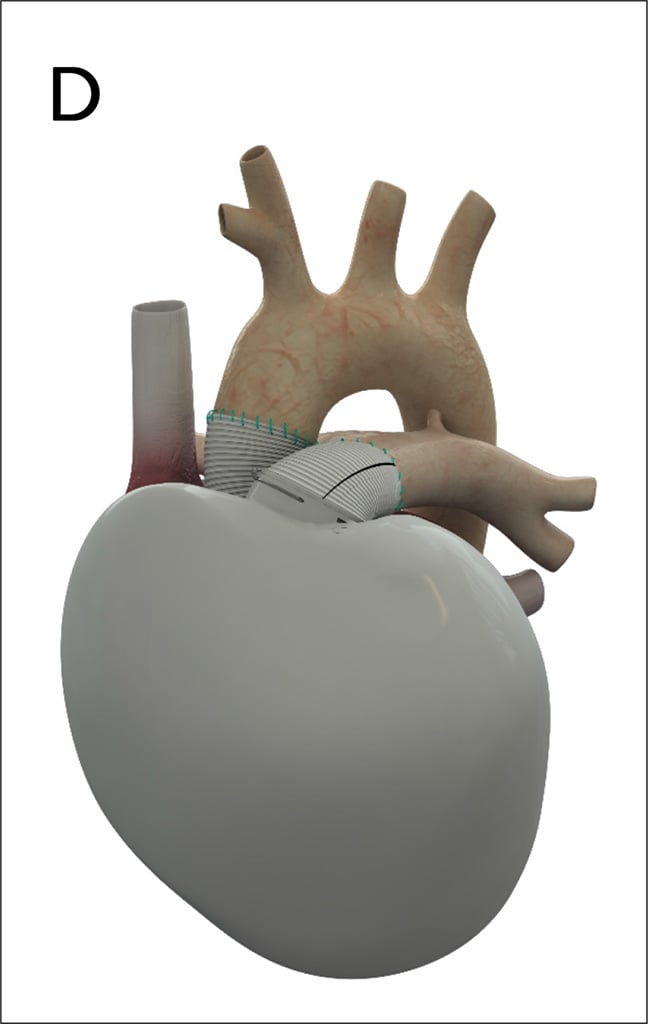
Abb. 3 D: Das Carmat TAH® ist das neueste zugelassene Kunstherzsystem. Es wird elektrisch angetrieben und kann eine Autoregulation mit verschiedenen Füllungsdrücken imitieren. Die Abbildungen wurden von den Firmen Berlin Heart GmbH in A), Abbott in B), Syncardia in C) und Carmat-SA in D) für diese Publikation freundlichst zur Verfügung gestellt.
Ein elektrischer Antrieb macht es erheblich leiser als das Syncardia TAH. Das Carmat TAH imitiert eine physiologische Herzleistung durch eine Autoregulation mit variablen Füllungsdrücken. Durch die Verwendung biologischer Oberflächen sind die Anforderungen an die dauerhaft notwendige Antikoagulation deutlich geringer.
Bei der geringen Anzahl implantierter Kunstherzen spielt für das Überleben der Patienten die Erfahrung der Zentren eine wesentliche Rolle.
Indikationen zur mechanischen Kreislaufunterstützung
Eine VAD/TAH Therapie kann zur Überbrückung bis zu einer Herztransplantation (bridge to transplant, BTT) oder Kontraindikationen als Alternative zur Transplantation (alternative to transplant, ATT; destination therapy DT) indiziert sein. Aufgrund des dramatischen Organmangels ist die BTT Indikation eine eher theoretische Behandlungsstrategie. Die European Association for Cardio-Thoracic Surgery (EACTS) spricht daher allgemein von dauerhafter Unterstützung [3].
Die Indikation hängt von der klinischen Erfahrung des Zentrums und dem Wunsch des Patienten ab. Die VAD/TAH Therapie ist grundsätzlich indiziert bei Patienten mit terminaler Herzinsuffizienz mit eingeschränkter Pumpfunktion (HFrEF, EF ≤ 25 %) und Inotropika-Abhängigkeit oder permanentem NYHA Stadium IIIb-IV unter optimierter medikamentöser Therapie [3]. Eine eingeschränkte maximale Sauerstoffaufnahme von unter 12ml/kg/min ist ein wichtiger Indikator.
Die Register Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS) und European Registry for Patients with Mechanical Circulatory Support (EUROMACS) stratifizieren herzinsuffiziente Patienten in sieben Stufen, die bei der Indikationsstellung einer VAD/TAH Therapie helfen (Tab. 1) [4].
Tab. 1: The Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS)-Status zur Klassifikation terminal herzinsuffizienter Patienten [9].
|
1. Kardiogener Schock (Crash and Burn) NYHA Klasse: IV System: ECLS, ECMO, perkutanes MCS 1-Jahres-Überleben: 52.6 ± 5.6% |
|
2. Fortschreitende Verschlechterung trotz Inotropika (Sliding on Inotropes) NYHA Klasse: IV System: ECLS, ECMO, LVAD 1-Jahres-Überleben: 63.1 ± 3.1% |
|
3. Stabil unter Inotropika (Dependent Stability) NYHA Klasse: IV System: LVAD 1-Jahres-Überleben: 78.4 ± 2.5% |
|
4. Symptome in Ruhe (Frequent Flyer) NYHA Klasse: IV ambulant System: LVAD 1-Jahres-Überleben: 78.7 ± 3.0% |
|
5. Nicht belastbar (Housebound) NYHA Klasse: IV ambulant System: LVAD 1-Jahres-Überleben: 93.0 ± 3.9%* |
|
6. Eingeschränkte Belastbarkeit (Walking wounded) NYHA Klasse: III System: LVAD / LVAD kann als Behandlungsoption diskutiert werden |
|
7. Placeholder NYHA Klasse: III System: LVAD kann als Behandlungsoption diskutiert werden |
ECLS = extracorporeal life support; ECMO = extracorporeal membrane oxygenation; LVAD = left ventricular assist device; NYHA = New York Heart Association;
* Kaplan-Meier Überlebenswahrscheinlichkeiten ± Standardfehler für das 1-Jahres-Überleben mit LVAD Therapie. Patienten wurden zensiert zum Zeitpunkt des letzten Kontaktes, Erholung oder Herztransplantation. Wegen der kleinen Patientenzahlen wurden die Ergebnisse für die Intermacs Status 5,6 und 7 kombiniert.
Ergebnisse der VAD/TAH Therapie
Seit der Veröffentlichung der REMATCH Studie 2001 haben zahlreiche Publikationen dokumentiert, dass die VAD/TAH Therapie einen bedeutenden Überlebensvorteil, verbesserte Lebensqualität und Belastbarkeit gegenüber optimierter medikamentöser Therapie bietet [5]. In den Zulassungsstudien einzelner Systeme sind die Ergebnisse in der Regel besser als in den großen Registern (Euromacs, Imacs), was auf die Patientenselektion zurückgeführt werden muss. Negativen Einfluss haben eine biventrikuläre Herzinsuffizienz, sowie Nieren- und Leberinsuffizienz.
Im IMACS report wird eine 3-Jahres-Überlebensrate von 62,4 % bei LVAD – Patienten berichtet [4], im EUROMACS – Register wird eine 3-Jahres-Überlebensrate über alle Altersgruppen von 44 % angegeben [6]. Bei Patienten unter 50 Jahren liegt dies über 62 %. Für das Heartmate 3® attestiert die MOMENTUM3 Studie ein 2-Jahres-Überleben von 79 % [7]. Für das Syncardia TAH® ist ein 2Jahres-Überleben von 34 % angegeben [8]. Biventrikuläre Unterstützungssysteme und TAHs scheinen zu zögerlich eingesetzt zu werden.
Komplikationen der mechanischen Kreislaufunterstützung
Die gegenüber der Herztransplantation deutlich schlechteren Langzeitergebnisse der VAD/TAH Therapie sind durch methodenbedingte Komplikationen begründet [2].
Rechtsherzversagen
Ein perioperatives Rechtsherzversagen kann nicht verlässlich vorhergesagt werden, weshalb bei Patienten mit eingeschränkter linksventrikulärer Pumpfunktion zunächst die isolierte LVAD Implantation angestrebt wird [7]. Eine temporäre Rechtsherzunterstützung durch eine extrakorporale Zentrifugalpumpe kann zur Überbrückung bis zur Erholung der Rechtsherzfunktion oder bis zur permanenten mechanischen Unterstützung eingesetzt werden. Sollte die Entwöhnung von einem temporären RVAD nicht möglich sein, kann entweder eine zweizeitige Implantation eines permanenten RVAD Systems, die Implantation eines Kunstherzens (TAH) oder eine dringliche Herztransplantation angestrebt werden.
Pumpenthrombose
Bei Thrombosierung eines VAD/TAH Systems muss entweder eine systemische Thrombolyse oder der Austausch des Systems erfolgen. Das Überleben nach Systemwechsel ist aber deutlich eingeschränkt. Das Risiko für die Entwicklung einer Pumpenthrombose ist erhöht bei hohem Body-Mass-Index, Non-Compliance, Rechtsherzinsuffizienz und Infektion. Für das Heartmate 3® wurden keine Pumpenthrombosen beschrieben [7].
Blutungen
VAD Systeme mit kontinuierlichem Blutfluss verursachen ein erworbenes Von-Willebrand-Syndrom und können zum Auftreten von arterio-venösen Malformationen führen. Schwere Blutungen können bei bis zu 23 % der Patienten auftreten und sich bei bis zu 10 % wiederholen. Bei den pulsatilen VAD/TAH Systemen sind derartige Komplikationen nicht beschrieben.
Infektionen
Systeminfektionen stellen die häufigste Komplikation der VAD/TAH Therapie dar. Zumeist sind dies Staphylokokkus dominierte Driveline Infektionen mit einer definitionsabhängigen Inzidenz von 13 % bis 80 %. Im Sinne einer Systemendokarditis können Keime die Systeme auch über den Blutstrom besiedeln. Neben der Driveline-Infektion ist die Diagnose eines Systeminfektes schwierig, da eine positive Blutkultur nicht beweisend, eine Echokardiographie wegen Artefakten nicht verlässlich und ein PET-CT falsch-positiv sein kann. Neben der primären antibiotischen Therapie kann ein Systemwechsel notwendig oder eine dringliche Herztransplantation angestrebt werden.
Zerebro-vaskuläre Komplikationen
Bis zu 20 % der VAD/TAH Patienten entwickeln in den ersten zwei Jahren einen Schlaganfall oder eine intrakranielle Blutung. Das Auftreten wird begünstigt durch eine vormalige neurologische Komplikation, Hyponatriämie, niedriges Albumin, erhöhte rechtsatriale Drücke, Vorhofflimmern, Infektionen und Schwankungen der Antikoagulation.
Fehlfunktionen des Systems
Etwa 50 % der Patienten mit einem permanenten Kreislaufunterstützungssystem erfahren innerhalb des ersten Jahres eine Gerätefehlfunktion, die nicht auf einer Thrombose des Systems beruht. Aufgrund des berichteten 1-Jahres-Überleben nach VAD/TAH Implantation von etwa 70 % bis 80 %, beeinflussen solche Gerätefehlfunktionen die Morbidität und Letalität aber nur unwesentlich. Fehlfunktionen der extrakorporalen Systemkomponenten machen nur selten einen operativen Systemwechsel erforderlich.
Zusammenfassung
Die Herztransplantation stellt wegen der guten Langzeitergebnisse immer noch den Goldstandard in der Behandlung der terminalen Herzinsuffizienz dar. Die VAD/TAH Therapie stellt abhängig von der Indikationsstellung eine wichtige Alternative dar. Verbesserte Biokompatibilität und transkutane Energieübertragung werden zukünftig die Ergebnisse der mechanischen Kreislaufunterstützung verbessern.
Literatur
[1] Beckmann A, Meyer R, Lewandowski J, Markewitz A and Gummert J. German Heart Surgery Report 2020: The Annual Updated Registry of the German Society for Thoracic and Cardiovascular Surgery. Thorac Cardiovasc Surg. 2021;69:294-307.
[2] Schramm R, Morshuis M, Schoenbrodt M, Boergermann J, Hakim-Meibodi K, Hata M and Gummert JF. Current perspectives on mechanical circulatory support. Eur J Cardiothorac Surg. 2019;55:i31-i37.
[3] Potapov EV, Antonides C, Crespo-Leiro MG, Combes A, Farber G, Hannan MM, Kukucka M, de Jonge N, Loforte A, Lund LH, Mohacsi P, Morshuis M, Netuka I, Ozbaran M, Pappalardo F, Scandroglio AM, Schweiger M, Tsui S, Zimpfer D and Gustafsson F. 2019 EACTS Expert Consensus on long-term mechanical circulatory support. Eur J Cardiothorac Surg. 2019;56:230-270.
[4] Kirklin JK, Xie R, Cowger J, de By T, Nakatani T, Schueler S, Taylor R, Lannon J, Mohacsi P, Gummert J, Goldstein D, Caliskan K and Hannan MM. Second annual report from the ISHLT Mechanically Assisted Circulatory Support Registry. J Heart Lung Transplant. 2018;37:685-691.
[5] Rose EA, Gelijns AC, Moskowitz AJ, Heitjan DF, Stevenson LW, Dembitsky W, Long JW, Ascheim DD, Tierney AR, Levitan RG, Watson JT, Meier P, Ronan NS, Shapiro PA, Lazar RM, Miller LW, Gupta L, Frazier OH, Desvigne-Nickens P, Oz MC, Poirier VL and Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure Study G. Long-term use of a left ventricular assist device for end-stage heart failure. N Engl J Med. 2001;345:1435-43.
[6] de By TMMH, Mohacsi P, Gahl B, Zittermann A, Krabatsch T, Gustafsson F, Leprince P, Meyns B, Netuka I, Caliskan K, Castedo E, Musumeci F, Vincentelli A, Hetzer R, Gummert J; EUROMACS members. The European Registry for Patients with Mechanical Circulatory Support (EUROMACS) of the European Association for Cardio-Thoracic Surgery (EACTS): second report. Eur J Cardiothorac Surg. 2018 Feb 1;53:309-16.
[7] Mehra MR, Uriel N, Naka Y, Cleveland JC, Jr., Yuzefpolskaya M, Salerno CT, Walsh MN, Milano CA, Patel CB, Hutchins SW, Ransom J, Ewald GA, Itoh A, Raval NY, Silvestry SC, Cogswell R, John R, Bhimaraj A, Bruckner BA, Lowes BD, Um JY, Jeevanandam V, Sayer G, Mangi AA, Molina EJ, Sheikh F, Aaronson K, Pagani FD, Cotts WG, Tatooles AJ, Babu A, Chomsky D, Katz JN, Tessmann PB, Dean D, Krishnamoorthy A, Chuang J, Topuria I, Sood P, Goldstein DJ and Investigators M. A Fully Magnetically Levitated Left Ventricular Assist Device – Final Report. N Engl J Med. 2019;380:1618-1627.
[8] Arabia FA, Cantor RS, Koehl DA, Kasirajan V, Gregoric I, Moriguchi JD, Esmailian F, Ramzy D, Chung JS, Czer LS, Kobashigawa JA, Smith RG and Kirklin JK. Interagency registry for mechanically assisted circulatory support report on the total artificial heart. J Heart Lung Transplant. 2018;37:1304-1312.
[9] Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, Falk V, Gonzalez-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GMC, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P and Group ESCSD. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37:2129-2200.
Gummert J, Schramm R: Herztransplantation und mechanische Kreislaufunterstützung – der aktuelle Stand Passion Chirurgie. 2021 November; 11(11): Artikel 03_02.
Autoren des Artikels
Prof. Dr. med. Jan Gummert
Präsident der Deutschen Gesellschaft für Thorax-, Herz- und GefäßchirurgieHerz- und Diabeteszentrum NRWUniklinik der Ruhruniv. BochumThorax- u. KardiovaskularchirurgieProf. Dr. med. Rene Schramm
Klinik für Thorax- und KardiovaskularchirurgieHerz- und Diabeteszentrum NRWGeorgstr. 1132545Bad OeynhausenWeitere aktuelle Artikel
01.05.2025 Herzchirurgie
Geschlechtssensible Aspekte in der Herzchirurgie: Neue Perspektiven und Herausforderungen
Die geschlechtssensible Medizin hat in den letzten Jahren zunehmend an Bedeutung gewonnen, auch in Fachbereichen wie der Herzchirurgie, in denen geschlechtsspezifische Unterschiede in Diagnose, Behandlung und Ergebnissen bisher oft unzureichend berücksichtigt wurden.
01.03.2025 BDC|News
BDC-Journalistenpreis 2024: Lebensretter im OP – ein Tag in der Herzchirurgie
»Amandine Cormier, Journalistin beim Evangelischen Kirchenfunk Niedersachsen-Bremen, hat 2024 den BDC-Journalistenpreis für ihre Reportage „Lebensretter im OP – ein Tag in der Herzchirurgie“ erhalten. Die Veröffentlichung der Reportage war am 01. November 2023 auf dem YouTube-Kanal BASIS:KIRCHE.
27.09.2022 Pressemitteilungen
Weltherztag: Kleine Taktgeber für das Herz
Die Entwicklung verschiedener Herz-Rhythmus-Implantate ist eine medizinische Erfolgsgeschichte, die bereits zahllosen Menschen Lebensqualität zurückgegeben und in vielen Fällen sogar das Leben gerettet hat. Für die moderne Medizin sind diese Systeme unentbehrlich.
28.07.2022 Herzchirurgie
Zweitmeinung jetzt auch bei Herzschrittmachern und Defibrillatoren
Heute (28.7.2022) tritt der Beschluss des Gemeinsamen Bundesausschusses (G-BA) vom 19.5.2022 in Kraft, wonach die Richtlinie zum Zweitmeinungsverfahren nun auch für den Einsatz von Herzschrittmachern und Defibrillatoren gilt.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.