12.02.2016 Thoraxchirurgie
Gibt es eine personalisierte Chirurgie des Lungenkarzinoms?
Die moderne Onkologie, nicht zuletzt die Thoraxonkologie verfolgt den Anspruch einer personalisierten Medizin. Gilt das auch für die Thoraxchirurgie? Nun, das hängt davon ab, was man unter personalisierter Medizin versteht.
Giovanni Maio schreibt: „Personalisierte Medizin ist in Mode, weil sie ein Gegenpol zur naturwissenschaftlich orientierten und in Schemata denkenden modernen High-Tech-Medizin zu sein vorgibt. Das oft verwendete Synonym für personalisierte Medizin ist der Ausdruck „individualisierte Medizin“. Was möchte man mehr?” Allerdings sei „personalisierte Medizin” ein irreführender Marketing-Begriff, da es in Wirklichkeit nicht um das Medikament nach Maß geht, wie bei einem Maßanzug, der nur einer Person perfekt passt, sondern vielmehr um ein Stratifizieren der Medizin im Hinblick auf die Vermeidung von Inneffektivität und unnötige Risiken. [1]
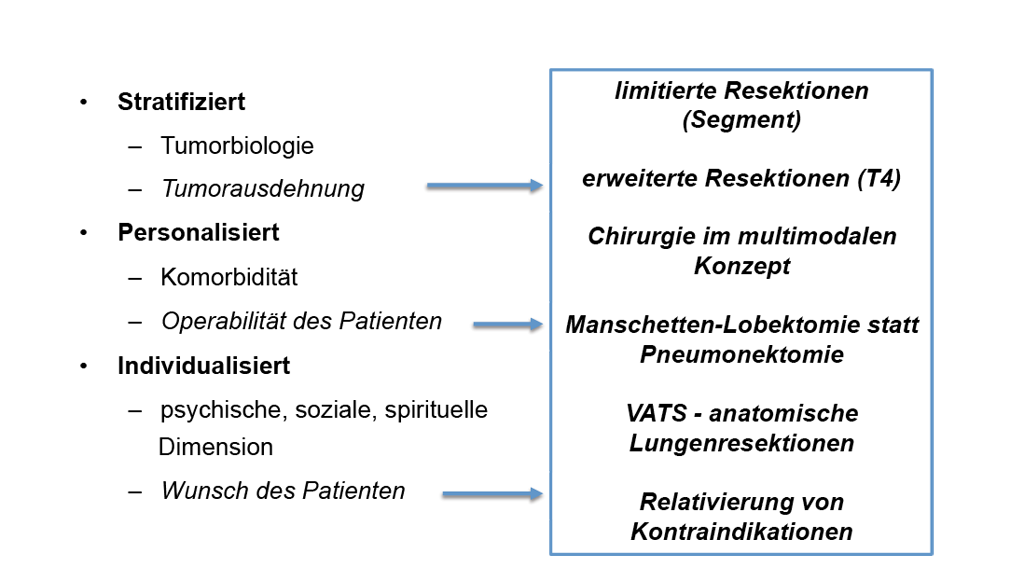
Also drei Begriffe für dasselbe? Nicht ganz. Stratifizierte, personalisierte und individualisierte Medizin werden in der onkologischen Literatur mit durchaus unterschiedlichen Inhalten verknüpft. Unter „stratifizierter Medizin“ versteht man die mittels prädiktiver molekularbiologischer Diagnostik gesteuerte Auswahl zielgerichteter Therapien. Die „personalisierte Medizin“ berücksichtigt zusätzlich Patientenseitige Faktoren wie Komorbidität, Alter und Compliance. Von „individualisierter Medizin“ darf gesprochen werden, wenn auch die individuellen Präferenzen, die psychische, soziale und spirituelle Situation des Patienten in die Therapieentscheidungen einbezogen werden. [2]
Als Chirurgen haben wir immer den Anspruch, jeder Patientin und jedem Patienten, die individuell bestmögliche Therapie zukommen zu lassen. Wir schauen uns die Tumorausdehnung an, wir schauen uns den kranken Menschen an und wir sprechen miteinander, auch mit den Angehörigen. Die gemeinsame Therapieentscheidung ist dann stratifiziert (entsprechend der Tumorausdehnung), personalisiert (entsprechend der funktionellen und allgemeinen Operabilität) und individualisiert unter Berücksichtigung der sozialen und psychischen Situation und den Wünschen des Patienten. Die Therapieentscheidung beinhaltet zunächst die generelle Entscheidung für oder gegen die Operation. Bei der Entscheidung für die Operation eröffnen sich eine ganze Reihe von Optionen, die bestmögliche Operationsstrategie individuell anzupassen und festzulegen.
Abb. 1: Stratifizierte, personalisierte und individualisierte Medizin im chirurgischen Kontext
Limitierte Resektion
Limitierte Resektionen (anatomische Segmentresektion, atypische Resektion) sind eine chirurgisch-therapeutische Option bei Patienten mit kleinen peripher gelegenen Tumoren im Stadium I, die funktionell für eine Standardresektion im Sinne einer Lobektomie nicht operabel erscheinen. Damit kann auch Patienten mit stark eingeschränkter funktioneller Reserve die Option der Tumorentfernung eröffnet werden, allerdings um den Preis einer eingeschränkten Kuration im Langzeitverlauf. Dieser Nachteil tritt jedoch in der Regel in den Hintergrund angesichts der einschränkten Lebenserwartung aufgrund der bestehenden Komorbiditäten. Die Lokalrezidivrate ist nach limitierter Resektion eines nicht-kleinzelligen Lungenkarzinoms im Stadium IA (T1N0) im Langzeitverlauf etwa dreimal so hoch wie nach einer Lobektomie. Neuere retrospektive Analysen größerer Kohorten aus den USA (SEER-Daten) und Japan lassen vermuten, dass bei Tumoren kleiner 2 cm im Durchmesser und prognostisch günstiger histologischer Subdifferenzierung eine anatomische Segmentresektion der Lobektomie onkologisch jedoch gleichwertig ist. Dies gilt insbesondere für Adenokarzinome mit lepidischer Subdifferenzierung. Allerdings müssen bis zur definitiven Einschätzung die Ergebnisse der derzeit in Europa, Japan und USA laufenden randomisierten Studien abgewartet werden. Aktuell gilt nach wie vor die Lobektomie als Standard.
Minimal-invasive Operation (VATS-Lobektomie)
Als operativer Standard für Tumore im Stadium I hat sich die videothorakoskopisch durchgeführte Lobektomie (VATS-Lobektomie) etabliert. Die VATS – als minimal-invasives Verfahren – ist aufgrund deutlich kleinerer Inzisionen und Verzicht auf eine Spreizung der Rippen für den Patienten deutlich weniger belastend als eine offene Thorakotomie. Onkologisch ist die VATS-Lobektomie der offenen Lobektomie nicht nur nicht unterlegen, sondern mindestens gleichwertig, sofern keine Kompromisse in der onkologischen Radikalität und insbesondere bei der Lymphknotendissektion gemacht werden. Prinzipiell ist jede anatomische Lungenresektion minimal-invasiv und onkologisch korrekt durchführbar. Bei interlobärer Lymphknoten-Metastasierung im Stadium II oder mediastinaler Lymphknotenmetastasierung kommt das videothorakoskopische Vorgehen allerdings aufgrund begrenzter Übersicht an seine Grenzen. In diesen Fällen sollte zu einer offenen Thorakotomie konvertiert werden, um Kompromisse in der onkologischen Radikalität zu vermeiden – ein Beispiel für die jederzeit erforderliche individuelle Anpassung der Operationsstrategie bei neuen oder unerwarteten Befunden.
Bronchoplastische/angioplastische Verfahren
Endobronchialer Tumorbefall der zentralen Lappenbronchen oder kapselüberschreitendes Wachstum befallener interlobärer Lymphknoten (N1) sind die Indikation zu bronchoplastischen und/oder angioplastischen Resektionen. Durch Manschettenresektionen an Bronchialbaum und Lungengefäßen – als sogenannte organerhaltenden Operationen – lassen sich in diesen Fällen häufig die Pneumonektomie vermeiden, ohne die Radikalität und damit die Heilungschancen einzuschränken. Die technische Komplexität des Eingriffs, die Morbidität und der postoperativer Überwachungsaufwand, aber auch die Anforderungen an die Mitarbeitsfähigkeit des Patienten, sind höher als bei einer Standard-Lobektomie. Morbidität und Letalität sind bei entsprechender Erfahrung des Operateurs jedoch niedriger als nach Pneumonektomie. Die Notwendigkeit einer Manschettenresektion lässt sich oft erst intraoperativ erkennen. Der Operateur muss dann entscheiden, ob der Patient für eine Manschettenresektion geeignet ist oder ob das Risiko schwerwiegender postoperativer Komplikationen im individuellen Fall zu hoch ist. Fortgesetztes Rauchen bis zum OP-Tag, eingeschränkte Mobilität oder Mitarbeitsfähigkeit sind Faktoren, die ein hohes Risiko für einen komplikationsträchtigen postoperativen Verlauf erwarten lassen. Das Wissen darum setzt die Kenntnis der Gesamtsituation des Patienten voraus. Im Einzelfall wird man sich dann u. U. für die Inkaufnahme einer lokalen R1-Situation mit postoperativer Nachbestrahlung und gegen eine komplexe operative Erweiterung entscheiden.
Erweiterte Resektion
Unter einer erweiterten Resektion versteht man die Einbeziehung aller Lungengrenzen überschreitenden Befunde oder die en bloc-Resektion des Lungentumors mit angrenzenden Strukturen. Während eine direkte Infiltration der Thoraxwand in der Regel technisch unproblematisch respektabel ist, stellt die Infiltration des Mediastinums bei Patienten mit nicht-kleinzelligem Lungenkarzinom eine Grenzindikation für eine primär chirurgische Therapie dar und bedarf der erfahrenen thoraxchirurgischen Beurteilung. Postoperative Letalität und Morbidität nach erweiterter Resektion sind höher als nach vergleichbarer einfacher Resektion. In diesen Fällen gilt die oben dargestellte Abwägung des individuellen Patientenseitigen Nutzen-Risikos daher im Besonderen. Eine eingehende Beratung mit dem Patienten unter Einbeziehung aller Faktoren ist unabdingbar. Diese kann dann auch das Ergebnis haben, dass man sich gemeinsam von der Operationsindikation zurückzieht und eine andere Therapieoption präferiert.
Adjuvante Therapie
Auch die Entscheidung für oder gegen eine adjuvante Therapie nach kurativer Lungenresektion bei einem Lungenkarzinom ist immer eine individuelle Entscheidung zusammen mit dem Patienten. Die 5-Jahres-Überlebensraten nach kurativer Resektion bei nicht-kleinzelligem Lungenkarzinom im Stadium IA liegen bei 75 bis 80 Prozent. Eine adjuvante Chemotherapie verbessert die 5-Jahres-Überlebensrate nicht. In der postoperativen Situation nach R0-Resektion hat die Strahlentherapie einen negativen Einfluss auf die Prognose und ist nicht indiziert. Für das Stadium IB weisen die großen Register postoperative 5-Jahres-Überlebensraten von 55 bis 60 Prozent aus. In der Metaanalyse führt die adjuvante Chemotherapie im Stadium IB zu einer Verbesserung der 5-Jahres-Überlebensrate um absolut 1,8 Prozent. Die aus diesen Daten abgeleiteten Empfehlungen verschiedener Leitlinien sind nicht einheitlich. Retrospektive Analysen deuten darauf hin, dass möglicherweise Patienten mit zusätzlichen Risikofaktoren (z. B. Tumorgröße > 4 cm) in stärkerem Maße von einer adjuvanten Chemotherapie profitieren. Diese zusätzlichen Parameter sind allerdings nicht prospektiv validiert. Eine adjuvante Bestrahlung ist nur nach inkompletter Resektion indiziert, wenn eine Nachresektion nicht möglich ist. In der postoperativen Situation nach R0 Resektion hat sie einen negativen Einfluss auf die Prognose und ist nicht indiziert. Die postoperativen 5-Jahres-Überlebensraten nach alleiniger Operation für das Stadium IIA liegen zwischen 45 und 55 Prozent und für das Stadium IIB zwischen 35 und 45 Prozent. Alle aktuellen Leitlinien empfehlen eine adjuvante Chemotherapie nach erfolgter R0 Resektion. Sie führte in einer Metaanalyse von 34 Studien mit unterschiedlichen Chemotherapie-Protokollen zu einer Verbesserung der 5-Jahres-Überlebensrate um 5 Prozent absolut. In der Langzeit-Metaanalyse von mit einer Kombination aus Cisplatin und Vinorelbin behandelten Patienten der LACE Studie lag die 5-Jahresüberlebensrate um 11,6 Prozent höher als in der Kontrollgruppe. Die Strahlentherapie hat in der postoperativen Situation nach R0 Resektion im Stadium II einen negativen Einfluss auf die Prognose und ist nicht indiziert. Die Strahlentherapie ist eine Alternative als primäre Therapiemaßnahme bei inoperablen Patienten. Sie kann auch indiziert sein in einer postoperativen R1 oder R2 Situation, wenn eine erneute Operation nicht möglich ist.
Oligometastastasiertes Stadium IV
Patienten mit Lungenkarzinom und einer solitären Nebennierenmetastase oder bis zu drei solitären ZNS Metastasen (ohne Hinweise auf extraadrenale bzw. extrazerebrale Metastasen) kann ein Therapiekonzept mit einem kombinierten lokalen kurativen Therapieansatz angeboten werden. Voraussetzung hierzu ist eine kurative Therapieoption sowohl für den Primärtumor als auch für die Metastasen. Primärtumore mit mediastinaler Lymphknotenmetastasierung sind daher in der Regel ein Ausschluss-Kriterium. Die Staging-Diagnostik sollte eine adäquate Bildgebung zum Ausschluss weiterer Metastasen umfassen (PET-CT). Eingehende Beratung mit dem Patienten unter Einbeziehung möglicher konkurrierender Therapieverfahren ist hier besonders gefordert, da belastbare Daten fehlen. Es ist immer eine Einzelfall-Entscheidung.
Palliative Chirurgische Therapie
Die chirurgische Therapie bei Patienten mit Lungenkarzinom kann neben der kurativen Zielsetzung bei bedingter oder sicherer kurativer Inoperabilität auch eine palliative Zielsetzung verfolgen. Indikationen sind z. B.: Lungenabszess, einschmelzende Retentionspneumonie, Hämoptoe oder unbeeinflussbare Schmerzen bei Tumoreinbruch in die Brustwand nach Versagen anderer Therapieverfahren. Die Indikation zur Operation – insbesondere mit primär palliativer Zielsetzung – ist immer per se eine Individualentscheidung. Sie sollte interdisziplinär unter kritischem Abwägen der Risiken und des zu erwartenden palliativen Nutzen für den Patienten getroffen werden.
Schlussbemerkung
Die personalisierte bzw. individualisierte Chirurgie beim Lungenkarzinom sollte Standard sein. Erreichbar ist dieser Standard in einer sorgsam geführten, alle Faktoren der Tumorausdehnung und der individuellen Situation des Patienten berücksichtigenden Beratung in einem interdisziplinären Tumorbord, idealerweise in der umfassenden multidisziplinären Struktur eines zertifizierten Lungenkrebszentrums.
Literatur
[1] Maio G. Chancen und Grenzen der personalisierten Medizin – eine ethische Betrachtung. GGW. 2012; 12(1):15-19.
[2] Thomas M, Bischoff H, Grosch H, Sianidou M, Steins M, Villalobos M. Personalisiert, Individualisiert, Stratifiziert – Thoraxonkologie Quo Vadis? Pneumologie. 2012; 66(6):1-3.
Weiterführende Literatur
Howington JA, Blum MG, Chang AC, Balekian AA, Murthy SC. Treatment of stage I and II non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143:e278S-313S.
Goeckenjan G, Sitter H, Thomas M, Branscheid D, Flentje M, et al. Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. Pneumologie. 2010;64:e1-e164.
Ramnath N, Dilling TJ, Harris LJ, Kim AW, Michaud GC, et al. Treatment of stage III non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143:e314S-40S.
Kozower BD, Larner JM, Detterbeck FC, Jones DR. Special treatment issues in non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143:e369S-99S.
Socinski MA, Evans T, Gettinger S, Hensing TA, Sequist LV, et al. Treatment of stage IV non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143:e341S-68S.
Hoffmann H. Gibt es eine personalisierte Chirurgie des Lungenkarzinoms? Passion Chirurgie. 2016 Februar, 6(02): Artikel 02_01.
Autor des Artikels
Prof. Dr. med. Hans Hoffmann
Leitender Oberarzt ChirurgieThoraxklinikUniversitätsklinikum HeidelbergRöntgenstrasse 169126Heidelberg kontaktierenWeitere Artikel zum Thema
01.10.2017 Politik
Berufspolitische Themen im Fachbereich Thoraxchirurgie
diejenigen unter Ihnen, die bereits Mitglieder im BDC sind, haben offensichtlich im Rahmen einer Entscheidungsfindung erkannt, wie wichtig aktive Berufspolitik ist. Der BDC ist der größte chirurgische Berufsverband in Europa. Da drängt sich zwangsläufig die Frage auf, welche spezifischen Themen im Referat Thoraxchirurgie für eine zahlenmäßig vergleichsweise kleine Berufsgruppe als relevant erachtet werden.
01.10.2017 Thoraxchirurgie
Thoraxchirurgie gestern und heute
Die Anfänge der Thoraxchirurgie liegen nicht nur in den Händen großer chirurgischer Vorväter wie von Langenbeck, Billroth, Nissen oder Sauerbruch, sondern auch in denen von Internisten, die sich mit den Möglichkeiten der Behandlungen der Tuberkulose durch gezielte Anlage eines Pneumothorax beschäftigten.
18.09.2017 Fachgebiete
Präoperative Evaluation erwachsener Patienten vor elektiven, nicht herz-thoraxchirurgischen Eingriffen
Die vorliegenden Empfehlungen gelten für erwachsene Patienten vor elektiven, nicht kardiochirurgischen und nicht lungenresezierenden Eingriffen. Es handelt sich um eine Überarbeitung und Aktualisierung der erstmals im Jahre 2010 publizierten Empfehlungen der Deutschen Fachgesellschaften der Inneren Medizin, Chirurgie und Anästhesiologie [1], die seither im deutschsprachigen Raum eine gute Durchdringung und Akzeptanz erfahren haben [2,3].
09.08.2016 BDC|News
Reisestipendien für Studenten zum DGT-Kongress
In diesem Jahr vergibt die Deutsche Gesellschaft für Thoraxchirurgie (DGT) erstmalig zehn Reisestipendien für Studenten zur Teilnahme an der Jahrestagung in Freiburg im Wert von 250 Euro. Bewerbungsschluss ist am 04. September 2016.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.