01.09.2014 Fachübergreifend
Aktuelle Bewertungskriterien für die Resektabilität von malignen Tumoren
Die en-bloc R0-Resektion ist nach wie vor der Goldstandard in der Behandlung fast aller soliden Tumoren und meist die einzige kurative Therapieoption. In den vergangenen zwei Jahrzehnten wurden große Fortschritte im Gebiet der onkologischen Chirurgie erzielt; durch chirurgische und technische Fortschritte und die Weiterentwicklung von Anästhesie und Intensivmedizin sind viele ehemals als irresektabel eingestufte Tumore heute chirurgisch entfernbar. Die Einschätzung der lokalen Resektabilität für grenzwertig resektable Tumoren sollte dabei von spezialisierten chirurgischen Teams in sogenannten „high-volume“ Zentren vorgenommen werden.
Die Einschätzung der kompletten Entfernbarkeit eines Tumors hängt jedoch nicht nur vom Lokalbefund, sondern selbstverständlich auch von dem systemischen Risko der Tumorprogression ab, da Fernmetastasen bei vielen Tumoren noch immer eine Kontraindikation für eine Resektion darstellen. Hinzu kommen bei vielen onkologischen Patienten durch die immer älter werdende Bevölkerung noch weitere Komorbiditäten, hierbei sind insbesondere kardiopulmonale Vorerkrankungen zu nennen, die einen technisch und onkologisch resektablen Tumor durch die Größe des chirurgischen Eingriffes nicht sinnvoll operabel machen können.
Bei der Betrachtung der lokalen Resektabilität des Pankreaskarzinoms ist die anatomische enge Beziehung zu Nachbarstrukturen, insbesondere der arteriellen Gefäße wie der Truncus coeliacus und die A. mesenterica superior, welche nur unter deutlich erhöhter Morbidität und auch Mortalität reseziert und ersetzt werden können, zu beachten.
Bei einem Rektumkarzinom gibt es nur sehr selten lokal irresektable Befunde. Hier sind es die Einschränkungen in der Lebensqualität durch mutilierende Operationen, die die Grenze der Resektabilität darstellen können. Bei kolorektalen Lebermetastasen sind es ggf. das multifokale Auftreten und die durch Chemotherapie vorgeschädigte Leber, die eine erweiterte Resektion unmöglich machen können.
Zusammenfassend sollte jeder Patient mit einem grenzwertig resektablen Tumor in einem Zentrum der Maximalversorgung von einem interdisziplinären Expertenteam („Tumorboard“) mit erfahrenen onkologischen Chirurgen besprochen und ein individuelles Behandlungskonzept erstellt werden, um eine onkologisch bestmögliche Versorgung zu gewährleisten.
Material und Methoden
Mittels Literaturrecherche in Pubmed, MEDLINE und manueller Recherche wurden relevante Publikationen bis Juli 2014 analysiert.
Entwicklung der onkologischen Chirurgie
In den vergangenen Jahren hat sich die onkologische Chirurgie kontinuierlich weiterentwickelt und spielt mehr denn je die zentrale Rolle in der kurativen multimodalen Therapie nahezu aller Patienten mit soliden Tumoren [1,2]. Wichtige Neuerungen der vergangenen Jahrzehnte waren
- die Verbesserung der chirurgischen Technik, (z. B. neue technische Entwicklungen in der Leberchirurgie, Weiterentwicklung der laparoskopischen Chirurgie, moderne Klammernaht- und Versiegelungsgeräte),
- die stetig wachsende Rolle multimodaler Therapiekonzepte (z. B. neoadjuvante und adjuvante Therapie, intraperitoneale hypertherme Chemotherapie (HIPEC), intraoperative Bestrahlung) und nicht zuletzt
- die deutlich erweiterte Indikationsstellung bezüglich des operativen Vorgehens bei fortgeschrittenen Tumoren und bei Tumorrezidiven.
Die erweiterte Indikationsstellung geht nicht zuletzt mit einer zunehmenden Spezialisierung der Zentren einher. Im Vergleich zu früher werden heute bei Vorhandensein der entsprechenden Expertise deutlich erweiterte Kriterien der Resektabilität eingesetzt. Nach wie vor bleibt hierbei – auch bei erweiterter Indikationsstellung – die R0-Resektion, in der Regel zusammen mit der Durchführung einer adäquaten Lymphadenektomie der entscheidende prognostische Behandlungsfaktor. Lässt sich eine R0-Resektion nicht erzielen, so machen ausgedehnte Resektionen onkologisch in aller Regel keinen Sinn. Insbesondere für die technisch anspruchsvollen Operationen wie z. B. die Rektum-, Pankreas- und Ösophaguschirurgie zeigen sich im Vergleich zu früher deutlich bessere Ergebnisse, sowohl bei der perioperativen Morbidität und Mortalität als auch hinsichtlich der onkologischen Langzeitergebnisse. Wichtig ist daher, dass alle onkologischen Patienten – insbesondere aber solche mit fortgeschrittenem Tumorleiden und Tumorrezidiven – bezüglich der Einschätzung der Resektabilität und einem operativen Eingriff einem erfahrenen und für die jeweilige Entität versierten onkologischen Chirurgen an einem entsprechenden Zentrum vorgestellt werden.
Allgemeine Resektabilitätskriterien in der onkologischen Chirurgie
Die Evaluation der Resektabilität und damit die Entscheidung für einen chirurgischen Eingriff ist bei jedem mit einer Tumorerkrankung neu diagnostizierten Patienten stets eine individuelle Entscheidung, in die multiple Faktoren einfließen müssen. Zu unterscheiden ist hierbei stets zwischen einer „lokalen Irresektabilität“ und einer systemisch fortgeschrittenen Erkrankung, bei welcher chirurgische Resektionen onkologisch häufig keinen Sinn machen, da sie weder prognoseverbessernd noch lebensqualitätsverbessernd wären, obgleich eine lokale R0-Resektion der Tumorherde technisch möglich wäre. Zunächst muss bei allen onkologischen Patienten durch eine adäquate Umfelddiagnostik ein Staging erfolgen. Sollten sich systemische Metastasen zeigen, die das Therapiekonzept beeinflussen könnten (z. B. Leberrundherde bei bekanntem Pankreaskarzinom), ist eine histologische Sicherung anzustreben, um Patienten mit benignen Zweitbefunden und einem malignen Primärtumor (oder zwei synchronen, potentiell kurablen Tumorerkrankungen) nicht vorschnell als palliativ einzuschätzen. Während bei manchen Tumorentitäten (z. B. dem duktalen Pankreaskarzinom) eine Fernmetastasierung eine chirurgische Behandlung der Erkrankung meist ausschließt, stellen bei vielen anderen soliden Tumoren (z. B. kolorektales Karzinom, neuroendokrine Tumoren, Nierenzellkarzinom) Fernmetastasen heutzutage keine unbedingte Kontraindikation für eine potentiell kurative Resektion dar. Ist die onkologische Sinnhaftigkeit einer Resektion gesichert, wird nach adäquater Lokaldiagnostik (z. B. MRT beim Rektumkarzinom, ERCP/MRCP beim Klatskintumor) die lokale Resektabilität des Tumors beurteilt. Hierbei wird evaluiert, ob der betreffende Tumor nach den Standards der onkologischen Chirurgie, wie sie bereits 1949 von K.H. Bauer definiert wurden [1], operiert werden kann:
1) Vollständige (R0) en-bloc Resektion des Tumors
2) Präparation von zentral nach peripher, d. h. Präparation und Absetzen der ableitenden Gefäße vor Manipulation des Tumors
3) ggf. Durchführung einer adäquaten Lymphadenektomie
Hierbei kommen dem primär befallenen Organ sowie infiltrierten Umgebungsstrukturen eine entscheidende Rolle zu: Deren Entfernbarkeit oder Rekonstruierbarkeit sind die limitierenden Faktoren der onkologischen Chirurgie. Durch die kontinuierliche Weiterentwicklung der Chirurgie sind heutzutage viele Tumoren „technisch resektabel“, die noch vor einigen Jahren noch als irresektabel eingestuft wurden. Als Beispiel sind hierbei zum Beispiel die arterielle Resektionen mit konsekutiver Rekonstruktion beim Pankreaskarzinom und die ante situm-Leberresektion mit Kaltperfusion bei zentral liegenden Lebertumoren zu nennen. Ob diese technisch machbaren Resektionen im Einzelfall onkologisch sinnvoll sind, muss für jeden Fall individuell in einem multidisziplinären Team und vor allem in einem ausführlichen Gespräch über die Vor- und Nachteile des geplanten Eingriffs mit dem Patienten besprochen werden.
Weitere negative Einflussfaktoren auf die Operabilität von Tumoren stellen internistische Begleiterkrankungen (insbesondere kardiopulmonale Erkrankungen) und natürlich der Patientenwille dar, weil ausgedehnte Resektionen oft mit Funktionsverlusten (z. B. permanente Stomata, Extremitätenamputationen) einhergehen können, die nicht alle Patienten bereit sind einzugehen. Hohes Alter hingegen ist kein generelles Irresektabilitätskriterium, vielmehr sollte das biologische Alter (i. S. von Begleiterkrankungen und dem aktuellen Allgemeinzustand des Patienten) herangezogen werden, um die Entscheidung für oder gegen eine kurativ intendierte Operation zu treffen.
Die Einschätzung der Resektabilität onkologischer Patienten wird im Folgenden beispielhaft für das Pankreaskarzinom, für lokal fortgeschrittene Rektumkarzinome und für kolorektale Lebermetastasen skizziert.
Resektabilitätskriterien beim Pankreaskarzinom
Bei Verdacht auf ein Pankreasmalignom sollte ein standardisierter Algorithmus zur Einschätzung des Krankheitsstadiums gemäß aktueller Leitlinien erfolgen [2, 3]. Alle Patienten mit Verdacht auf ein duktales Adenokarzinom des Pankreas sollten zur Einschätzung der Resektabilität in einem in der Pankreaschirurgie erfahrenem Zentrum vorgestellt werden. Leider werden nach wie vor viele Patienten ohne Hinzuziehen eines Chirurgen als palliativ eingestuft und ihnen somit die Operation als einzige potentiell kurative Therapieoption verwehrt. Die Einschätzung der Resektabilität variiert stark zwischen den einzelnen Zentren. Erfahrungsgemäß werden erfahrene Zentren lokal fortgeschrittene Tumoren auch mit Gefäßinfiltration als technisch resektabel einstufen, während den Patienten an unerfahreneren Häusern diese Eingriffe nicht angeboten werden [4–6]. Patienten mit einem systemischen Erkrankungsstadium (Leber-, peritoneale oder zentrale Lymphknotenmetastasen) profitieren in aller Regel nicht von einer ausgedehnten Resektion – auch wenn diese potentiell technisch möglich wäre – und werden palliativ mit einer systemischen Therapie behandelt [3].
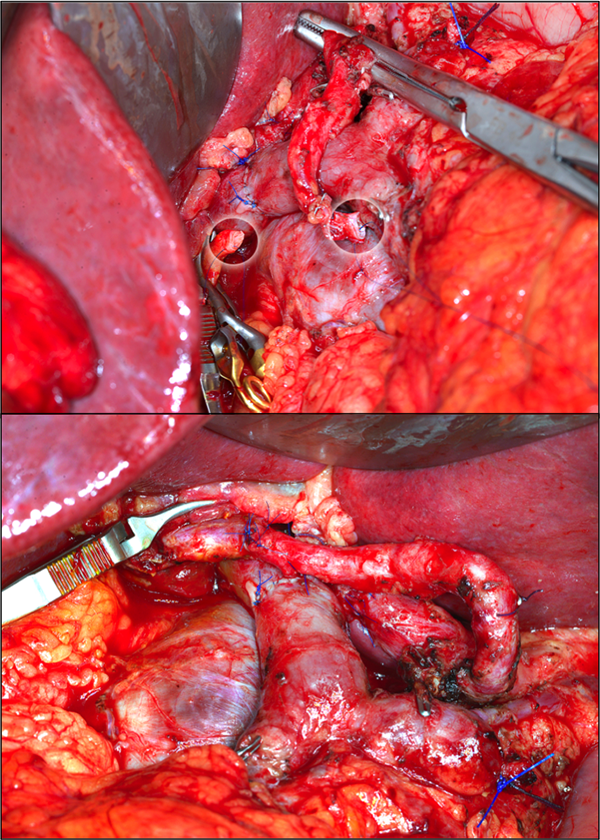
Während noch vor zehn Jahren bereits eine venöse Gefäßinfiltration eines Pankreaskarzinoms als Kontraindikation für eine Resektion angesehen wurde, werden mittlerweile Pfortaderresektionen routinemäßig und bei ausgewählten Patienten auch arterielle Resektionen mit entsprechender Rekonstruktion durchgeführt. Bei arteriellen Resektionen favorisieren wir im eigenen Vorgehen eine Pankreatektomie (ggf. mit Inselzellautotransplantation) zur Vermeidung einer postoperativen Pankreasfistel mit nachfolgender Arrosionsblutung der arteriellen Anastomose. Die Patienten können in verschiedene Gruppen bezüglich der Resektabilität eingeteilt werden, die sich maßgeblich an der Lokalisation des Tumors zu den venösen und arteriellen Gefäßen orientiert [5, 7]. Eingeteilt werden können die Patienten dann als „resektabel“, „grenzwertig („borderline“) resektabel“ und „irresektabel“, wobei zu beachten ist, dass auch die nach dieser Klassifikation als „irresektabel“ eingeteilten Patienten unter Umständen technisch durchaus resektabel sein können, aber in aller Regel zumindest von einer neoadjuvanten Therapie profitieren würden. Häufig werden Patienten vor der Exploration einer solchen neoadjuvanten Radiochemo-therapie zugeführt, um eine sekundäre Resektabilität zu erreichen. Multimodale Therapiekonzepte mit neoadjuvanter (Radio-)Chemotherapieund postoperativer Chemotherapie spielen heute bei der Behandlung des Pankreaskarzinomes eine wichtige Rolle.
Abb. 1: Transposition der A. lienalis auf die A. hepatica dextra und Pfortaderresektion bei lokal fortgeschrittenem Pankreaskarzinom. © Prof. J. Weitz, Universitätsklinikum Dresden
Resektabilitätskriterien bei lokal fortgeschrittenem Rektumkarzinom
Insbesondere lokal fortgeschrittene Rektumkarzinome oder Lokalrezidive im kleinen Becken stellen die Chirurgie vor besondere technische Herausforderungen. Hierbei spielt die enge räumliche Beziehung der Beckenorgane eine große Rolle, da diese bei Infiltration mit entfernt und ggf. rekonstruiert werden müssen. Als präoperative Diagnostik hat sich hierbei die MRT etabliert, bei dem die lokale Tumorausbreitung besser abgeschätzt werden kann als mit der CT [8] und in der auch das Ansprechen auf die neoadjuvante Radiochemotherapie genauer beurteilt werden kann [9].
Prinzipiell sind sämtliche Organe des kleinen Beckens resezierbar oder rekonstruierbar. Die radikalste Operation bei anderweitig nicht resektablen Beckentumoren stellt die Hemikorporektomie oder translumbale Amputation dar, bei der die unteren Extremitäten mitsamt dem Becken und der Beckenorgane auf Höhe der Lendenwirbelsäule abgesetzt werden und die Rekonstruktion durch ein Ileo- oder Kolostoma sowie meist ein Ileumkonduit erfolgt. Diese Operation geht allerdings mit schwerer perioperativer und postoperativer Morbidität, schwerem Funktionsverlust und Körperbildveränderungen und den damit verbundenen psychologischen und sozialen Folgen für den Patienten einher. Dieser Eingriff ist aus unserer Sicht daher ein Beispiel, dass nicht alles, was technisch möglich ist, auch durchgeführt werden sollte; auch in der Literatur wird dieser Eingriff äußerst kritisch beurteilt [10].
Die Beurteilung der Resektabiltät und des Operationsausmaßes im kleinen Becken ist abhängig von der Lokalisation des Tumors: Posterior gelegene Rektumkarzinome mit Infiltration des Os sacrum können oft durch eine hintere Beckenexenteration mit Sakrumteilresektion mit gutem onkologischem Outcome in sano reseziert werden [11]. Funktionell gute Ergebnisse können hier erreicht werden, wenn die Absetzungshöhe des Kreuzbeins unterhalb S2/S3 liegt. Höher gelegene Infiltration des Knochens wird meist als irresektabel angesehen, da das Absetzen des Sakrums und der Nervenwurzeln über S2/3 mit schweren Funktionsverlusten im Bereich der unteren Extremitäten einhergeht. Grundsätzlich sind jedoch auch solche Eingriffe technisch möglich [12]. Weiter ventral gelegene Tumoren mit Infiltration von Prostata/Vagina, Uterus und Harnblase erfordern eine komplette Beckenexenteration mit Anlage eines Kolostomas und extraanatomischer Harnableitung [13].
Generell ist das häufigste Irresektabilitätskriterium bei lokal fortgeschrittenen Beckentumoren nicht die lokale Situation, sondern Komorbiditäten, die mit hoher Morbidität assoziierte Eingriffe unmöglich machen, sowie die Entscheidung des Patienten, die mit ausgedehnten Beckeneingriffen einhergehenden Funktionsverluste nicht eingehen zu wollen.
Resektabilitätskriterien bei Lebertumoren
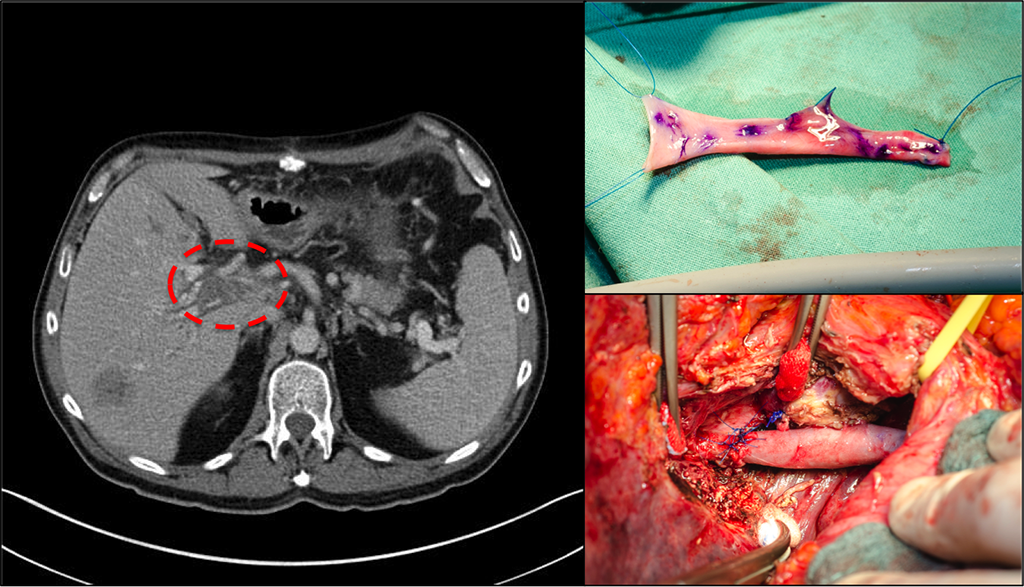
Bei der Evaluation der Resektabilität unterscheidet man nicht zwischen primären und sekundären Lebertumoren. Die Resektabilität wird dabei prinzipiell anhand der Lokalisation der Herde in der Leber und ihrer Beziehung zu den anatomischen Strukturen der Leber. Hieraus ergeben sich die notwendigen und möglichen Resektionsausmaße. Möglich sind (extraanatomische) atypische Resektionen, anatomische Segmentresektionen, Sektorektomie, (erweiterte) Hemihepatektomie (Bi-/Trisektorektomien) oder zentrale Leberresektionen (Mesohepatektomie). Während Gefäße und Gallengänge technisch rekonstruierbar bzw. reanastomosierbar sind, ist hier das mit zu resezierende Leberparenchym der limitierende Faktor. Maßgeblich ist hier der Verlust an funktionellem Restparenchym: Der Verlust eines komplett tumordurchsetzten Leberlappens ist leichter zu kompensieren als der Verlust einer Hemileber mit wenig Tumorlast und viel funktionellem Parenchym, zumal häufig das verbleibende Restparenchym durch vorhergehende Chemotherapie oder zirrhotischen Umbau häufig bereits vorgeschädigt sein kann.
Insbesondere bilobäre Lebermetastasen oder multifokale hepatozelluläre Karzinome bringen die onkologische Chirurgie an ihre Grenzen. Bei geplanten ausgedehnten Leberresektionen (z. B. einer erweiterten Hemihepatektomie rechts bzw. Trisektorektomie rechts) mit zu erwartendem geringen Restparenchym kann es daher notwendig werden, vor der Resektion eine Hypertrophie der verbleibenden (meist linken) Leber zu induzieren. Dies kann durch eine Embolisation des (rechten) Pfortaderastes geschehen, wobei dann (nach entsprechender Hypertrophiekontrolle) nach drei bis sechs Wochen die erweiterte Hemihepatektomie rechts erfolgt. Eine weitere Möglichkeit ist der in situ Split: Hierbei erfolgt bei einem ersten Eingriff eine Ligatur oder Verschluss der rechten Pfortader und eine Transsektion des Leberparenchyms entlang des Lig. falciforme. Durch die im Vergleich zur alleinigen Pfortaderembolisation fehlende Kollateraldurchblutung mit portalvenösem Blut zwischen rechter und verbleibender linker Leber entsteht sehr wahrscheinlich eine beschleunigte Hypertrophie, sodass bereits sieben Tage nach dem Primäreingriff die Leberresektion erfolgen kann [14]. Der genaue Mechanismus des sehr schnellen und effizienten Hypertrophieeffektes beim in situ Split ist aber noch nicht genau geklärt; die aber hohe Morbidität und Mortalität dieses Eingriffes sollte auch in erfahrene Zentren berücksichtigt werden.
Bei bilobären Lebermetastasen sind auch mehrzeitige Eingriffe möglich, z. B. zunächst die Sanierung der linken Seite durch atypische Resektionen, dann die rechtsseitige Pfortaderembolisation zur Hypertrophieinduktion gefolgt von der erweiterten Hemihepatektomie rechts. Generell können auch gut parenchymsparende ablative Techniken (RFA) mit der Resektion kombiniert werden. Wie auch bei anderen ausgedehnten Eingriffen ist bei der onkologischen Leberchirurgie durch die Morbidität eine Grenze des für den Patienten Zumutbaren und Machbaren oft vor den chirurgisch-technischen Grenzen erreicht. Es gilt zusätzlich diese komplexen Operationen in ein sinnvolles multimodales Therapiekonzept einzubinden.
In ausgewählten Fällen bei anderweitig schwer zu resezierenden Tumoren, insbesondere im Bereich des Venenkonfluens, können technisch sehr anspruchsvolle Resektionstechniken wie die ante situm-Resektion zum Einsatz kommen [15]. Bei anderweitig gesunden, ausgewählten Fällen können extrakorporale Resektionstechniken eine R0-Resektion erreichen, die durch eine in situ-Resektion nicht möglich gewesen wäre.
Abb. 2: Hemihepatektomie links mit Ersatz der Pfortader durch die Vena jugularis bei kolorektalen Lebermetastasen. Im weiteren Verlauf noch atypische Resektion der im CT sichbaren Metastase rechts. © Prof. J. Weitz, Universitätsklinikum Dresden.
Fazit für die Praxis
Die chirurgische Resektabilität hängt durch Fortschritte in der Chirurgie, der Anästhesie und der Intensivmedizin immer häufiger nicht vom Primärtumor ab, sondern von anderen Begleitumständen wie z. B. Einverständnis bzw. Risikobereitschaft des Patienten oder der Erfahrung des behandelnden Zentrums. Grundsätzlich ist stets eine onkologische R0-Situation anzustreben. Für die Einschätzung der Resektabilität von fortgeschrittenen Tumoren oder von Tumorrezidiven ist stets die Vorstellung in einem Zentrum mit entsprechender Erfahrung in der Behandlung der betreffenden Tumorentität anzustreben. Hierbei sollten alle grenzwertig resektablen Tumoren in einem interdisziplinären Tumorboard unter Teilnahme von erfahrenen Viszeralchirurgen, Onkologen, Radiologen und Radiotherapeuten besprochen und die Indikationen im multimodalen Kontext unter genauer Kenntnis des jeweiligen Patienten im Konsens gestellt werden. Ausgedehnte Tumorresektionen sind mit guten onkologischen Ergebnissen möglich, erfordern jedoch eine strenge Patientenselektion und ein gut eingespieltes, interdisziplinäres Team aus Chirurgen, OP-Schwestern, Anästhesisten und Intensivmedizinern.
Literatur
[1] Bauer KH (1949) Das Krebsproblem. Einführung in die allgemeine Geschwulstlehre für Studierende, Ärzte und Na-turwissenschaftler. Springer Verlag, Heidelberg
[2] Adler G, Seufferlein T, Bischoff SC, et al. (2007) [S3-Guidelines “Exocrine pancreatic cancer” 2007]. Z Gastroenterol 45:487–523. doi: 10.1055/s-2007-963224
[3] National Comprehensive Cancer Network (NCCN) (2012) NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Pancreatic Adenocarcinoma Version 2.2012.
[4] Sohn TA, Lillemoe KD, Cameron JL, et al. (1999) Reexploration for periampullary carcinoma: resectability, periop-erative results, pathology, and long-term outcome. Ann Surg 229:393–400.
[5] Andersson R, Vagianos CE, Williamson RCN (2004) Preoperative staging and evaluation of resectability in pan-creatic ductal adenocarcinoma. HPB (Oxford) 6:5–12. doi: 10.1080/13651820310017093
[6] Weitz J, Kienle P, Schmidt J, et al. (2007) Portal vein resection for advanced pancreatic head cancer. J Am Coll Surg 204:712–716. doi: 10.1016/j.jamcollsurg.2007.01.004
[7] Tempero MA, Arnoletti JP, Behrman S, et al. (2010) Pancreatic Adenocarcinoma. J Natl Compr Canc Netw 8:972–1017.
[8] Torkzad MR, Kamel I, Halappa VG, Beets-Tan RGH (2014) Magnetic resonance imaging of rectal and anal cancer. Magn Reson Imaging Clin N Am 22:85–112. doi: 10.1016/j.mric.2013.07.007
[9] Patel UB, Taylor F, Blomqvist L, et al. (2011) Magnetic resonance imaging-detected tumor response for locally advanced rectal cancer predicts survival outcomes: MERCURY experience. J Clin Oncol 29:3753–3760. doi: 10.1200/JCO.2011.34.9068
[10] Weaver JM, Flynn MB (2000) Hemicorporectomy. J Surg Oncol 73:117–124.
[11] Colibaseanu DT, Dozois EJ, Mathis KL, et al. (2014) Extended sacropelvic resection for locally recurrent rectal cancer: can it be done safely and with good oncologic outcomes? Dis Colon Rectum 57:47–55. doi: 10.1097/DCR.0000000000000015
[12] Gallia GL, Suk I, Witham TF, et al. (2010) Lumbopelvic reconstruction after combined L5 spondylectomy and total sacrectomy for en bloc resection of a malignant fibrous histiocytoma. Neurosurgery 67:E498–502. doi: 10.1227/01.NEU.0000382972.15422.10
[13] Koch M, Schölch S, Ulrich A, et al. (2012) Pelvic exenteration for advanced rectal cancer. Colorectal Cancer 1:255–262. doi: 10.2217/crc.12.17
[14] Schnitzbauer AA, Lang SA, Goessmann H, et al. (2012) Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg 255:405–414. doi: 10.1097/SLA.0b013e31824856f5
[15] Raab R, Schlitt HJ, Oldhafer KJ, et al. (2000) Ex-vivo resection techniques in tissue-preserving surgery for liver malignancies. Langenbecks Arch Surg 385:179–184.
[16] Mehrabi A, Fonouni H, Golriz M, et al. (2011) Hypothermic ante situm resection in tumors of the hepatocaval con-fluence. Dig Surg 28:100–108. doi: 10.1159/000323818
Autoren des Artikels
Dr. med. Sebastian Schölch
Universitätsklinikum Carl Gustav CarusKlinik und Poliklinik für Viszeral-, Thorax- und GefäßchirurgieFetscherstr. 7401307Dresden kontaktierenDr. med. Ulrich Bork
Universitätsklinik Carl Gustav CarusKlinik und Poliklinik für Viszeral-, Thorax- und GefäßchirurgieFetscherstr. 7401307DresdenDr. med. Nuh N. Rahbari
OberarztUniversitätsklinik Carl Gustav CarusKlinik und Poliklinik für Viszeral-, Thorax- und GefäßchirurgieFetscherstr. 7401307DresdenProf. Dr. med. Moritz Koch
Uniklinikum Carl Gustav CarusKlinik und Poliklinik für Viszeral-, Thorax- und GefäßchirurgieFetscherstr. 7401307DresdenWeitere aktuelle Artikel
01.11.2025 Fachübergreifend
Safety Clip: Patientenlagerung bei Operationen und Interventionen
Das bekannte Sprichwort „Wie man sich bettet, so liegt man“ erhält im Kontext der operativen Medizin eine tiefere, fachliche Dimension. Während eines chirurgischen Eingriffs sind Patienten aufgrund der Narkose nicht in der Lage, ihre Körperposition selbst zu beeinflussen – die Verantwortung für eine fachgerechte Lagerung liegt somit vollständig beim medizinischen Personal.
23.10.2025 Fachübergreifend
Umfrage “Physician Assistants im deutschen Gesundheitswesen” – Ihre Perspektive zählt!
Derzeit wird eine Online-Umfrage „Physician Assistants im deutschen Gesundheitswesen (PAGe): Bekanntheit, Verbreitung und Wahrnehmung“ durchgeführt. Bitte machen Sie mit!
20.09.2025 Fachübergreifend
Stellenwert der Spezialisierung – Chance zur Neuorientierung
Die Veränderungen im Kontext der Krankenhausreform machen eine Neuorientierung der persönlichen Kompetenzen des Klinikarzt-Berufs erforderlich. Wer sich darauf gezielt vorbereitet, wird seine individuellen Herausforderungen bewältigen und für sich eine positive Lebensqualität sicherstellen.
09.05.2025 BDC|News
Update zur Wundversorgung
Nahezu 1 Million behandlungsbedürftige Fälle von chronischen oder schlecht heilenden Wunden, Kosten für das Gesundheitssystem von geschätzt 8 Mrd. Euro werden als Belastung für das deutsche Gesundheitswesen bezeichnet.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.






















