01.09.2014 Fachübergreifend
HIPEC-Verfahren bei der Behandlung der Peritonealkarzinose- Standortbestimmung, aktuelle Datenlage

Die Tumordissemination in das Peritoneum hat einen entscheidenden Einfluss auf die Prognose der Tumorerkrankung. In den letzten Jahrzehnten hat sich die Sichtweise der Peritonealkarzinose (PC) dahingehend geändert, dass die Erkrankung als lokoregionäre Dissemination verstanden wird. In der Folge hat sich die therapeutische Strategie – bei Abwesenheit anderer systemischer Metastasen – von einem konservativ palliativen Vorgehen hin zu einer Kombination von aggressiver chirurgischer Zytoreduktion und hyperthermer intraperitonealer Chemotherapie (HIPEC) gewandelt.
Das Ziel dieser Kombinationstherapie besteht in der möglichst vollständigen chirurgischen Entfernung der makroskopisch sichtbaren Tumore und der Beseitigung mikroskopischer Tumorreste durch die intraoperative intraperitoneale Chemotherapie. Der Anspruch an die Chemotherapie ist die Verbesserung der Effektivität gegenüber systemischer Applikation durch die Steigerung der intraperitonealen Konzentration bei minimaler systemischer Konzentration und möglichst tiefer Penetration in das Gewebe.
Die Schlüsselfragen, welcher Patient mit welcher Primärerkrankung in welchem Stadium der Peritonealkarzinose wie aggressiv chirurgisch und chemotherapeutisch behandelt werden sollte, können vor dem Hintergrund der Studienergebnisse der letzten Jahre immer besser beantwortet werden. Dabei haben sich die Untersuchungen neben den primären Peritonealkarzinosen (peritoneales Mesotheliom, Pseudomyxoma peritonei) auf die sekundären Peritonealkarzinosen ausgehend vom kolorektalen Karzinomen, dem Magenkarzinom und den Ovarialkarzinomen fokussiert. Die Ergebnisse dieser Untersuchungen und die daraus resultierenden Empfehlungen werden im Folgenden dargestellt.
Diagnose der Peritonealkarzinose
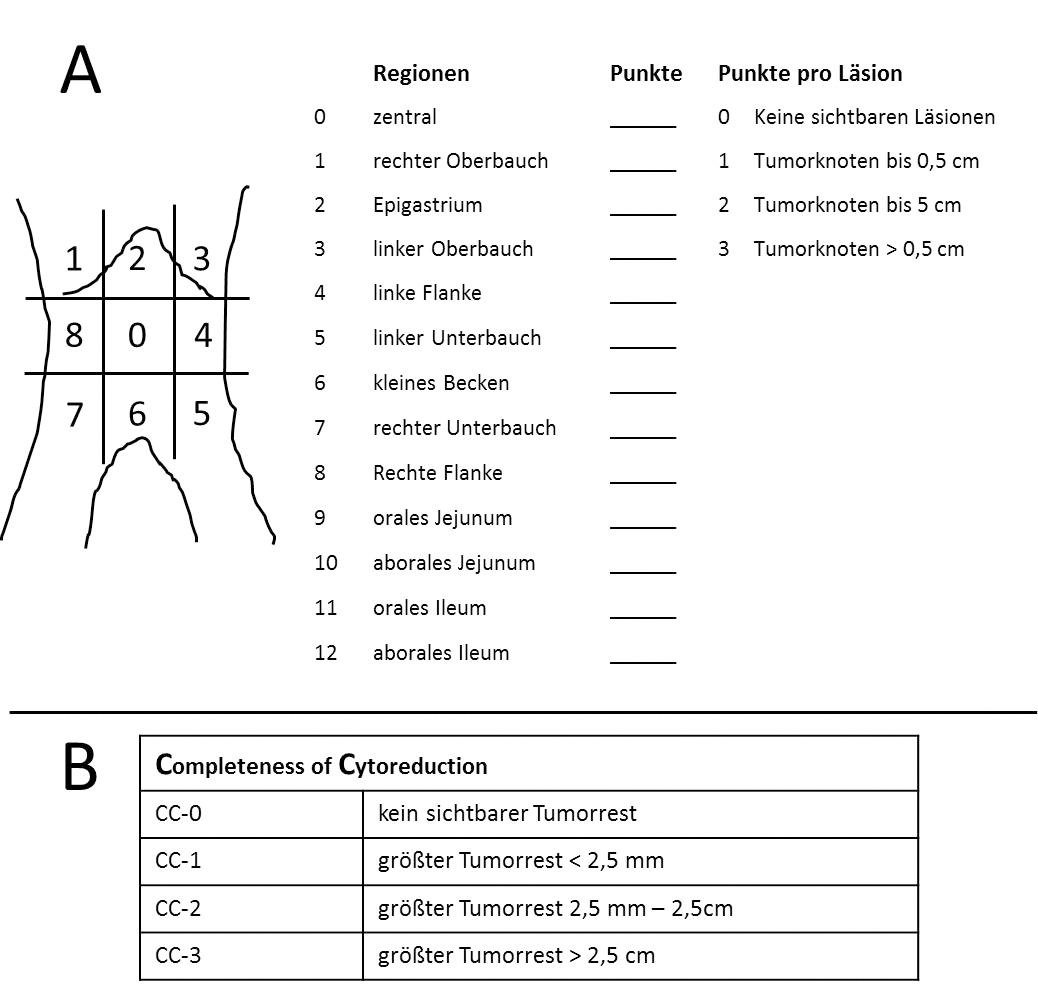
Anamnestische und klinische Untersuchungen sind bei der Diagnose der Peritonealkarzinose wenig wegweisend. Zuverlässiger sind die bildgebenden Staginguntersuchungen durch CT und/oder PET-CT, mit Hilfe derer die Peritonealkarzinose mit einer Sensitivität von 91 % bzw. 82 % nachzuweisen ist [Pasqual 2014]. Die Ausdehnung der Peritonealkarzinose lässt sich sicher nur durch eine operative Exploration nachweisen, wobei die diagnostische Laparoskopie hilfreich ist. Für die Beschreibung der Ausdehnung der Peritonealkarzinose wird am häufigsten der Peritoneal Cancer Index (PCI, Washington Cancer Institute) verwendet. Die Werte liegen zwischen 0 und 39 (Abb. 1).
Abb. 1: A: Peritoneal Cancer Index [modifiziert nach Sugarbaker 1995], B: Completeness of Cytoreduction Score
Chirurgische Zytoreduktion und HIPEC
Zur vollständigen Entfernung der sichtbaren Peritonealkarzinose wird die chirurgische Resektion des parietalen und viszeralen Peritoneums situationsadaptiert durchgeführt. In diesem Zusammenhang wird die Omentektomie durchgeführt und zur kompletten Resektion Peritoneums im kleinen Becken bei häufig dort lokalisierten Tumorherden wird das hier anhaftende Rektum bis unmittelbar unterhalb der peritonealen Umschlagsfalte reseziert. Je nach Ausmaß der Peritonealkarzinose sind Eingriffe bis zur multiviszeralen Resektion notwendig. Kritisch und häufig limitierend ist der Befall des Dünndarms, wobei die Tumore entweder durch Segmentresektionen oder durch lokale Destruktion durch z. B. Elektrokoagulation entfernt werden. Die Qualität der chirurgischen Zytoreduktion wird abschließend bewertet und mit dem „Completeness of Cytoreduction Score“ (CC) abgebildet (Abb. 1).
Die HIPEC erfolgt unmittelbar im Anschluss an die Zytoreduktion und wird am offenen oder geschlossenen Abdomen durchgeführt. Neben der gegenüber der systemischen Chemotherapie erhöhten intraperitonealen Konzentration werden durch die Hyperthermie auf 42-43°C die Gewebepenetration erhöht und direkte zytotoxisch Effekte erzielt. Die Applikation der Chemotherapie erfolgt über mehrere Zu- und Ablaufdrainagen, die im Bauchraum platziert werden. Rollerpumpen und Wärmetauscher sorgen für eine gleichmäßige Perfusion bei angestrebter Zieltemperatur. Die Dauer der Perfusion ist abhängig von den verwendeten Zytostatika. Die Auswahl der Zytostatika und Perfusionsprotokolle ist uneinheitlich, am häufigsten werden Cisplatin, Mitomycin und – in den letzten Jahren zunehmend – Oxaliplatin eingesetzt.
Pseudomyxoma peritonei
Das Pseudomyxoma peritonei ist eine durch schleimigen Aszites gekennzeichnete, häufig von einem perforierten epithelialen Appendixkarzinom ausgehende Krankheit mit einer multifokalen peritonealen epithelialen Aussaat. Histologisch werden drei Typen unterschieden: low-grade Tumore als disseminierte peritoneale Adenomukose (DPAM), high-grade Tumore als peritoneale muzinöse Karzinomatose (PMCA) und ein Intermediärtyp. Die Prognose der Erkrankung konnte mit der Einführung der zytoreduktiven Chirurgie und anschließender HIPEC deutlich verbessert werden, wobei neben dem histologischen Typ (10-Jahreseüberlebensrate 67% bei DPAM vs. 40,7% bei PMCA [Deraco 2006] vor allem die Vollständigkeit der Zytoreduktion (10-Jahresüberlebensrate beträgt 78,9% bei CC-0/1 vs. 0% bei CC-2/3) Einfluss auf das Gesamtüberleben zeigten. Die Arbeitsgruppe um Chua konnte in einer retrospektiven multizentrischen Studie zeigen, dass neben dem Alter vorangegangene Chemotherapiezyklen, der histologische Subtyp PMCA, ein hoher PCI und die Unvollständigkeit der Zytoreduktion (CC-2/3) einen negativen Einfluss auf das Langzeitüberleben hatten[Chua 2012].
Peritoneales Mesotheliom
Das peritoneale Mesotheliom ist ein sehr seltener aber schnell und aggressiv wachsender Tumor, der von der Serosa des Peritoneums ausgeht. Die Inzidenz des Astbestexposition-assoziierten Tumors liegt zwischen 0.5–3.0 pro 1.000.00 pro Jahr bei Männern und zwischen 0.2–2.0 pro 1.000.000 pro Jahr bei Frauen [Bridda 2007 und Boffeta, 2007]. Die Diagnose der Erkrankung wird häufig durch das Fehlen von charakteristischen Frühsymptomen verzögert, klassische Therapieformen mit palliativer Resektion und systemischer Chemotherapie resultierten in medianen Überlebensraten zwischen 9 und 15 Monaten. Durch die Kombination kompletter zytoreduktiven Chirurgie undHIPEC mit Cisplatin und Doxorubicinwurde die mediane Überlebensrate auf 50 – 60 Monate verlängert [Sugarbaker 2002; Sterman 2005]. Auch hier stellt die Vollständigkeit der Zytoreduktion einen wesentlichen Prognosefaktor dar [Konstantinidis 2012].
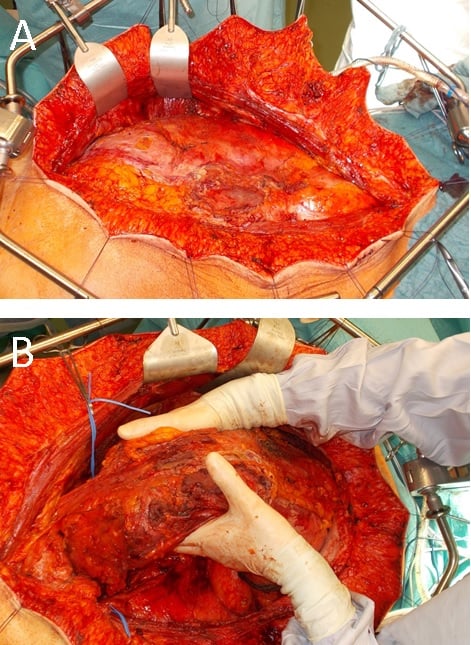
Abb. 2: A. Intraoperativer Situs nach kompletter Präparation des parietalen Peritoneums bei einem Patienten mit peritonealem Mesotheliom. Der peritoneale Sack bleibt bei diesem initialen Präparationsschritt geschlossen. B. Situs nach der beidseitigen Präparation des parietalen Peritoneums bis zur Mesenterialwurzel. Beide Ureteren wurden angeschlungen.
Primäres peritoneales Karzinom
Die primären peritonealen Karzinome machen ca. 10 % der serösen Karzinome des Beckens aus. Die Pathogenese wird kontrovers diskutiert. Fest steht, dass die primären peritonealen Karzinome sich klinisch und histologisch ähnlich zu fortgeschrittenen Stadien des Ovarialkarzinoms verhalten [Bloss 1993]. Insgesamt zeigt sich eine sehr schlechte Prognose: Die 5 Jahresüberlebensrate liegt zwischen 0 und 26,5 % [Fromm 1990]. Bisher sind keine Studien zur Effektivität der Kombination von Zytoreduktion und HIPEC bei der Therapie von primären peritonealen Karzinomen erfolgt.
Peritonealkarzinose vom kolorektalen Karzinom
Bei kolorektalen Karzinomen liegt in 10 bis 15 % der Fälle bei Erstdiagnose bereits eine Peritonealkarzinose vor, bei einem Viertel dieser Patienten finden sich keine weiteren Fernmetastasen [Dawson 1983, Brodsky 1991]. Die Zytoreduktion und HIPEC ist in der aktuellen Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) von 2013 als Option für die Therapie der Peritonealkarzinose bei KRK mit dem Empfehlungsgrad 0 implementiert worden. Der Evidenzlevel 2a beruhte auf der bis dato einzigen abgeschlossenen randomisiert kontrollierten Studie. Bei diesem in 2003 publizierten Dutch-Trial wurden 105 Patienten mit Peritonealkarzinose bei kolorektalem Primarius ohne hämatogene Metastasierung zwischen 1998 bis 2001 eingeschlossen. Die Patienten im Kontrollarm erhielten eine Chemotherapie mit 5-Fluoruracil und Leucovorin mit oder ohne palliative Chirurgie. Die Patienten im experimentellen Arm erhielten vor der identischen Chemotherapie eine Zytoreduktion und HIPEC mit Mitomycin C. Es konnte ein signifikant verbessertes medianes Überleben zugunsten der HIPEC-Gruppe demonstriert werden (22,3 vs. 12,6 Monate, p=0,032). Schwächen der Studie bestehen in dem veralteten Chemotherpieprotokoll, der fehlenden Informationen zur Art der palliativen Chirurgie im Kontrollarm und der nicht ausgeglichene Zahl der Appendix- (n=18) und Rektumkarzinome (n=12) [Verwaal 2003]. Darüber hinaus wurde der Effekt der chirurgischen Zytoreduktion und HIPEC bisher in einigen retrospektiven Fall-Kontroll-Studien untersucht. Hervorzuheben sind die Ergebnisse von Elias et al. aus 2009, die an einem selektionierten Patientengut mit vollständig resektabler Peritonealkarzinose ohne weitere Fernmetastasen (n=48) durch eine Kombination aus Zytoreduktion und HIPEC mit Oxaliplatin und neoadjuvanter Chemotherapie ein medianes Überleben von 62,7 Monaten vs. 23,9 Monaten und eine 5-Jahresüberlebensrate von 51 % vs. 13 % in der Kontrollgruppe (p<0,05; systemische Chemotherapie mit oder ohne palliative Tumorresektion) erreichten [Elias 2009]. Insbesondere der Effekt der neoadjuvanten und adjuvanten Chemotherapie beim peritoneal metastasierten Kolonkarzinom vom k-RAS Wildtyp wird derzeit in der deutschen COMBATAC-Studie untersucht. In dieser multizentrischen, einarmigen Phase-II Studie werden Patienten mit Peritonealkarzinose neben der vollständigen chirurgischen Zytoreduktion und HIPEC (bidirektional mit Oxaliplatin i.p., 5-FU/Leucovorin i.v.) einer 3-monatigen neoadjuvanten und adjuvanten Chemotherapie mit Folfox/Folfiri und Cetuximab unterzogen.
Zusammenfassend kann bei isoliert peritoneal metastasiertem Kolonkarzinom durch die Kombinationstherapie mit vollständiger chirurgische Zytoreduktion und HIPEC ein 5-Jahresüberleben zwischen 30 und 50 % erreicht werden. Prognostisch entscheidend sind neben der vollständigen Zytoreduktion die Tumorlast mit einem PCI<20 und fehlende hämatogene Organmetastasen.
Peritonealkarzinose vom Magenkarzinom
Bei 10-20 % der Patienten mit einem Magenkarzinom wird im Rahmen der Exploration zur elektiven kurativen Gastrektomie eine Peritonealkarzinose diagnostiziert [Roviello 2011; Gill 2011]. Insgesamt zeigt sich beim Vorliegen einer Peritonealkarzinose beim Magenkarzinom eine schlechte Prognose mit einem medianen Gesamtüberleben von 3 bis 6 Monaten [Sadeghi 2000]. Bei 43 % der Patienten mit Magenkarzinom konnten durch peritoneale Spülungen freie intraperitoneale Tumorzellen nachgewiesen werden [Juhl 1994]. Diese Patienten zeigen gegenüber Patienten mit makroskopischen Peritonealkarzinose ein deutlich besseres Überleben mit einer 5-Jahresüberlebensrate zwischen 9,4 und 62,5 % abhängig vom Ausmaß der Lymphknotenmetastasierung.
Beim fortgeschrittenen metastasierten Magenkarzinom ist die Therapie der Wahl die systemische Chemotherapie [Roth 2007]. Allerdings konnten mehrere Studien keinen positiven Effekt auf das Überleben und auf das Ansprechen der Chemotherapie bei vorliegender Peritonealkarzinose nachweisen [Al-Shammaa 2008 und Ross 2002]. Möglicherweise erreicht die systemisch verabreichte Chemotherapie aufgrund der Blut-Peritoneum-Schranke und der peritonealen Gefäßrarifizierung und somit dem geringen Apoptosepotential der hypoxischen Tumorzellen die peritonealen Tumorzellen schlechter [Al-Shammaa 2008, Gräber 1996]. Die neoadjuvante Chemotherapie beim Magenkarzinom dient zum Downstaging um gegeben falls nicht resektable Magenkarzinome mit einer Peritonealkarzinose in ein Stadium zu überführen in dem eine Resektion möglich ist. Verschiedene Arbeitsgruppen konnten eine partielle Response von 69 % [Inokuchi 2006] oder auch eine komplette Remission von 15, 4 % [Yano 2002] bei allerdings kleinen Patientenkollektiven nachweisen. In den letzten Jahrzehnten wurden mehrere Studien zur chirurgischen Zytoreduktion und HIPEC bei Peritonealkarziose und Magenkarzinom erfolgreich durchgeführt [Gill 2011; Yan 2007]. Das mediane Überleben lag hier zwischen 7,9 und 15 Monaten. Die Arbeitsgruppe um Yonemura konnte bei Patienten mit dem Nachweis freier intraperitonealer Tumorzellen (aber ohne makroskopische Peritonealkarzinose) durch die Kombination von chirurgischer Zytoreduktion und HIPEC das mediane Überleben von 15 auf 48 Monate und die 5-Jahresüberlebensrate von 12 % auf 42 % verlängern [Yonemura 2007]. Glehen et al. untersuchten in einer multizentrischen Studie mit 1290 Patienten die Toxizität und die Prognose nach Zytoreduktion und HIPEC bei nichtgynäkologischen Tumoren mit einer Peritonealkarzinose, 159 dieser Patienten mit einer Peritonealkarzinose bei Magenkarzinom. Hier zeigte sich eine 5-Jahresüberlebensrate von 13 % und ein medianes Überleben von 9,2 Monaten [Glehen , 2010]. Die Bedeutung der vollständigen Zytoreduktion wird durch einige Studien untermauert. Yang et al konnten mediane Überlebenszeiten von 12 Monaten bei CC-0/1 gegenüber 8,2 Monaten bei einem CC-2/3 darstellen [Yang 2011]. Glehen et al. zeigten im Rahmen einer multizentrischen retrospektiven Untersuchung in der Subgruppe der Patienten mit kompletter Zytoreduktion(CC-0) eine 5 Jahresüberlebensrate von 23 % gegenüber 13 % im untersuchten Gesamtkollektiv [Glehen 2010].
Neuere Therapiekonzepte beinhalten bidirektionale Chemotherapieapplikationen in Form einer kombinierten systemischen und intraperitonealen Chemotherapie in neoadjuvanter (neoadjuvant intraperitoneal and systemic, NIPS) oder adjuvanter Strategie (early postoperative intraperitoneal Chemotherapy, EPIC). Die Arbeitsgruppe um Yonemura konnte durch eine kombinierte Therapie mit 2 Zyklen NIPS (S-1 i.v. und Taxotere/Cisplatin i.p.) gefolgt von chirurgischer Zytoreduktion und HIPEC eine 5-Jahresübensrate von 16 % und ein medianes Überleben von 14,4 Monaten erreichen. Dabei wurde wiederum ein signifikanter Unterschied zwischen der CC-0 und CC-1-3 Gruppe beobachtet mit einer 5-Jahresüberlebensrate von 21 % vs. 0 %.Signifikanten Einfluss auf das Überleben hatten darüber hinaus ein PCI <6 und das histologische Ansprechen auf die neoadjuvante Chemotherapie (NIPS). [Yonemura 2012]. In Deutschland wurde zur Untersuchung der HIPEC beim peritoneal metastasierten Magenkarzinom die GASTRIPEC-Studie initiiert. In dieser multizentrischen Phase-III-Studie werden die Patienten (n=180) nach Staginglaparoskopie und Randomisierung im Kontrollarm mit 3-Zyklen Epirubicin, Oxaliplatin und Capecitabin bzw. bei HER-2-Positivität mit Cisplatin, Capecitabin und Trastuzumab neoadjuvant i.v.-chemotherapiert. Danach wird eine chirurgische Zytoreduktion durchgeführt, gefolgt von 3 weiteren Zyklen Chemotherapie. Im experimentellen Arm wird zusätzlich eine HIPEC (Cisplatin und Mitomycin C) im Rahmen der chirurgischen Zytoreduktion appliziert.
Insgesamt scheint die Kombination aus vollständiger Zytoreduktion und HIPEC das Überleben beim fortgeschrittenen Magenkarzinom mit Peritonealkarzinose zu verlängern. Dieser positive Effekt bleibt jedoch überwiegend Patienten ohne weitere Fernmetastasen und mit einer lokalisierten Peritonealkarzinose mit einem PCI < 10 vorbehalten.
Peritonealkarzinose vom Ovarialkarzinom
Das Auftreten der Peritonealkarzinose stellt das entscheidende Problem beim Ovarialkarzinom dar. Die Peritonealkarzinose wird in 75% der Fälle bei Erstdiagnose des Ovarialkarzinoms nachgewiesen und ist die Haupttodesursache. Die etablierte Therapie besteht in der vollständigen chirurgischen Zytoreduktion und der adjuvanten Chemotherapie mit Cisplatin/Carboplatin und Paclitaxel. Es konnte gezeigt werden, dass das Überleben der Patientinnen mit der Vollständigkeit der Zytoreduktion korreliert [Elattar 2011]. Das mediane Gesamtüberleben der Patientinnen mit einer vollständigen Zytoreduktion beträgt 46,5 -106 Monate gegenüber 12-39 Monaten bei Patientinnen mit Resttumorgewebe (>1 cm) [Bereder 2009; Song 2011; Chang 2012; Ozols 2003; Armstrong 2006].
Seit den 1980er-Jahren wurde die intraperitoneale Chemotherapie beim peritoneal metastasierten Ovarialkarzinom etabliert. In randomisierten Phase III-Studien [Armstrong 2006; Markman 2001] konnte gezeigt werden, dass die intraperitoneal applizierte Chemotherapie der intravenösen Standardtherapie bei fortgeschrittenen Ovarialkarzinomen mit Peritonealkarzinose hinsichtlich des medianen Gesamtüberlebens (66 Monate vs. 50 Monate) und des krankheitsfreien Überlebens (24 Monate vs. 18 Monate überlegen ist. Allerdings sind diese Überlebensraten durch die intraperitoneale Chemotherapie häufig mit schweren Nebenwirkungen durch die intraperitonealen Katheter vergesellschaftet, die in bis zu 60 % zum Therapieabbruch führten [Armstrong 2006]. Dennoch wurde die intraperitoneale Chemotherapie vom National Comprehensive Cancer Network zur Therapie des epithelialen Ovarialkarzinoms im Stadium III empfohlen [Morgan 2011].
In zahlreichen, zumeist nicht-randomisierten Studien mit kleinen Fallzahlen wurde der Effekt der Kombination aus chirurgischer Zytoreduktion und HIPEC bei der Peritonealkarzinose des fortgeschrittenen Ovarialkarzinoms untersucht. Dabei konnten 3-Jahresüberlebensraten von 35 bis 63 % und 5-Jahresüberlebensraten von 12 bis 66 % ermittelt werden. Das krankheitsfreie Überleben lag dabei zwischen 11 und 26 Monaten. Die perioperative Mortalität schwankte zwischen 0 bis 10 % und die Morbidität lag insgesamt zwischen 0 bis 40 % [Piso 2004; Gori 2005; Zanon 2004; Pavlov 2009; Fagotti 2009; Ryu 2004; Reichman 2005; Raspagliesi 2006; Rufian 2006; Helm 2007; Cotte 2007; Di Giorgio 2008, De Bree 2003; Chatzigeorgiou 2003; Bae 2007; Guardiola 2009]. Die unterschiedlichen Ergebnisse ergeben sich aus den variierenden Krankheitsstadien, der Vollständigkeit der Zytoreduktion und uneinheitlichen Protokollen der HIPEC. Insgesamt erscheinen die Ergebnisse aus den bisherigen Studien vergleichbar mit denen der Standardtherapie. Bisher fehlen prospektive randomisierte Studien zur Untersuchung des Effekts der HIPEC zusätzlich zur bisherigen Standardtherapie. Mehrere solche Studien befinden sich aktuell in der Planung oder sind bereits angelaufen.
Insgesamt gibt es einige Hinweise, dass die Hinzunahme der HIPEC zur bereits standardisiert durchgeführten chirurgischen Zytoreduktion und adjuvanten Chemotherapie zu einer Verbesserung des Überlebens bei akzeptabler Mortalität und Morbidität führt. Bei bis dato fehlender Evidenz sollte die HIPEC beim Ovarialkarzinom jedoch im Rahmen von Studien durchgeführt werden.
Literatur
Al-Shammaa HA, Li Y, Yonemura Y: Current status and future strategies of cytoreductive surgery plus intraperitoneal hyperthermic chemotherapy for peritoneal carcinomatosis. World J Gastroenterol. 2008 Feb 28;14(8):1159-66.
Armstrong DK, Bundy B, Wenzel L, Huang HQ, Baergen R, Lele S, Copeland LJ, Walker JL, Burger RA: Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N Engl J Med 2006;354: 34-43.
Bae JH, Lee JM, Ryu KS, Lee YS, Park YG, Hur SY, Ahn WS, Namkoong SE: Treatment of ovarian cancer with paclitaxelor carboplatin-based intraperitoneal hyperthermic chemotherapy during secondary surgery. Gynecol Oncol 2007; 106: 193-200.
Bereder J, Glehen O, Habre J, Desantis M, Cotte E, Mounier N, Ray-Cocquard I, Karimdjee B, Bakrin N, Bernard J, Benchimol D, Gilly F: Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from ovarian cancer: a multiinstitutional study of 246 patients. J Clin Oncol 2009; 27: abstract 5542
Bloss JD, Liao SY, Buller RE, Manetta A, Berman ML, McMeekin S, Bloss LP, DiSaia PJ: Extraovarian peritoneal serous papillary carcinoma: a case-control retrospective comparison to papillary adenocarcinoma of the ovary. Gynecol Oncol. 1993 Sep;50(3):347-51.
Brodsky JT, Cohen AM.Peritoneal seeding following potentially curative resection of colonic carcinoma: implications for adjuvant therapy.Dis Colon Rectum. 1991 Aug;34(8):723-7.
Bridda A, Padoan I, Mencarelli R, Frego M: Peritoneal mesothelioma: a review. MedGenMed. 2007 May 10; 9(2):32.
Boffetta P: Epidemiology of peritoneal mesothelioma: a review. Ann Oncol. 2007 Jun; 18(6):985-90
Di Giorgio A, Naticchioni E, Biacchi D, Sibio S, Accarpio F, Rocco M, Tarquini S, Di Seri M, Ciardi A, Montruccoli D, Sammartino P. Cytoreductive surgery (peritonectomy procedures) combined with hyperthermic intraperitoneal chemotherapy (HIPEC) in the treatment of diffuse peritoneal
carcinomatosis from ovarian cancer. Cancer 2008; 113: 315-325.
avaliere F, Perri P, Di Filippo F, Giannarelli D, Botti C, Cosimelli M, Tedesco M, Principi F, Laurenzi L, Cavaliere R: Treatment of peritoneal carcinomatosis with intent to cure. J Surg Oncol 2000; 74: 41-44.
Chang SJ, Bristow RE, Ryu HS. Impact of complete cytoreduction leaving no gross residual disease associated with radical cytoreductive surgical procedures on survival in advanced ovarian cancer. Ann Surg Oncol 2012; 19: 4059-4067.
Chatzigeorgiou K, Economou S, Chrysafis G, Dimasis A, Zafiriou G, Setzis K, Lyratzopoulos N, Minopoulos G, Manolas K, Chatzigeorgiou N: Treatment of recurrent epithelial ovarian cancer with secondary cytoreduction and continuous intraoperative intraperitoneal hyperthermic chemoperfusion(CIIPHCP). Zentralbl Gynakol 2003; 125: 424-429.
Chua TC, Moran BJ, Sugarbaker PH, Levine EA, Glehen O, Gilly FN, Baratti D, Deraco M, Elias D, Sardi A, Liauw W, Yan TD, Barrios P, Gómez Portilla A, de Hingh IH, Ceelen WP, Pelz JO, Piso P, González-Moreno S, Van Der Speeten K, Morris DL: Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol. 2012 Jul 10;30(20):2449-56.
Cotte E, Glehen O, Mohamed F, Lamy F, Falandry C, Golfier F, Gilly FN: Cytoreductive surgery and intraperitoneal chemo-hyperthermia for chemo-resistant and recurrent advanced epithelial ovarian cancer: prospective study of 81 patients. World J Surg 2007; 31: 1813-1820.
de Bree E, Romanos J, Michalakis J, Relakis K, Georgoulias V, Melissas J, Tsiftsis DD. Intraoperative hyperthermic intraperitoneal chemotherapy with docetaxel as second-line treatment for peritoneal carcinomatosis of gynaecological origin. Anticancer Res 2003; 23: 3019-3027.
Dawson LE, Russell AH, Tong D, Wisbeck WM. Adenocarcinoma of the sigmoid colon: sites of initial dissemination and clinical patterns of recurrence following surgery alone. J Surg Oncol. 1983 Feb;22(2):95-9
Deraco M, Kusamura S, Laterza B, Favaro M, Fumagalli L, Costanzo P, Baratti D: Cytoreductive surgery and hyperthermic intra-peritoneal chemotherapy (HIPEC) in the treatment of pseudomyxoma peritonei: ten years experience in a single center. In Vivo 2006 Nov-Dec;20(6A):773-6.
Elattar A, Bryant A, Winter-Roach BA, Hatem M, Naik R: Optimal primary surgical treatment for advanced epithelial ovarian cancer. Cochrane Database Syst Rev. 2011 Aug 10;(8):CD007565.
Fagotti A, Paris I, Grimolizzi F, Fanfani F, Vizzielli G, Naldini A, Scambia G: Secondary cytoreduction plus oxaliplatinbased HIPEC in platinum-sensitive recurrent ovarian cancer patients: a pilot study. Gynecol Oncol 2009; 113: 335-340.
Fromm GL, Gershenson DM, Silva EG: Papillary serous carcinoma of the peritoneum. Obstet Gynecol. 1990 Jan;75(1):89-95.
Gill RS, Al-Adra DP, Nagendran J, Campbell S, Shi X, Haase E, Schiller D: Treatment of gastric cancer with peritoneal carcinomatosis by cytoreductive surgery and HIPEC: a systematic review of survival, mortality, and morbidity. J Surg Oncol. 2011 Nov 1;104(6):692-8.
Glehen O, Gilly FN, Arvieux C, Cotte E, Boutitie F, Mansvelt B, Bereder JM, Lorimier G, Quenet F, Elias D: Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy. Ann Surg Oncol 2010, 17(9):2370–2377
Gori J, Castaño R, Toziano M, Häbich D, Staringer J, De Quirós DG, Felci N. Intraperitoneal hyperthermic chemotherapy in ovarian cancer. Int J Gynecol Cancer 2005; 15: 233-239.
Graeber TG, Osmanian C, Jacks T, Housman DE, Koch CJ, Lowe SW, Giaccia AJ: Hypoxia-mediated selection of cells with diminished apoptotic potential in solid tumours.Nature. 1996 Jan 4;379(6560):88-91.
Guardiola E, Delroeux D, Heyd B, Combe M, Lorgis V, Demarchi M, Stein U, Royer B, Chauffert B, Pivot X: Intraoperative intra-peritoneal chemotherapy with cisplatin in patients with peritoneal carcinomatosis of ovarian cancer. World J Surg Oncol 2009; 7: 14.
Helm CW, Randall-Whitis L, Martin RS, Metzinger DS, Gordinier ME, Parker LP, Edwards RP: Hyperthermic intraperitoneal chemotherapy in conjunction with surgery for the treatment of recurrent ovarian carcinoma. Gynecol Oncol 2007; 105: 90-96.
Inokuchi, Yamashita T, Yamada H, Kojima K, Ichikawa W, Nihei Z, Kawano T, SugiharaK :Phase I/II study of S-1 combined with irinotecan for metastatic advanced gastric cancerBr J Cancer. 2006 April 24; 94(8): 1130–1135.
Juhl H, Stritzel M, Wroblewski A, Henne-Bruns D, Kremer B, Schmiegel W, Neumaier M, Wagener C, Schreiber HW, Kalthoff H. Immunocytological detection of micrometastatic cells: comparative evaluation of findings in the peritoneal cavity and the bone marrow of gastric, colorectal and pan-creatic cancer patients. Int J Cancer 1994; 57: 330-335
Konstantinidis IT, Young C, Tsikitis VL, Lee E, Jie T, Ong ES: Cytoreductive surgery and hyperthermic intraperitoneal chemoperfusion: The University of Arizona early experience. World J Gastrointest Surg. 2012 Jun 27; 4(6):135-40.
Markman M, Bundy BN, Alberts DS, Fowler JM, Clark-Pearson DL, Carson LF : Phase III trial of standard-dose intravenous cisplatin plus paclitaxel versus moderately high-dose carboplatin followed by intravenous paclitaxel and intraperitoneal cisplatin in small-volume stage III ovarian carcinoma: an intergroup study of the Gynecologic Oncology Group, Southwestern Oncology Group, and Eastern Cooperative Oncology Group. J Clin Oncol. 2001 Feb 15;19(4):1001-7.
Morgan RJ Jr, Alvarez RD, Armstrong DK, Boston B, Burger RA, Chen LM, Copeland L, Crispens MA, Gershenson D, Gray HJ, Grigsby PW, Hakam A, Havrilesky LJ, Johnston C, Lele S, Matulonis UA, O’Malley DM, Penson RT, Remmenga SW, Sabbatini P, Schilder RJ, Schink JC, Teng N, Werner TL; National Comprehensive Cancer Network. Epithelial ovarian cancer.J Natl Compr Canc Netw. 2011 Jan;9(1):82-113.
Ozols RF, Bundy BN, Greer BE, Fowler JM, Clarke-Pearson D, Burger RA, Mannel RS, DeGeest K, Hartenbach EM, Baergen R: Phase Ⅲ trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage Ⅲ ovarian cancer: a Gynecologic Oncology
Group study. J Clin Oncol 2003; 21: 3194-3200.
Pasqual EM, Bertozzi S, Bacchetti S, Londero AP, Basso SM, Santeufemia DA, Lo Re G, Lumachi F. Preoperative assessment of peritoneal carcinomatosis in patients undergoing hyperthermic intraperitoneal chemotherapy following cytoreductive surgery.Anticancer Res. 2014 May;34(5):2363-8.
Pavlov MJ, Kovacevic PA, Ceranic MS, Stamenkovic AB, Ivanovic AM, Kecmanovic DM. Cytoreductive surgery and modified heated intraoperative intraperitoneal chemotherapy
(HIPEC) for advanced and recurrent ovarian cancer — 12-year single center experience. Eur J Surg Oncol 2009; 35: 1186-1191.
Piso P, Dahlke MH, Loss M, Schlitt HJ. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in peritoneal carcinomatosis from ovarian cancer. World J Surg Oncol 2004; 2: 21.
Raspagliesi F, Kusamura S, Campos Torres JC, de Souza GA, Ditto A, Zanaboni F, Younan R, Baratti D, Mariani L, Laterza B, Deraco M. Cytoreduction combined with intraperitoneal hyperthermic perfusion chemotherapy in advanced/ recurrent ovarian cancer patients: The experience of National Cancer Institute of Milan. Eur J Surg Oncol 2006; 32: 671-675.
Reichman TW, Cracchiolo B, Sama J, Bryan M, Harrison J, Pliner L, Harrison LE. Cytoreductive surgery and intraoperative hyperthermic chemoperfusion for advanced ovarian carcinoma. J Surg Oncol 2005; 90: 51-56.
Robinson BW, Lake RA: Advances in malignant mesothelioma. N Engl J Med. 2005 Oct 13; 353(15):1591-603.
Ronnett BM, Zahn CM, Kurman RJ, Kass ME, Sugarbaker PH, Shmookler BM: Disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. A clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis, and relationship to “pseudomyxoma peritonei”. Am J Surg Pathol. 1995 Dec; 19(12):1390-408.
Ross P, Nicolson M, Cunningham D, Valle J, Seymour M, Harper P, Price T, Anderson H, Iveson T, Hickish T, Lofts F, Norman A: Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU) With epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer. J Clin Oncol. 2002 Apr 15;20(8):1996-2004.
Roth AD, Fazio N, Stupp R, Falk S, Bernhard J, Saletti P, Köberle D, Borner MM, Rufibach K, Maibach R, Wernli M, Leslie M, Glynne-Jones R, Widmer L, Seymour M, de Braud F; Swiss Group for Clinical Cancer Research: Docetaxel, cisplatin, and fluorouracil; docetaxel and cisplatin; and epirubicin, cisplatin, and fluorouracil as systemic treatment for advanced gastric carcinoma: a randomized phase II trial of the Swiss Group for Clinical Cancer Research. J Clin Oncol. 2007 Aug 1;25(22):3217-23.
Roviello F, Caruso S, Marrelli D, Pedrazzani C, Neri A, De Stefano A, Pinto E. Treatment of peritoneal carcinomatosis with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: state of the art and future developments. Surg Oncol. 2011 Mar;20(1):e38-54.
Rufián S, Muñoz-Casares FC, Briceño J, Díaz CJ, Rubio MJ, Ortega R, Ciria R, Morillo M, Aranda E, Muntané J, Pera C: Radical surgery-peritonectomy and intraoperative intraperitoneal chemotherapy for the treatment of peritoneal carcinomatosis in recurrent or primary ovarian cancer. J Surg Oncol 2006; 94: 316-324.
Ryu KS, Kim JH, Ko HS, Kim JW, Ahn WS, Park YG, Kim SJ, Lee JM: Effects of intraperitoneal hyperthermic chemotherapy in ovarian cancer. Gynecol Oncol 2004; 94: 325-332.
Sadeghi B, Arvieux C, Glehen O, Beaujard AC, Rivoire M, Baulieux J, Fontaumard E, Brachet A, Caillot JL, Faure JL, Porcheron J, Peix JL, François Y, Vignal J, Gilly FN: Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer. 2000 Jan 15;88(2):358-63.
Song YJ, Lim MC, Kang S, Seo SS, Kim SH, Han SS, Park SY: Extended cytoreduction of tumor at the porta hepatis by an interdisciplinary team approach in patients with epithelial ovarian cancer. Gynecol Oncol 2011; 121: 253-257.
Sugarbaker PH, Jablonski KA.Prognostic features of 51 colorectal and 130 appendiceal cancer patients with peritoneal carcinomatosis treated by cytoreductive surgery and intraperitoneal chemotherapy.Ann Surg. 1995 Feb;221(2):124-32.
Sugarbaker PH, Acherman YI, Gonzalez-Moreno S, Ortega-Perez G, Stuart OA, Marchettini P, Yoo D:
Diagnosis and treatment of peritoneal mesothelioma: The Washington Cancer Institute experience.
Semin Oncol. 2002 Feb; 29(1):51-61.
Sterman DH, Albelda SM: Advances in the diagnosis, evaluation, and management of malignant pleural mesothelioma. Respirology. 2005 Jun; 10(3):266-83.
Valle M, Garafalo A: Laparoscopic staging of peritoneal surface malignancies. Eur J Surg Oncol. 2006 Aug;32(6):625-7.
Yan TD, Black D, Sugarbaker PH, Zhu J, Yonemura Y, Petrou G, Morris DL: A systematic Review and meta-analysis oft he randomized controlled trials on adjuvant intraperitoneal chemotherapy for resectable gastric cancer. Ann Surg Oncol 2007; 14: 2702-13.
Yang XJ, Huang CQ, Suo T, Mei LJ, Yang GL, Cheng FL, Zhou YF, Xiong B, Yonemura Y, Li Y: Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy Improves Survival of Patients with Peritoneal Carcinomatosis from Gastric Cancer: Final Results of a Phase III Randomized Clinical Trial. Ann Surg Oncol. 2011 June; 18(6): 1575–1581.
Yano M, Shiozaki H, Inoue M, Tamura S, Doki, Yasuda T, Fujiwara Y, Tsujinaka T, Monden M: Neoadjuvant Chemotherapy followed by Salvage Surgery: Effect on Survival of Patients with Primary Noncurative Gastric Cancer. Worl J Surg, 2002; 26(9): 1155-1159.
Yonemura Y, Bandou E, Sawa T, Neoadjuvant treatment of gastric cancer with peritoneal dissemination. European Journal of Surgical Oncology. 2006;32(6):661–665.
Yonemura Y, Bando E, Kawamura T, Ito H, Endo Y, Miura M, Kiyosaki K, Sasaki T: Cytoreduction and Intraperitoneal Chemotherapy for Carcinomatosis from Gastric Cancer. Cancer Treat Res 2007; 134: 357-373.
Yonemura Y, Endou Y, Shinbo M, Safety and efficacy of bidirectional chemotherapy for treatment of patients with peritoneal dissemination from gastric cancer: selection for cytoreductive surgery. Journal of Surgical Oncology. 2009;100(4):311–316.
Yonemura Y, Elnemr A, Endou Y, Ishibashi H, Mizumoto A, Miura M, Li Y: Effects of neoadjuvant intraperitoneal/systemic chemotherapy (bidirectional chemotherapy) for the treatment of patients with peritoneal metastasis from gastric cancer. Int J Surg Oncol. 2012; 2012: 148420.
Zanon C, Clara R, Chiappino I, Bortolini M, Cornaglia S, Simone P, Bruno F, De Riu L, Airoldi M, Pedani F. Cytoreductive surgery and intraperitoneal chemohyperthermia for recurrent peritoneal carcinomatosis from ovarian cancer. World J Surg 2004; 28: 1040-1045.
Hoerbelt R./ Griessemer A. / Gehron J. / Padberg W. HIPEC-Verfahren bei der Behandlung der Peritonealkarzinose- Standortbestimmung, aktuelle Datenlage. Passion Chirurgie. 2014 September, 4(09): Artikel 02_04.
Autoren des Artikels
PD Dr. med. Rüdiger Hörbelt
Universitätsklinikum Giessen und Marburg, Standort GiessenKlinik für Allgemein-, Viszeral-, Thorax-, Transplantations- und KinderchirurgieRudolf Buchheim Str. 735385Gießen kontaktierenAnna Griessemer
Universitätsklinikum Giessen und MarburgKlinik für Allgemein-, Viszeral-, Thorax-, Transplantations- und KinderchirurgieStandort GiessenJohannes Gehron
Universitätsklinikum Giessen und MarburgKardiotechnik der Klinik für Herz-, Kinderherz- und GefäßchirurgieStandort GiessenProf. Dr. Winfried Padberg
Universitätsklinikum Giessen und MarburgKlinik für Allgemein-, Viszeral-, Thorax-, Transplantations- und KinderchirurgieStandort GiessenWeitere aktuelle Artikel
10.02.2026 BDC|News
Neue Ausgabe der Passion Chirurgie: Perioperatives Management
erioperatives Management steht im Fokus der Januar/Februar-Ausgabe. Drei Fachbeiträge beleuchten das Thema – von den zehn wichtigsten Maßnahmen im perioperativen Management, über den idealisierten Workflow im Zentral-OP bis hin zur Prähabilitation zwischen theoretischem Anspruch und praktischer Umsetzung. Viel Spaß beim Lesen!
20.01.2026 Fachübergreifend
Prähabilitation – vom theoretischen Ideal zur praktischen Umsetzung
Lange wurde dem Allgemeinzustand von Patient:innen vor onkologischen Eingriffen wenig Aufmerksamkeit geschenkt. Es galt die Devise, den Tumor so rasch wie möglich nach Diagnosestellung zu entfernen.
20.01.2026 Fachübergreifend
Prozessmanagement – Der idealisierte WorKFlow in einem Zentral-OP
Der idealisierte Workflow im Zentral-OP ergibt sich aus einer hochgradig standardisierten und zunehmend digital orchestrierten Prozesslandschaft.
20.01.2026 Fachübergreifend
Perioperatives Management – das sind die 10 wichtigsten Maßnahmen
In der modernen Chirurgie spielen viele Maßnahmen bezüglich eines adäquaten prä-, intra- und postoperativen Managements eine relevante Rolle, um die Krankenhausverweildauer sowie die Morbidität und Mortalität der Patient:innen zu reduzieren.
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.