30.11.2018 Neurochirurgie
Neurochirurgie aktuell

Die spezielle Situation des Gehirns als Organ besteht in seiner Lage innerhalb einer knöchernen Kapsel und der Repräsentation der wesentlichen Funktionen des Körpers, wie der Bewegung, des Sprechens, des Sehens, der Gefühlsempfindung, der vegetativen Funktionen und nicht zuletzt der Kognition und Emotion auf kleinem Raum. Bei pathologischen Prozessen stellt sich daher immer die Frage, inwieweit es möglich ist, krankhafte Veränderungen zu beheben, ohne neue neurologische oder neuropsychologische Ausfälle zu erzeugen. In der Regel ist ein rasches Handeln erforderlich, da zunehmende Raumforderungen nur in engen Grenzen kompensiert werden können, bevor es zu irreversiblen Schäden oder Bewusstlosigkeit kommt. Die wichtigste Forderung ist daher, neben einer maximalen Radikalität bei der Entfernung von krankhaften Prozessen die Hirnfunktionen optimal zu erhalten.
Die Entwicklung der Neurochirurgie stand in den letzten Jahren unter zwei wesentlichen Einflussgrößen: der Technik und der Molekularbiologie.
Exakte anatomische Kenntnisse sind notwendig, um pathologische Prozesse innerhalb des Gehirns und des Rückenmarks genau zu lokalisieren. Die Magnetresonanztomographie hat zu einem perfekten Verständnis der Morphologie geführt. Pathologische Prozesse können genau zugeordnet und durch die Methode der seit den 90er Jahren routinemäßig zur Verfügung stehenden Neuronavigation punktgenau geortet werden. Während auf der Großhirnoberfläche die Funktionen von Bewegung, Gefühl, Sprache und Sehen repräsentiert sind, finden sich in den Stammganglien und dem Hirnstamm komprimiert die Repräsentationen für die langen Bahnen, die Hirnnervenkerngebiete und die vegetativen Zentren. Im Rückenmark laufen dann die Funktionen für Sensibilität und Motorik auf einem kleinen Querschnitt zusammen.
Der vorliegende Beitrag gliedert sich in vier Punkte:
- Klinischer Standard
- Molekularbiologische Diagnostik
- Neue bildgebende Verfahren
- Ausblick in die Zukunft
Klinischer Standard
Zur standardmäßigen präoperativen Vorbereitung von Hirntumorpatienten gehören die Durchführung einer MRT-Untersuchung und die Datenerhebung zur Neuronavigation.
Die Neuronavigation ist fester Bestandteil neurochirurgischer Operationen. Die Zugänge können durch sie Patienten-individuell geplant und minimal gehalten werden. Wertvoll ist die Navigation besonders bei Prozessen, die in der Tiefe des Gehirns liegen. Zugangsbedingte Verletzungen von eloquenten Hirnregionen werden vermieden und Prozesse in der Tiefe des Gehirns zielsicher aufgefunden. Bedingt aussagekräftig ist die Neuronavigation zur Resektionskontrolle. Der „Brain Shift“, eine Verlagerung der Hirnstrukturen durch Liquorverlust und Resektion von Tumorvolumen unter der Operation, verhindert die exakte Zuordnung der intraoperativ gewonnenen Daten, da der zur Verfügung stehende Datensatz auf präoperativen Daten beruht und die neue Situation noch nicht berücksichtigen kann. Forschungsarbeiten befassen sich schon seit langem mit diesem Problem unter dem Stichwort der elastischen Registrierung.
Bei Prozessen in der Nähe von funktionellen Hirnarealen wie den vornehmlichen Sprachregionen (dem Broca- und Wernickezentrum) oder der Bewegungsregion (der Pyramidenbahn) werden zusätzlich eine Darstellung dieser funktionellen Nervenfaserbündel mittels Diffusion Tensor Imaging (DTI) oder ein funktionelles Sprach-MRT (fMRT) durchgeführt. Bei dem DTI handelt es sich um eine Messung der Diffusion der Wassermoleküle durch das Hirngewebe, die man als Anisotropie bezeichnet. An den Fasern der Bahnsysteme werden die Wassermoleküle abgebremst. Dies ermöglicht die Darstellung der Bahnen. Im funktionellen MRT wird über eine Aktivierung der Sprache der BOLD (Blood Oxygenation-Level Dependent) – Effekt ausgelöst, der auf einer vermehrten Sauerstoffausschöpfung und Bildung von Methämoglobin im aktivierten Areal beruht und visuell sichtbar gemacht werden kann. Da diese Untersuchungen über einen speziellen Algorithmus berechnet und gemittelt werden, bilden sie Annäherungen an die tatsächliche Repräsentation der eloquenten Areale und können nicht als absolut angesehen werden. Dennoch sind sie ein essenzieller Punkt für die operative Planung und heute Routine. Unter bestimmten Bedingungen werden Wachoperationen durchgeführt, dies vor allem bei Tumoren in der Nähe zur Sprachregion. Das Gehirn ist nicht schmerzempfindlich. Lediglich zur Trepanation und Duraeröffnung wird eine Lokalanästhesie vorgenommen. Bei Erreichen des Sprachareals führt man ein Brain Mapping durch, d. h. es wird ein elektrischer Stimulus auf die Hirnoberfläche appliziert und zeitgleich der Patient aufgefordert, Gegenstände auf Bildern, die ihm präsentiert werden, zu benennen. Wenn es zu einem „Speech Arrest“ kommt, weiß man, dass hier das Sprachzentrum lokalisiert ist. Dies wird bei der Resektion berücksichtigt.
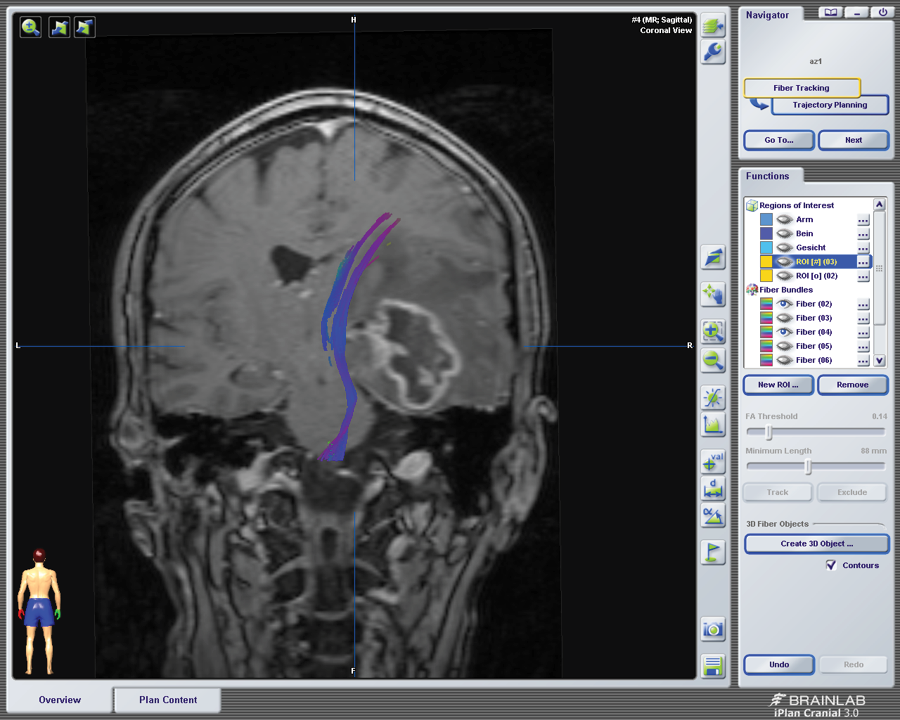
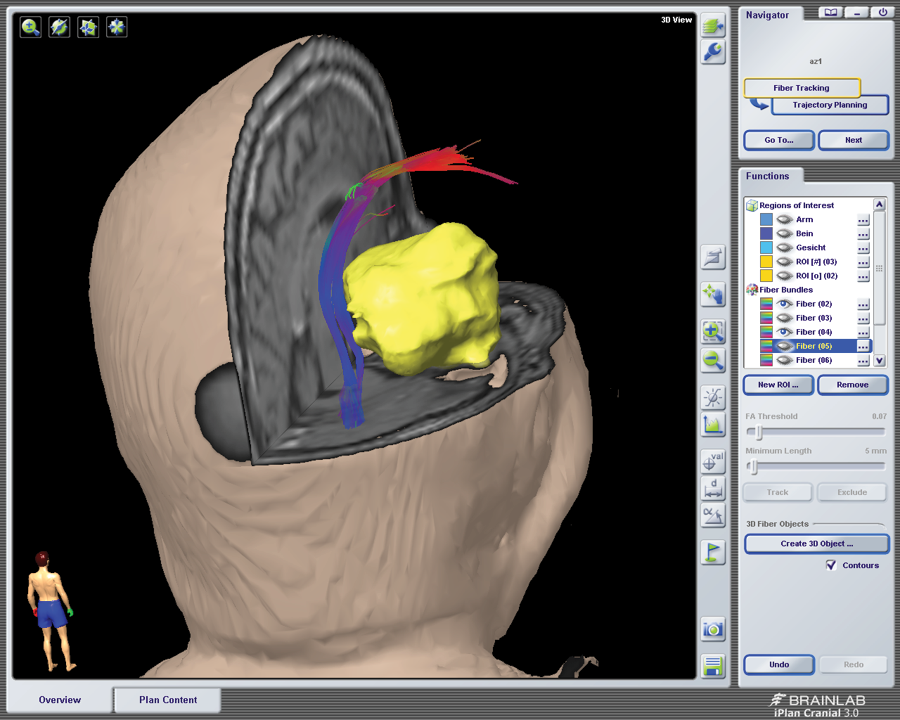
Abb. 1, 2: DTI der Pyramidenbahn (blau und rot) bei temporalem Tumor (gelb)
Ein weiterer wichtiger Pfeiler neurochirurgischer Operationen ist das Neuromonitoring. Dieses hat in den letzten Jahren deutlich an Bedeutung gewonnen und ist fester Bestandteil einer neurochirurgischen Operation in der Nähe zu motorischen Bahnen, den Hirnnerven und ihren Kerngebieten im Hirnstamm. In der Gliomchirurgie kann man sich damit den motorischen Bahnen in der weißen Substanz bis auf wenige Millimeter nähern und den Tumor maximal resezieren, ohne neue neurologische Ausfälle befürchten zu müssen. Bei Cavernomen oder Tumoren im Hirnstamm werden die motorischen Kerngebiete der Nn. facialis, abducens und der kaudalen Hirnnerven auf diese Weise lokalisiert, sodass man in der Lage ist, die operative Eintrittszonen in einer stummen Region zu definieren und die Läsion sicher zu exstirpieren. Bei der Operation von Akustikusneurinomen sind die Facialisstimulation und bei Erhalt des Hörvermögens die Ableitung der akustisch evozierten Potenziale unabdingbare Voraussetzungen für eine sichere Entfernung des Prozesses unter Erhalt der Nervenfunktion. In der Epilepsiechirurgie wird es über ein invasives Monitoring mit Einlegen von Platten- oder Stabelektroden und anschließendem mehrtägigem EEG-Monitoring erst möglich, epileptogene Foci genau zu lokalisieren, in einer Operation zu resezieren und damit Anfallsfreiheit zu erreichen. Auch in der spinalen Chirurgie hat das Neuromonitoring seinen festen Platz. Obligat ist es bei intraduralen und intramedullären Tumoren. Hier kommen die SSEPs, MEPs, die D-Welle und das EMG zum Einsatz. Aber auch bei degenerativen Wirbelsäulenprozessen, oder extraduralen Tumoren mit Spondylektomie setzt sich die elektrophysiologische Überwachung zunehmend durch.
Das intraoperative MRT ist bildgebend die beste Kontrolle, die heutzutage zur Verfügung steht. Besonders bei niedergradigen Gliomen, die sonst nicht darstellbar sind und auch mit dem bloßen Auge unter dem Mikroskop nur schlecht vom normalen Hirngewebe zu differenzieren sind, ist das intraoperative MRT die einzige Möglichkeit, den Befund zu beurteilen. So wird ein resezierbarer Resttumor noch während der Operation erkannt, und der neugewonnene Datensatz kann wieder in die Navigation eingespielt werde, wodurch sie aktualisiert wird, d. h. die Ungenauigkeit durch den „Brain Shift“ entfällt, und das Resektionsergebnis wird optimiert. Die Stärke des MRT liegt in der Beurteilung des Weichgewebes. Ein intraoperatives CT ist nur dann überlegen, wenn es um die Beurteilung von knöchernen Strukturen wie in der Wirbelsäulenchirurgie geht. Die spinale Neuronavigation und ein 3D-C-Bogen erlauben eine optimale Platzierung von und Kontrolle nach Implantation von Schrauben und Cages. Moderne Robotersysteme erleichtern die Positionierung bei Instrumentierungen. An weiteren Perfektionen der Systeme wird gearbeitet.
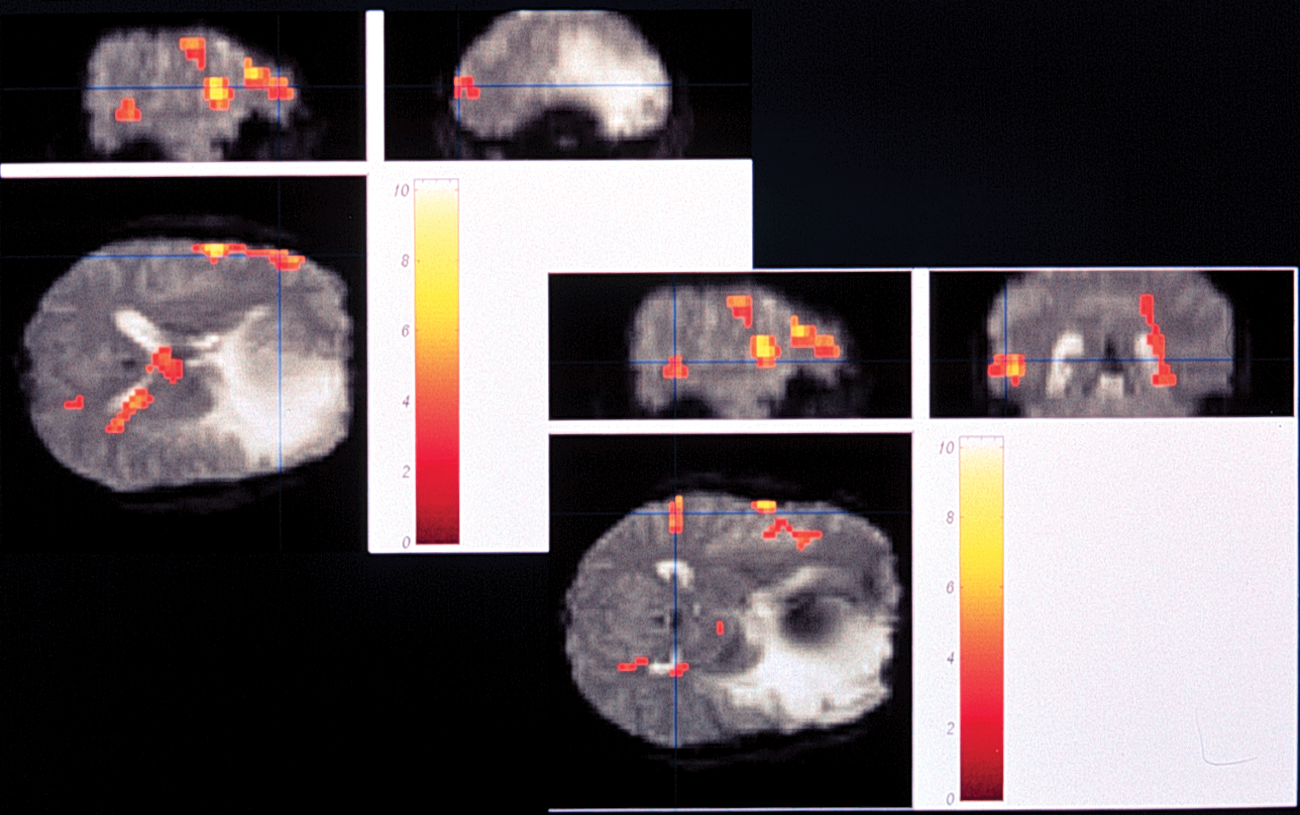
Abb. 3: MRT zur Darstellung des Sprachareals
In der vaskulären Neurochirurgie zeigt sich in den letzten Jahrzehnten ein deutlicher Trend zu interventionellen Eingriffen. Ca. 60 % der Aneurysmen werden heute interventionell mit Coiling versorgt, 40 % werden geclippt. Das Coilen mit Platinelektroden liegt in der Hand der Neuroradiologen. Mit Stents, Flow Divertern und Web Devices entstehen zunehmend Versorgungsmöglichkeiten, die die operativen Verfahren zurückdrängen. Die Aneurysmen des Vertebralis- und Basilarisgebietes sind längst die Domäne der Interventionalisten. Bei den arterio-venösen Malformationen hat sich eine kombinierte Vorgehensweise durchgesetzt. Zunächst wird in der Regel eine Embolisation mit Onyx angestrebt, bei nicht vollständigem Verschluss schließt sich die operative Exstirpation an. Cavernome werden in allen Hirnregionen exstirpiert. Ausgewählte Zugänge ermöglichen selbst die erfolgreiche Exstirpation im Hirnstamm.
Molekulare Diagnostik
Die molekulare Diagnostik von Tumorgewebe hat zu entscheidenden Fortschritten in der Tumortherapie und der Prognose der Patienten geführt. Während man früher glaubte, dass Hirntumoren schon allein auf Grund der Blut-Hirn-Schranke einer Chemotherapie nicht zugänglich seien, kennt man heute genetische Faktoren, die auf eine Chemosensitivität hinweisen, wie eine MGMT-Promotormethylierung, oder ein LOH von 1p/19q. Das Zytostatikum Temozolomid ist in der Therapie von Gliomen neben einer Strahlentherapie mit 60 Gray als Standardtherapie etabliert (Stupp-Schema). Bei älteren Patienten in reduziertem Allgemeinzustand erfolgt die Bestrahlung hypofraktioniert. Nach der neuen WHO Klassifikation von 2016 werden Tumoren nicht mehr vorrangig nach der Histologie, sondern nach ihrer molekularen Signatur beurteilt. So kann es sein, dass ein histologisch als Grad III Gliom klassifizierter Tumor, molekular eher einem Glioblastom (IDH-Wildtyp, EGFR-Amplifikation, PTEN-Mutation, TERT-Promotor-Mutation) entspricht und dann auch so therapiert wird. Die Gliome werden streng nach Oligodendrogliomen mit LOH von 1p und 19q und Astrozytomen mit einer IDH-Mutation eingeteilt. Mischformen, die früher als Oligoastrozytome bezeichnet wurden, gibt es nicht mehr. Der Begriff der Gliomatosis cerebri wird auch nicht mehr gebraucht. Heute spricht man vom diffusen Gliom. Bei Mittelliniengliomen wurde ein neues Gen identifiziert, welches Histon H3.3. codiert und mit einer schlechten Prognose assoziiert ist.
Beim Glioblastom hat sich die mediane Überlebenszeit von weniger als einem Jahr auf inzwischen 18 Monate verlängert. Rezidiveingriffe, Umstellungen der Chemotherapie und modifizierte Strahlenbehandlungen sind Teil der Therapie, und die Quote der Langzeitüberleber ist bei einer kontinuierlichen Betreuung der Patienten und konsequenten Therapie angestiegen. Nicht zuletzt hat die Optimierung der technischen Verfahren diesen günstigen Trend unterstützt. In einer großen EORTC-Studie 1419-BTG werden die Langzeitüberleber weiter analysiert.
Hirntumorpatienten werden möglichst in Studien geführt, die auf molekularbiologischen Befunden beruhen. Die neusten Ergebnisse der CODEL-Studie, d. h. Patienten mit einer Co-Deletion von 1p und 19q, zeigen Überlebenszeiten von mehr als 24 Monaten. Die N2M2 Studie schließt eine patienten-zentrierte Genanalyse ein, auf der die individuelle Therapie spezifisch aufbaut, d. h. die Behandlung der Patienten geht mehr und mehr in Richtung einer personalisierten Medizin.
Neue bildgebende Verfahren
Während es in den letzten Jahrzehnten gut gelungen ist, die morphologischen Strukturen des Gehirns zu bestimmen, ist die Visualisierung von Funktionen intraoperativ eine neue Dimension für das Operieren. Erste Versuche, über eine optische Bildgebung funktionelle Hirnareale zu visualisieren, reichen in die 90er Jahre zurück. Wie bereits in der präoperativen Diagnostik erläutert, kann man die Sprachareale mittels fMRT über den BOLD-Effekt darstellen. Damit ist es möglich, die Seite der dominanten Hemisphäre präoperativ festzulegen und bei Tumoren, die in der Nähe der Sprachregion liegen, den optimalen Zugang zu wählen. Allerdings ist bekannt, dass die Bestimmung, die man im fMRT erhält, sehr variabel ist und man sich hier nur näherungsweise auf die bildgebende Darstellung verlassen kann. Auch mit der PET-Untersuchung ist es möglich, ein aktiviertes Areal aufzuzeigen. In Wachoperation kann die Sprache dagegen direkt und exakt lokalisiert werden. Der Nachteil dieser Methode ist, dass der Patient die Operation mitverfolgen kann und über Stunden seine Liegeposition nicht verändern darf. Dies ist eine große Belastung für den Patienten, aber auch für den Operateur, dessen operative Schritte vom Patienten realisiert werden.
Optical Imaging von funktionellen Arealen
Mit dem Optical Imaging steht ein neues System zur Verfügung. Die Methode basiert auf dem Prinzip, dass es über einen in der Peripherie gesetzten Stimulus, elektrisch, akustisch oder optisch, zu einer Aktivierung in dem korrespondierenden Hirnareal kommt. Dies äußert sich in einer Zunahme des O2-Bedarfs und einer Zunahme des Blutflusses. Es kommt zu einer Vermehrung der Fraktion des oxygenierten Hämoglobins, das zu einer Veränderung im Absorptionsmuster des perfundierten Hirnareals führt. Über bestimmte Filter, die dem optischen System (der Kamera) vorgesetzt werden, kann nun über unterschiedliche Wellenlängen eine Charakteristik des Hirngewebes vorgenommen werden. Bei 570 nm wird die Veränderung des Blutflusses gemessen, bei 600 nm zeigt sich die Veränderung der Oxygenierung. Man sieht einen Unterschied in der Absorption von Oxy- und Desoxyhämoglobin. Damit ist es möglich, in Echtzeit ein aktiviertes Hirnareal intraoperativ zu identifizieren. So können sensible Areale, die Sprachregion, der visuelle Kortex und der motorische Kortex dargestellt werden. Diese Methode wird zukünftig als ein weiteres Modul für die Routine zur Verfügung stehen.
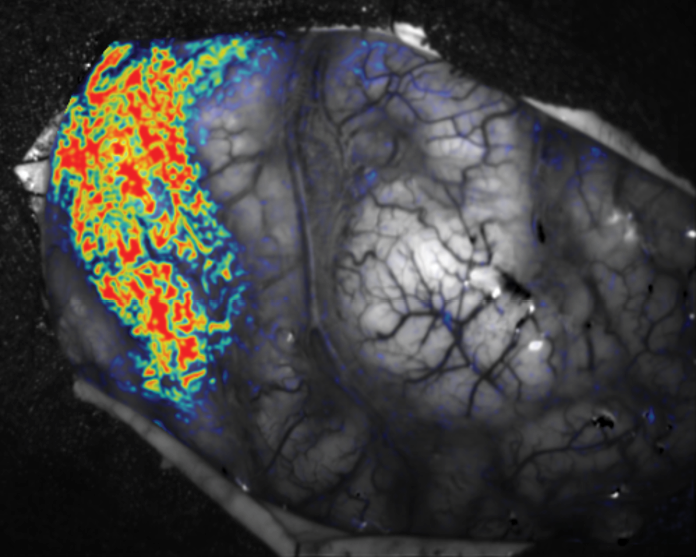
Abb. 4: Intraoperatives Bild des sensorischen Kortex nach N. medianus Stimulation mit Optical Imaging
Molekulare Spektroskopie
Optische, berührungsfreie Gewebserkennungsverfahren stellen eine neue Möglichkeit dar, Gewebe entsprechend der histologischen Einteilung zu klassifizieren. Die molekulare Spektroskopie beruht auf der biochemischen Signatur des Gewebes. Diese gewinnt man über die Infrarotspektroskopie, die Ramanspektroskopie und die CARS-Mikroskopie. In einem vom BMBF geförderten Verbundprojekt werden hierzu neue Methoden entwickelt. In der Infrarot- und Ramanspektroskopie findet sich in einem Wellenbereich von 800 bis 1.800 nm der sogenannte „molekulare Fingerprint“ des Gewebes. Die biochemische Signatur ermöglicht es, das Gewebe genau zu identifizieren. Bei der Infrarotspektroskopie wird durch die Beleuchtung eine Vibration der funktionellen Molekülgruppen erreicht, die in einer geänderten Rückstrahlung resultiert. Die Zahl der Atome, ihre Massen und die Stärke ihrer Bindungen definieren die Schwingungsfähigkeit eines Moleküls. Damit wird ein spezifisches Gewebespektrum emittiert. Mit einer speziellen Hochauflösungskamera können diese Spektren wieder zu einem Bild zusammengesetzt werden, das einem histologischen Bild entspricht. Damit ist es gelungen, das Hirngewebe exakt zu identifizieren. Selbst die vom Hirngewebe ausgehenden Gliome werden in ihrer Gradeinteilung unterschieden. Metastasen können den Primärtumoren zugeordnet werden, und eine Analyse von Tumoren bis auf die molekulare Ebene mit Bestimmung von Genveränderungen ist möglich. Eine unserer Untersuchungen beschäftigte sich mit der IDH1-Mutation, die durch die Infrarotspektroskopie dargestellt werden konnte und eine molekulare Klassifizierung der Tumoren erlaubt.
Eine weitere Methode ist die CARS-Mikroskopie. CARS bedeutet Coherent anti-Stokes Raman Spectroscopy. Hier erfolgt die Aktivierung des Gewebes mit unterschiedlichen Lasern. Mit der CARS-Aktivierung können selektiv bestimmte funktionelle Molekülgruppen analysiert werden, z. B. die CH23-Gruppen der Lipide, parallel dazu ohne Zeitverlust mit der Second Harmonic Generation Kollagene und mit der Autofluoreszenz (auch Zwei-Photonen-Anregungsfluoreszenz) infiltrierende Zellen, z. B. Immunzellen oder Endothelzellen. Das CARS-Imaging erlaubt es, in höchster Auflösung z. B. Nervenstrukturen mit Schmidt-Lantermann Inzisuren darzustellen oder auch Veränderung von traumatisiertem Rückenmark und Regenerationszeichen nachzuverfolgen. Bei Tumoren ist es möglich, eine Quantifizierung des normalen Gewebes, der Infiltrationszone und des Tumors vorzunehmen.
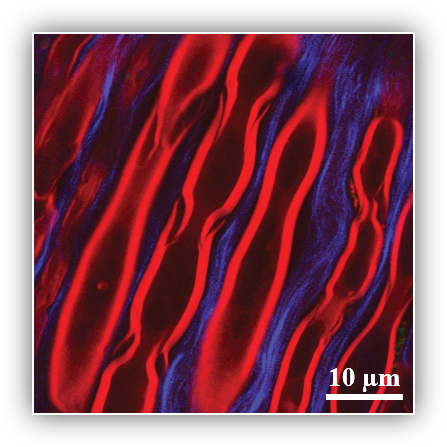
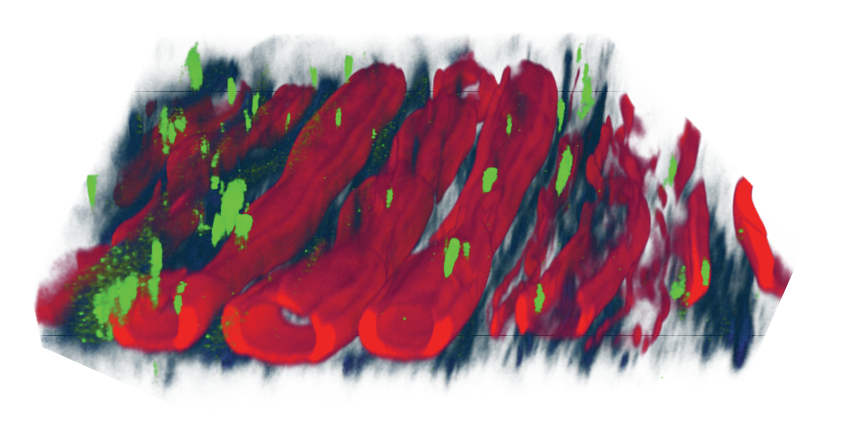
Abb. 5, 6: CARS-Mikroskopie: Nervus suralis mit Schmidt-Lantermann Inzisuren
Ausblick in die Zukunft
Perspektiven für die Zukunft auf dem technischen Sektor gründen sich auf der Vorstellung, ein Endoskop mit entsprechenden Fasern intraoperativ zu nutzen und bereits in situ eine Gewebsdiagnostik vorzunehmen. Dies könnte eine wertvolle Komplementierung zu den heutigen histopathologischen, immunhistochemischen und molekularbiologischen Verfahren sein. Außerdem ist es denkbar, über eine biochemische Kartierung der Hirnstrukturen weitere Aufschlüsse über funktionelle und nicht-funktionelle Hirnareale zu erhalten und diese für Restaurierungen von defekten Hirnstrukturen zu nutzen.
Die Regeneration von Nervenzellen und Hirngewebe und die Restauration von Hirnfunktionen werden zentrale Forschungsgebiete darstellen. Bereits heute gibt es Roboter, die Gliedmaßenfunktionen mit sogenannten Exoskeletons übernehmen können. Mit der tiefen Hirnstimulation kann man sowohl bei M. Parkinson, Dystonie, Depressionen oder Epilepsie und in ersten Versuchen bei Schädel-Hirn-Trauma-Patienten Hirnfunktionen restaurieren. Über kortikale Signalanalysen und eine Translation in Motorfunktionen werden Motorfunktionen, Sprache und Blasenkontrolle wieder möglich. Diese Schnittstelle zwischen Gehirn und einem die Funktion auslesenden elektronischen Chip, das sog. Brain-Machine-Interface, kontrolliert Bewegungen von Gliedmaßenprothesen und restauriert selbst bei quadriplegischen Patienten wieder zuvor messbare kortikale Funktionen.
Auch intraoperativ unterstützen Roboter bereits heute Operationsverfahren, z. B. Instrumentierungen an der Wirbelsäule. Navigationsgestützte Standardtätigkeiten werden zukünftig zunehmend von intelligenten Robotern übernommen.
In der molekularen Diagnostik werden weitere Erkenntnisse über die Entstehung und Komposition von Tumoren unsere Therapien bestimmen. Je früher es möglich ist, die Tumorentstehung zu analysieren, umso eher kann man sich in Richtung einer Prävention und Krankheitsvermeidung bewegen.
GEORGE CHURCH, EIN GENETIKER DER HARVARD MEDICAL SCHOOL SCHREIBT: “The best way to predict the future is to change it.”
Schackert G: Neurochirurgie aktuell. Passion Chirurgie. 2018 November, 8(11): Artikel 03.
Autor des Artikels
Prof. Dr. med. Gabriele Schackert
KlinikdirektorinKlinik und Poliklinik für NeurochirurgieUniversitätsklinikum Carl Gustav Carus an der Technischen Universität DresdenFetscherstraße 7401307Dresden kontaktierenWeitere aktuelle Artikel
11.11.2023 BDC|News
Passion Chirurgie im November 2023
Im Novemberheft steht das Thema "Neurochirurgie" im Fokus. Werfen Sie einen Blick in die spinale Neurochirurgie, lesen Sie Neues zum Karpaltunnelsyndrom oder dem Schädel-Hirn-Trauma, ein Krankheitsbild im Wandel.
01.11.2023 BDC|News
Editorial 11/2023: Neurochirurgie vor großen Aufgaben
Die Gesundheitspolitiker von Bund und Ländern haben in den letzten Monaten zur Umsetzung der geplanten Krankenhausreform viel Arbeit investiert. Einig ist man, dass hierzu ein Strukturwandel in der stationären Versorgung notwendig ist. Die stationäre Versorgung kann nicht ohne Berücksichtigung der ambulanten Versorgung reformiert werden.
01.11.2023 Neurochirurgie
Einblick in die spinale Neurochirurgie
Rückenbeschwerden sind in der heutigen Zeit ein alltägliches Problem, das einen beachtlichen Teil der Bevölkerung belastet. Nicht immer, aber auch nicht selten ist eine Operation an der Wirbelsäule indiziert. Ursächlich sind am häufigsten degenerative Veränderungen wie die Spinalkanalstenose, der Bandscheibenvorfall oder die Spondylolisthese.
01.11.2023 Neurochirurgie
Das Schädel-Hirn-Trauma in Deutschland – ein Krankheitsbild im Wandel
Aktuelle Zahlen der Gesundheitsberichterstattung des Bundes zeigen, dass das Schädel-Hirn-Trauma (SHT) in Deutschland weiterhin ein relevantes Krankheitsbild ist. So wurden im Jahr 2019 deutschlandweit 421.060 Patienten mit einer Verletzung des Kopfes (ICD-10: S00–S09) vollstationär behandelt, was einer Steigerung von 21 % im Vergleich zum Jahr 2000 entspricht [7].
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.






















