Historie der Endoprothetik
Der Beginn der endoprothetischen Arthrosebehandlung des Hüftgelenks geht auf die 1920er Jahre zurück, als Hey-Groves erstmalig versuchte, den Hüftkopf mit einem Elfenbeinimplantat zu ersetzen [1]. 1923 folgte eine Entwicklung von Smith-Petersen, in der eine Schale aus Glas temporär auf den Hüftkopf gesetzt wurde [2]. Zu jener Zeit standen neben septischen Komplikationen auch materialbedingte Fremdkörperreaktionen der Weiterentwicklung und Etablierung der Hüft-Endoprothetik entgegen. Die Erforschung alternativer Materialien führte 1938 zu der Verwendung von Hüft-Implantaten aus einer Chrom-Kobalt-Molybdän-Legierung. Phillip Wiles verankerte hierbei eine Hüftpfanne mit zwei Schrauben und ersetzte den Hüftkopf durch einen im Schenkelhals verlaufenden Schraubenbolzen [3]. Die damals geringe Präzision in der Fertigungstechnik führte unweigerlich zu vermehrtem Metallabrieb und dadurch bedingten Lockerungen der Komponenten. Daraufhin etablierte sich in den Folgejahren die Hemiarthroplastie, d. h. der Implantation einer intramedullär verankernden Femurkopfprothese ohne Ersatz der Pfanne [4]. Durch Überlastung des Azetabulums kam es durch knöcherne Ausdünnung der Gelenkpfanne zur Migration der Prothese in das kleine Becken.
Ein revolutionärer Fortschritt in der Hüft-Endoprothetik gelang Charnley in den 1960er-Jahren durch die Einführung von Knochenzement und Polyethylen [5], beides Voraussetzungen für eine primär belastungsstabile Verankerung und ein verbessertes Gleit- und Abriebverhalten. Trotz dieser Fortschritte war die dauerhafte Haltbarkeit der Implantate begrenzt [6]. Eine mögliche Ursache der Lockerungen wurde im Knochenzement vermutet, sodass in den 70er-Jahren die Entwicklung zementfrei verankerter Prothesen einen neuerlichen Aufschwung erfuhr [5]. Initial reichte jedoch die knöcherne Integration für eine stabile Verankerung der Komponenten nicht aus. Die Ursache hierfür wurde vor allem in der unphysiologischen Krafteinleitung, mit dem daraus resultierenden Stress-Shielding-Effekt, gesehen. Diese Problematik wurde mit einer vergrößerten Implantatoberfläche durch Aufrauhung reduziert [7, 8]. In den nachfolgenden Jahren und Jahrzehnten wurden diese Grundprinzipien weiterentwickelt und optimiert. Neben einer effizienteren Oberflächenstruktur wurden Schwerpunkte auf eine verbesserte Primärstabilität sowie eine weitgehend physiologische Krafteinleitung gelegt, die das Risiko einer aseptischen Lockerung minimierten.
Viele dieser Neuerungen verbesserten das Outcome und die Überlebensraten in der endoprothetischen Gelenkchirurgie. Es wurde zunehmend schwieriger, weitere bahnbrechende Innovationen zu entwickeln, da das Langzeitüberleben von zementfrei fixierten Geradschäften auf über 90 Prozent gelangt ist [9]. Auch die Einführung von Navigation und Robotik zeigten in der damalig eingeführten Form keine relevanten Vorteile. Innovationen der letzten Jahre umfassten patientenspezifische Schnittblöcke und roboterassistierte Chirurgie. Eine weitere Neuentwicklung mit einem positiven Einfluss auf die postoperative Patientenmobilisation und Rehabilitation konnte durch minimalinvasive muskelschonende Zugänge erreicht werden. Ferner kam es in den vergangenen Jahren zur Entwicklung knochensparender Implantate in Form von Kurzschaftprothesen. Das neue Schaftdesign mit den unterschiedlichsten Konzepten der knöchernen Verankerung findet weltweit zunehmend Verbreitung. Die gelenknahe Krafteinleitung soll den Stress-Shielding-Effekt und somit die Standzeit positiv beeinflussen. Die knochensparende Resektion ermöglicht eine bessere knöcherne Ausgangssituation im Falle eines Schaftwechsels. Inwieweit sich hierdurch das Outcome und die Überlebensraten verbessern, bleibt abzuwarten.
Rekonstruktion des Gelenkzentrums durch Hüft-TEP
Ist die Spannung der Glutealmuskulatur zu gering, besteht auch das Risiko eines positives Trendelenburg-Zeichen bei zu geringer Vorspannung. Mittlerweile besteht durch Planungssoftwares die Möglichkeit, die Rekonstruktion des Gelenkzentrums durch die Hüft-TEP anhand von Röntgenbildern zu planen. Hierbei können folgende Aspekte überprüft werden:
- Bestimmung der korrekten Implantatgrößen
- Rekonstruktion der Beinlänge
- Rekonstruktion des femoralen Offsets
- Bestimmung der korrekten Osteotomiehöhe
- Vermeidung von Komplikationen
Die präoperative Planung anhand von Röntgenbildern gibt Hinweise über die zu erwartende Größe von Pfannen- und Schaftkomponenten. Hierdurch können intra- und postoperative Komplikationen verringert werden. Allerdings liegt die Wahrscheinlichkeit der Vorhersage der exakten Größe laut Literatur zwischen 22 bis 92 Prozent sowie die der Vorhersage einer abweichenden Größe bei bis zu 100 Prozent [10-12]. Wählt der Operateur die Größe für den Hüftschaft zu groß, besteht das Risiko einer Schaftfissur, die entweder intraoperativ mit einer weiteren Osteosynthese (wie Drahtcerclagen) oder Revisionsschäften versorgt werden muss. Werden diese Fissuren intraoperativ nicht erkannt, besteht das Risiko einer postoperativen Ausdehnung der Fraktur. Wird der Schaft zu groß gewählt und kommt es dabei zu keiner Knochenfissur, kann der Schaft nicht in die geplante Tiefe des Oberschenkelknochens eingebracht werden, woraus sich eine Beinverlängerung ergeben kann. Wird der Schaft zu klein gewählt, birgt dies im Verlauf das Risiko einer Schaftsinterung bzw. -lockerung. Eine postoperative Schaftsinterung kann die intraoperativ eingestellte Muskelspannung soweit reduzieren, dass das Risiko einer Hüft-TEP-Luxation erhöht ist.
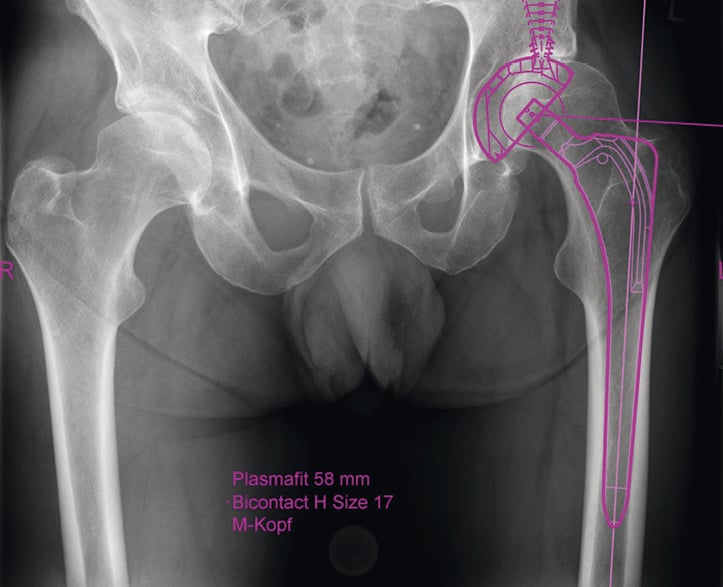
Abb.1: Planungsbeispiel mit Geradschaftprothese zur Rekonstruktion des Gelenkzentrums
Durch die Planung kann auch die postoperative Beinlänge abgeschätzt werden [10]. Über die Kopfkomponente lässt sich intraoperativ bei bereits einliegenden Hüft-TEP-Schaft die Beinlänge einstellen. Liegt beispielsweise eine Coxa vara mit einem kurzen Schenkelhals vor, besteht durch die Implantation einer Hüft-TEP das Risiko einer Beinverlängerung. Fällt dies bei der präoperativen Planung auf, kann zum Beispiel durch die Implantation eines zementierten Schaftes die zu erwartende Beinverlängerung reduziert werden. Zementierte Komponenten werden kleiner als der Knochendurchmesser gewählt, um Platz für den Zementmantel zwischen Knochen und Prothese zu lassen. Hierdurch können die Schäfte bei einer Coxa vara tiefer in das Femur eingeführt werden.
Eine gewisse Beinverlängerung um wenige Millimeter ist jedoch sinnvoll, um eine Luxationsneigung zu minimieren. Besteht eine beidseitige Koxarthrose, kann die Beinlänge komplikationslos bei Versorgung der zweiten Hüfte ausgeglichen werden.
Die Literatur zeigt, dass häufig nach Implantation einer Hüft-TEP die operierte Extremität verlängert ist. Weil keine einheitliche Grenze besteht, ab wie viel Millimeter Abweichung zur Gegenseite von einer Beinlängendifferenz gesprochen werden kann, sind die Ergebnisse der bisherigen Studien nicht einheitlich [13]. Während in einer Studie 14 (16 Prozent) von 85 Patienten nach Implantation einer H-TEP eine unterschiedliche Beinlänge aufwiesen [14], ergab eine andere Studie, dass das operierte Bein sogar in 144 von 150 Fällen um 15,9 ± 9,54 mm verlängert worden war [15]. Es wird davon ausgegangen, dass eine Beinlängendifferenz von >10-20 mm vom Patienten wahrgenommen wird und zu Implantatkomplikationen führen kann [16].
Ferner wird durch die Implantation einer Hüft-TEP versucht, das femorale Offset zu rekonstruieren [10, 12, 17-19]. Das femorale Offset hat einen entscheidenden Einfluss auf die Vorspannung der Glutealmuskulatur. Durch die Wahl des Prothesentyps und die Höhe der Osteotomie bei Kurzschaftprothesen kann das Offset beeinflusst werden. Bei Geradschaftprothesen gibt es je nach Prothesenhersteller verschiedene Offset-Varianten. Beispielsweise gibt es von der herkömmlichen Geradschaftprothese der Firma Aesculap eine Prothese mit einem Standardoffset und eine mit einem großen Offset. Ferner bietet eine SD-Version, ein Prothesenmodell für dysplastische Anatomien, ein Offset ähnlich dem des Standardmodells bei gleichzeitig reduzierter Beinlänge.
Bei Kurzschaftprothesen mit metaphysärer Verankerung beeinflusst die Osteotomiehöhe das femorale Offset. Je höher die Osteotomiehöhe ist, desto varischer kommt die Prothese zu liegen. Eine tiefe Resektion führt zu einer valgischen Positionierung. Je nach Hersteller gibt es eine Auswahl an Prothesenvariationen mit unterschiedlichen Centrum-Caput-Diaphysenwinkeln. Auch die Wahl des Kopfes beeinflusst das femorale Offset. Je länger der Kopf ist, desto größer wird das femorale Offset. Hierdurch bieten Kurzschaftprothesen bei anatomischen Besonderheiten mit einem großen Offset eine bessere Option zur Rekonstruktion des Gelenkzentrums [Abb. 1].
In der Literatur wird beschrieben, dass eine Erweiterung des femoralen Offsets um 15 Prozent zu Veränderungen des Gangbildes führen [20] und ab 35 Prozent mit einer erhöhten Vorspannung der Glutealmuskulatur einhergeht [21].
Fazit
Bedingt durch das gute Outcome und die gute Überlebensrate nach Hüft-TEP wurde die Implantation einer Hüft-TEP als Operation des Jahrhunderts bezeichnet. Nach 15 Jahren beträgt das revisionsfreie Implantatüberleben von zementfreien Hüftprothese etwa 95 Prozent [22]. Langzeitergebnisse zu zementierten Implantatsystemen erreichten nach 35 Jahren ein Komponentenüberleben von 78 Prozent [23]. Essenziell für ein gutes Outcome ist die Rekonstruktion des Gelenkzentrums und hierdurch die der Beinlänge und des Offsets. Die präoperative Planung anhand von Röntgenbildern hilft dabei, dies zu optimieren. Zudem kann hierdurch die zu erwartenden Größe der Implantate abgeschätzt werden, was wiederum das Risiko von Komplikationen verringert.
Wirries N, Flörkemeier T: Endoprothetik und Revisionsendoprothetik – Planung und Ergebnisse Hüft-TEP. Passion Chirurgie. 2018 September, 8(09): Artikel 03_02.