01.06.2025 Aus-, Weiter- & Fortbildung
CME-Artikel: Aktueller Stand der minimalinvasiven Viszeralchirurgie – Was hat bereits Einzug in den klinischen Alltag erhalten?
Erweitern Sie Ihre CME-Punkte, indem Sie nach dem Lesen des Artikels die Fragen dazu in der BDC|eAkademie beantworten!
Der Artikel „Aktueller Stand der minimalinvasiven Viszeralchirurgie“ ist für BDC-Mitglieder drei Monate kostenlos in ihr Konto gebucht! Loggen Sie sich auf www.bdc-eakademie.de ein: Einfach starten!
Historische Hintergründe zur Laparoskopie
Die minimalinvasive Chirurgie (MIC) hat in den letzten Jahrzehnten einen revolutionären Wandel in der operativen Medizin eingeleitet. Einen bedeutenden Meilenstein stellt die Laparoskopie dar, deren Anfänge bis ins frühe 20. Jahrhundert zurückreichen. Bereits 1901 führte der deutsche Internist Georg Kelling eine experimentelle Bauchspiegelung (Celioskopie) an einem Hund durch, bei der er die Bauchhöhle durch ein starres Endoskop inspizierte. 1910 unternahm der schwedische Internist Hans Christian Jacobaeus erste laparoskopische Versuche am Menschen. Die Entwicklung war jedoch lange Zeit durch technische Limitierungen und das Fehlen einer adäquaten Bildgebungstechnologie gehemmt.
In den 1960er und 1970er Jahren trieb Kurt Semm, ein deutscher Gynäkologe, die Technik mit der Einführung der CO2-Insufflation des Bauchraums weiter voran und standardisierte die Anwendung der Laparoskopie, insbesondere bei gynäkologischen Eingriffen. Seine bedeutendste Leistung war jedoch die erste laparoskopische Appendektomie im Jahr 1980, die einen Paradigmenwechsel in der Chirurgie markierte.
Die Verbreitung der Laparoskopie in der Viszeralchirurgie nahm in den 1990er Jahren rasant zu, vor allem dank der Einführung von Videokameras, die den Chirurg:innen eine klare und vergrößerte Sicht auf das Operationsfeld ermöglichten. Insbesondere die laparoskopische Cholezystektomie setzte sich weltweit als Standardverfahren durch. In den folgenden Jahren kamen immer mehr Eingriffe hinzu, wie laparoskopische Hernienreparationen, Fundoplikationen und Darmresektionen. Diese Entwicklung stellte die Weichen für die moderne MIC, die sich heute durch kontinuierliche technologische Innovationen auszeichnet.
Advanced Energy: Dissektion und Blutstillung auf einem neuen Level
„Advanced Energy“-Technologien haben die Möglichkeiten zur sicheren Dissektion und Blutstillung revolutioniert. Jenseits klassischer mono- und bipolarer Koagulationsverfahren bieten moderne Geräte wie ultraschallbasierte und bipolare Versiegelungssysteme sowie radiofrequenzgestützte Instrumente eine präzise und effiziente Gewebehandhabung.
Durch hochfrequente Vibration von Ultraschallskalpell-Systemen wird Gewebe gleichzeitig geschnitten und Gefäße bis zu einem Durchmesser von 7 mm sicher versiegelt. Diese Technologie minimiert thermische Schäden an umliegenden Strukturen und bietet eine schnelle und nahezu blutungsfreie Dissektion.
Die Weiterentwicklung dieser Technologien hat auch die Effizienz und Sicherheit in schwierigen Operationssituationen, wie bei der Dissektion in entzündlichem oder fibrotischem Gewebe, erheblich verbessert. Gleichzeitig sollen sie dazu beitragen, die Eingriffsdauer zu verkürzen und das postoperative Komplikationsrisiko zu verringern.
Zukünftige Innovationen könnten durch „Smart Feedback“-Systeme, die die Gewebebeschaffenheit in Echtzeit analysieren und die Energiezufuhr automatisch anpassen, die Gewebepräparation weiter optimieren.
Minimalinvasive Klammernaht: Präzision und Effizienz bei Anastomosen
Die Klammernaht hat sich als unverzichtbares Verfahren in der MIC etabliert, insbesondere bei der Anlage von Anastomosen in der GI-Chirurgie. Zwei zentrale Systeme sind die linearen Klammernahtgeräte, bekannt als GIA (Gastrointestinal Anastomosis), und die zirkulären Klammernahtgeräte.
GIA-Klammernahtgeräte werden hauptsächlich für die lineare Transsektion und Verschluss von Gewebe sowie für die Anlage von Seit-zu-Seit-Anastomosen verwendet. Sie ermöglichen präzise Gewebeschnitte mit gleichzeitiger Applikation von Klammern, was Blutungen minimiert, die Sicherheit erhöht und eine Kontamination des OP-Situs vermeidet. Zirkuläre Klammernahtgeräte hingegen kommen bei der Anlage von End-zu-End- oder End-zu-Seit-Anastomosen zum Einsatz, beispielsweise nach Dickdarmresektionen. Sie arbeiten mit einem zirkulären Mechanismus, der insbesondere bei Anastomosen im kleinen Becken sowie bei transhiataler und transthorakaler Anwendung von Vorteil ist, wo der Raum begrenzt ist.
Die Einführung von „Smart Stapling“-Technologien hat die Klammernaht weiter optimiert, indem Geräte mittels Sensoren Gewebedicke und -spannung in Echtzeit messen und die Klammerapplikation automatisch anpassen.
Die minimalinvasive Klammernaht kann durch diese fortschrittlichen Technologien Präzision, Sicherheit und Effizienz kombinieren und eine Schlüsselrolle bei der Weiterentwicklung der MIC spielen.
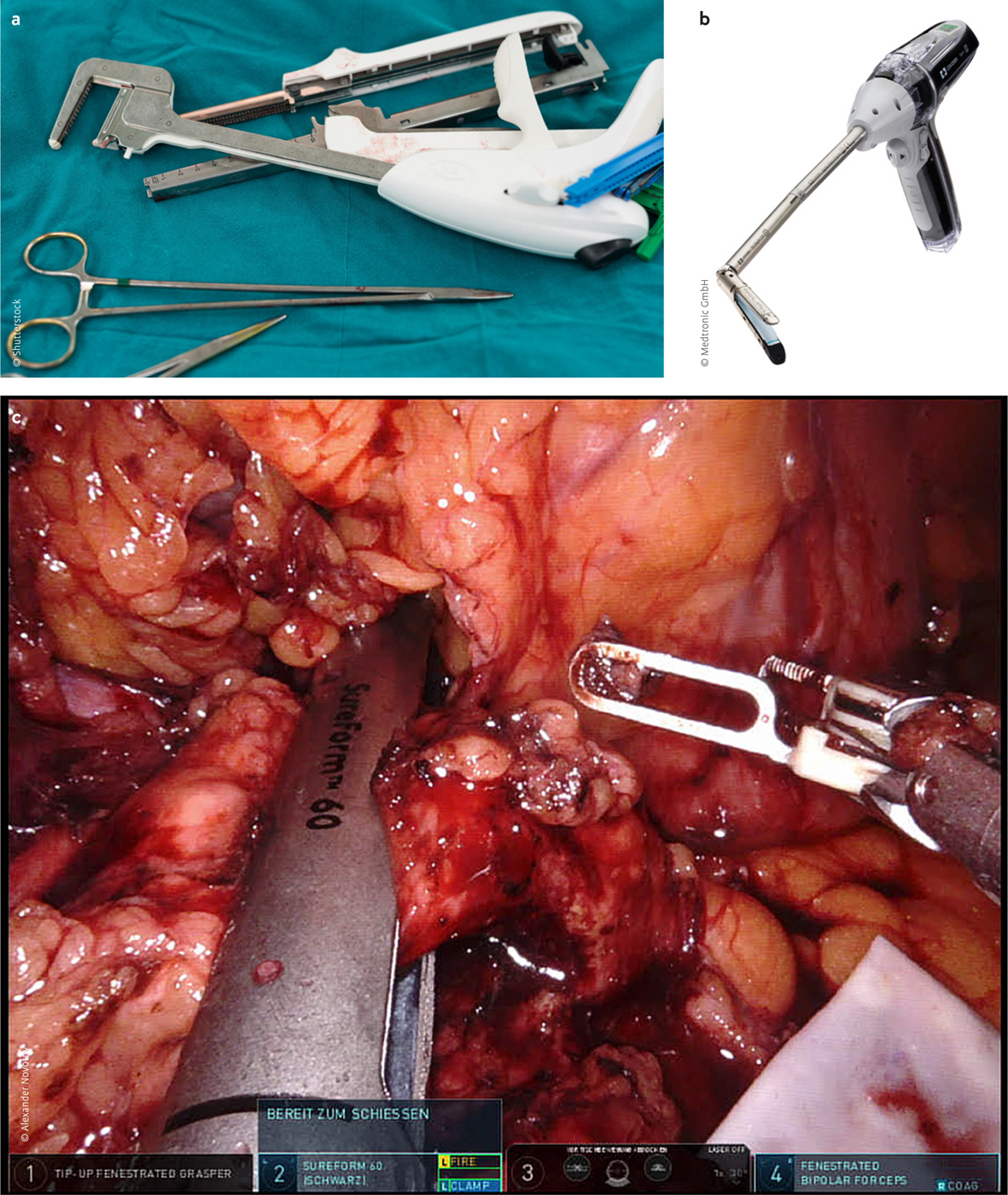
Abb. 1 a–c: a) Lineare Klammernahtgeräte wie sie in der offenen Chirurgie zur Anwendung kommen. b) Laparoskopisch einsetzbarer Smart Stapler mit visuellen und hörbaren Feedback zu unterschiedlichen Gewebestärken (kleiner grüner LED-Bildschirm am Ende des Geräts). Signia™ Powered stapler with Tri-Staple™ technology. c) Robotischer Smart Stapler bei der Transsektion des Pankreashalses i. R. der Linksresektion – schrittweise und dosierte Kompression des Gewebes während des Auslösens.
HD und UHD – Eine Bildqualität wie zu Hause auf dem Fernseher!
Die Einführung hochauflösender (HD) und ultra-hochauflösender (UHD) Bildgebungssysteme hat die Visualisierung in der MIC deutlich verbessert. UHD-Systeme liefern eine viermal höhere Auflösung im Vergleich zu HD, wodurch selbst feinste anatomische Strukturen und Gewebedetails sichtbar werden.
Insbesondere Gefäßstrukturen, Nervenbahnen und pathologische Veränderungen, die in herkömmlicher HD-Qualität weniger gut erkennbar sind, werden deutlich besser dargestellt. Diese Systeme verbessern nicht nur die Tiefenschärfe, sondern auch die Farbtreue, was die Identifikation von Gewebetypen erleichtert. Dadurch wird zum Beispiel die Beurteilung der Resektionsränder oder die Schonung empfindlicher Strukturen deutlich präziser.
Zudem profitieren moderne Bildgebungssysteme häufig von zusätzlichen Features wie HDR (High Dynamic Range), das Kontraste verstärkt und die Sichtbarkeit in schwierigen Lichtverhältnissen optimiert. Die Integration von 3D-Bildgebung in UHD-Systeme verbessert die Tiefenwahrnehmung zusätzlich.
Zukünftige Entwicklungen könnten UHD-Bildgebung mit künstlicher Intelligenz kombinieren, um Bildanalysen in Echtzeit zu liefern und damit die Entscheidungsfindung weiter zu unterstützen.
3D-Laparoskopie: Eine neue Dimension der Visualisierung
Die Einführung der 3D-Laparoskopie stellt eine weitere Verbesserung in der visuellen Unterstützung minimalinvasiver Eingriffe dar, indem eine verbesserte Tiefenwahrnehmung ermöglicht wird. Dies ist insbesondere bei komplexen Eingriffen von Vorteil, die eine hohe Präzision und komplexe Dissektionen erfordern. Die Technologie verbessert die Hand-Auge-Koordination, verkürzt die Lernkurve für angehende Chirurg:innen und reduziert die Eingriffsdauer sowie die Rate technischer Fehler. Studien haben gezeigt, dass die 3D-Laparoskopie zu einer besseren Ausführung und Präzision bei laparoskopischen Nähten, der Anlage von Anastomosen sowie der Tumorresektion führt.
Der 3D-Laparoskopie kommt die Rolle einer Brückentechnologie zu, da diese bei der roboterassistierten Chirurgie bereits standardmäßig zum Einsatz kommt. Die Zukunft der 3D-Laparoskopie könnte durch die Integration von Augmented Reality (AR) und künstlicher Intelligenz (KI) weiter verbessert werden. Erste Studien evaluieren den Einsatz von AR zur Projektion anatomischer Strukturen, die während der Operation nicht sichtbar sind, wie etwa Nerven oder Gefäße.
Indocyanin-Grün: Fluoreszenzbildgebung zur Optimierung der Operationssicherheit
Die Fluoreszenzbildgebung mit Indocyanin-Grün (ICG) hat sich als wertvolles Hilfsmittel in der MIC etabliert. ICG wird intravenös verabreicht und unter speziellem Licht sichtbar gemacht.
In der Leberchirurgie können die Durchblutung von Lebersegmenten, extrahepatische Gallenwege sowie primäre und sekundäre Tumoren visualisiert werden. In der GI-Chirurgie ermöglicht die ICG eine verbesserte Evaluation der Anastomosen in der Ösophagus- und kolorektalen Chirurgie. Dies kann dazu beitragen, das Risiko von Anastomoseninsuffizienzen zu minimieren, die eine der schwerwiegendsten Komplikationen nach gastrointestinalen EIngriffen darstellen. Bei malignen Befunden lässt sich der Lymphabfluss inkl. Wächterlymphknoten darstellen, was in der onkologischen Chirurgie hilfreich sein kann.
Ein weiteres Einsatzgebiet ist die Schilddrüsen- und Nebenschilddrüsenchirurgie, da mit dieser Methode Nebenschilddrüsen bzw. Nebenschilddrüsenadenome visualisiert werden können.
Robotische Chirurgie: Präzision durch Technologie
Die Robotik hat in der Chirurgie einen rasanten Aufstieg erlebt und gehört mittlerweile zu den modernsten Technologien in der MIC. Die aktuell eingesetzten robotischen Systeme ermöglichen Operateur:innen eine präzise, minimalinvasive Durchführung von Eingriffen mit einer Genauigkeit, die mit der konventionellen Laparoskopie nicht zu erreichen ist.
Robotische Systeme bieten mehrere wesentliche Vorteile: Neben einer Verbesserung der Ergonomie eliminieren sie das natürliche Zittern der Hand, bieten eine vergrößerte 3D-Darstellung des Operationsfeldes und ermöglichen Bewegungen mit Freiheitsgraden, die jenen des menschlichen Handgelenks ähnlich sind. Diese technischen Fähigkeiten sind besonders nützlich in der komplexen Viszeralchirurgie, etwa bei Operationen an der Bauchspeicheldrüse, bei komplexen Darmresektionen oder in der onkologischen Chirurgie.
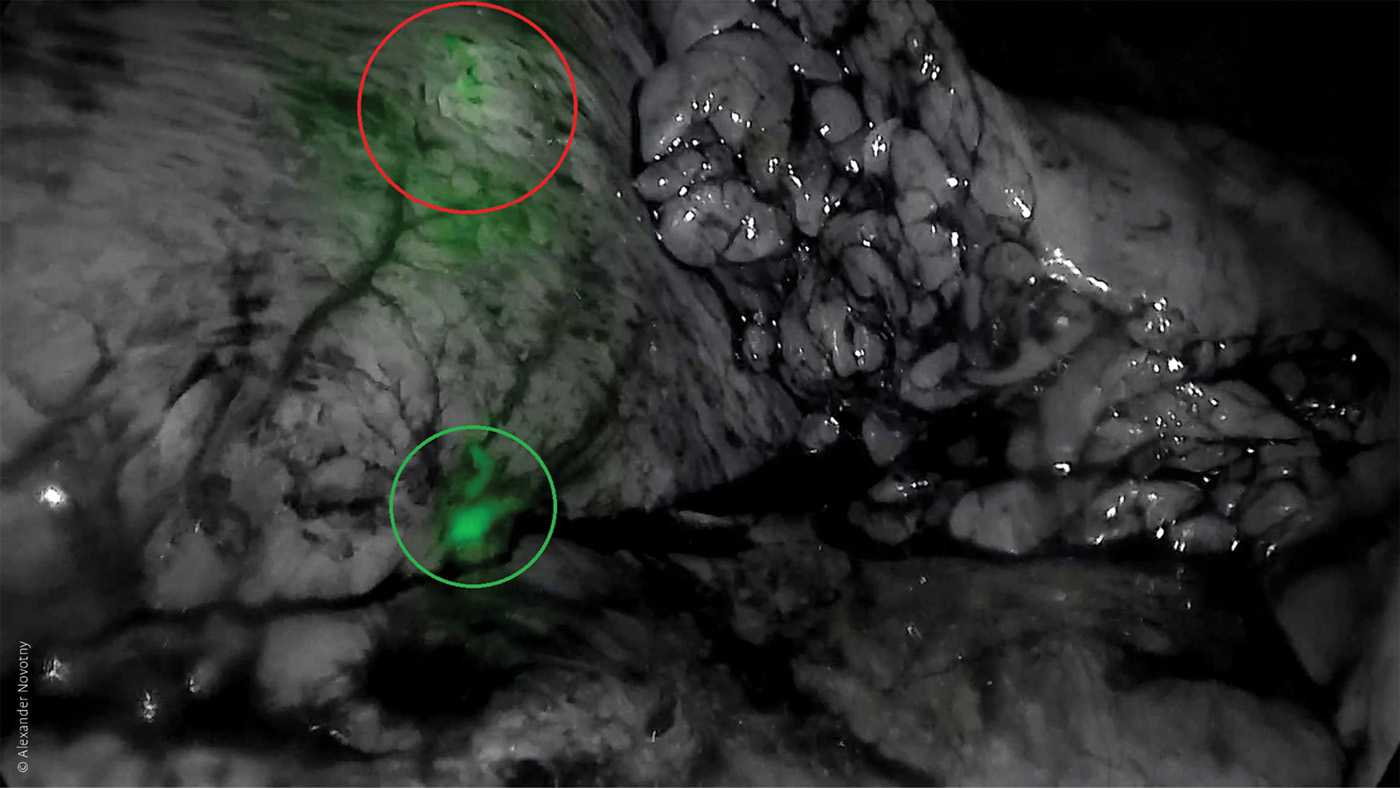
Abb. 2: Nach endoskopischer submuköser ICG-Injektion in eine großkurvaturseitig gelegene Magenläsion (NET) (rot umrandet) präsentiert sich das Sentinel-Basin hingegen kleinkurvaturseitig (grün umrandet).
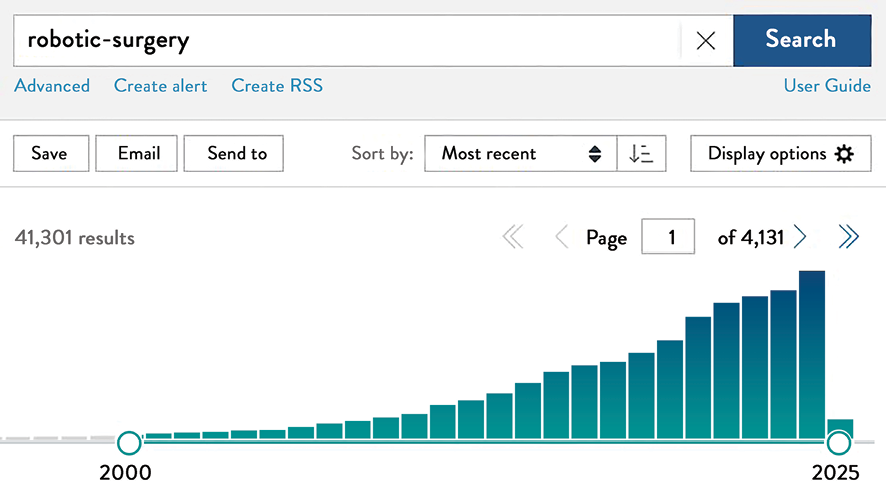
Abb. 3: Suchergebnisse zu robotischer Chirurgie auf Pubmed von 2000–2024: Die Ergebnisse zeigen, dass diese neue Technologie „gekommen ist, um zu bleiben”.
Die erhöhte Beweglichkeit der robotischen Instrumente erleichtert die Dissektion in engen Räumen. Dies ist beispielsweise bei tiefen Rektumresektionen im kleinen Becken von Vorteil, wo eine präzisere Dissektion das anatomiegerechte Operieren erleichtert und das Risiko von Nervenverletzungen minimieren kann, die postoperative Komplikationen wie Harn- und Sexualfunktionsstörungen nach sich ziehen können.
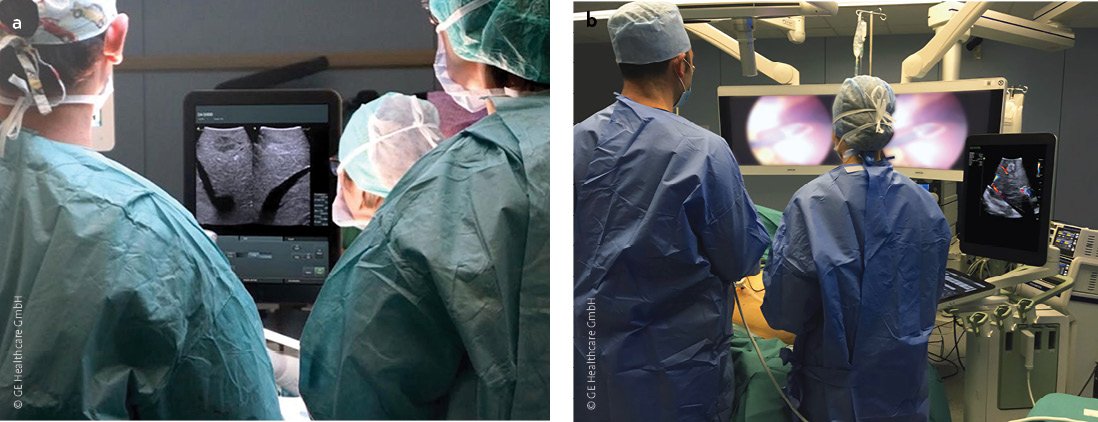
Abb. 4 a,b: Die intraoperative Anwendung von Ultraschallgeräten: a) in der offenen, b) in der minimalinvasiven Chirurgie.
Intraoperativer Ultraschall: Präzision durch Echtzeitbildgebung
Der intraoperative Ultraschall (IOUS) hat sich als unverzichtbares Werkzeug in der MIC etabliert, insbesondere bei komplexen Eingriffen wie der Leber- und Pankreaschirurgie. Durch die direkte Anwendung des Ultraschallkopfes auf das freigelegte Gewebe ermöglicht IOUS eine hochauflösende Echtzeitbildgebung, die präzise Informationen über die anatomische Lage und den Zustand von Organen und Geweben liefert.
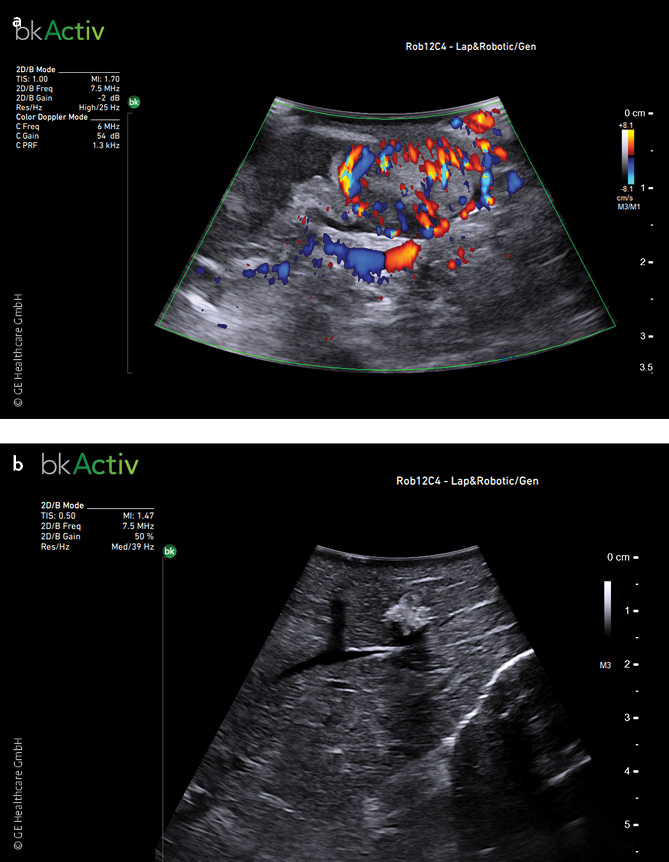
Abb. 5 a,b: Zwei intraoperative Ultraschallbefunde: a) ein Pankreastumor mit Farbdoppler dargestellt, b) eine hyperechogene Lebermetastase mit dorsaler Schallauslöschung.
Ein bedeutender Vorteil des IOUS ist die Fähigkeit, Tumore, Metastasen oder Gefäßstrukturen zu detektieren, die mit herkömmlichen bildgebenden Verfahren während der Operation schwer zu identifizieren sind. So kann der Chirurg beispielsweise bei einer Leberresektion die genaue Lage und Ausdehnung von Läsionen bestimmen, was zu einer optimierten Planung und Durchführung der Resektion beiträgt.
Zukunftsperspektiven für den intraoperativen Ultraschall liegen in der Kombination mit anderen Technologien wie der 3D-Bildgebung oder der Integration in robotische Systeme.
Fazit: Der Fortschritt der minimalinvasiven Viszeralchirurgie
Die MIC hat durch technologische Innovationen eine beispiellose Entwicklung erfahren. Die Kombination von 3D-Laparoskopie, Fluoreszenzbildgebung, robotischer Chirurgie und intelligenten elektronischen Geräten hat die Präzision, Sicherheit und Effizienz operativer Eingriffe erheblich gesteigert. Diese Entwicklungen bieten neue Möglichkeiten, komplexe Eingriffe schonender und sicherer durchzuführen, was letztlich Komplikationen reduzieren soll und zu einer schnelleren Genesung der Patient:innen beiträgt.
Zukünftige Trends werden voraussichtlich durch die fortschreitende Integration von KI, Augmented Reality und weiteren smarten Technologien bestimmt sein, mit dem Ziel, den chirurgischen Workflow weiter zu verbessern. Trotz der hohen Anschaffungs- und teilweise auch Unterhaltskosten, sowie der Notwendigkeit, Chirurg:innen kontinuierlich an neuen Systemen zu schulen, wird erwartet, dass sich weiterhin jene Innovationen in der Breite durchsetzen, die dem Anwender (Chirurg:in) einen wahrnehmbaren Mehrwert bieten.
Literatur
[1] Liselotte Mettler (Hrsg.): Endoskopische Abdominalchirurgie in der Gynäkologie: mit 15 Tabellen. 2002, ISBN 3-7945-1965-5
[2] https://web.archive.org/web/20120204233729/http://www.onekiloclub.org/Kurt_Semm.htm
[3] Litynski GS. Kurt Semm and the fight against skepticism: endoscopic hemostasis, laparoscopic appendectomy, and Semm’s impact on the “laparoscopic revolution”. JSLS. 1998 Jul-Sep;2(3):309-13. PMID: 9876762; PMCID: PMC3015306.
[4] A systematic review and network meta-analysis comparing energy devices used in colorectal surgery. Tech Coloproctol. 2022 Jun;26(6):413-423. doi: 10.1007/s10151-022-02586-0. Epub 2022 Feb 7. PMID: 35132505.
[5] Comparison of perioperative outcomes between bipolar sealing, ultrasonic shears and a hybrid device during laparoscopic gastrectomy for early gastric cancer: a prospective, multicenter, randomized study. Gastric Cancer. 2023 May;26(3):438-450. doi: 10.1007/s10120-023-01365-6. Epub 2023 Feb 3. PMID: 36735157.
[6] 2D vs 3D laparoscopic right colectomy: A propensity score-matching comparison of personal experience with systematic review and meta-analysis. World J Gastrointest Surg. 2021 Jun 27;13(6):597-619. doi: 10.4240/wjgs.v13.i6.597. PMID: 34194617; PMCID: PMC8223707.
[7] The use of 3D laparoscopic imaging systems in surgery: EAES consensus development conference 2018. Surg Endosc. 2019 Oct;33(10):3251-3274. doi: 10.1007/s00464-018-06612-x. Epub 2018 Dec 4. PMID: 30515610.
[8] Intraoperative fluorescence imaging in different surgical fields: Consensus among 140 intercontinental experts. Surgery. 2022 Dec;172(6S):S54-S59. doi: 10.1016/j.surg.2022.07.025. PMID: 36427931.
[9] Indocyanine green (ICG) fluorescence guide for the use and indications in general surgery: recommendations based on the descriptive review of the literature and the analysis of experience. Cir Esp (Engl Ed). 2022 Sep;100(9):534-554. doi: 10.1016/j.cireng.2022.06.023. Epub 2022 Jun 11. PMID: 35700889.
[10] European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 2023 Mar;37(3):1629-1648. doi: 10.1007/s00464-023-09928-5. Epub 2023 Feb 13. PMID: 36781468; PMCID: PMC10017637.

Korrespondierender Autor:
Prof. Dr. med. Alexander Novotny
Allgemein-, Viszeral- und Gefäßchirurgie
Klinikum Freising
prof.novotny@klinikum-freising.de

Dr. med. Selim Oliver Koca
Allgemein-, Viszeral- und Gefäßchirurgie
Klinikum Freising
Chirurgie
Novotny A, Koca SO: CME-Artikel: Aktueller Stand der minimalinvasiven Viszeralchirurgie – Was hat bereits Einzug in den klinischen Alltag erhalten? Passion Chirurgie. 2025 Juni; 15(06/QII): Artikel 03_01.
Mehr CME-Artikel finden Sie auf BDC|Online (www.bdc.de), Rubrik Wissen | Aus-, Weiter- und Fortbildung | CME-Artikel.
Weitere aktuelle Artikel
01.12.2025 Aus-, Weiter- & Fortbildung
BDC|Akademie-Programm 2026
Auch dieses Jahr freuen wir uns, unseren BDC-Mitgliedern und allen, die unsere BDC|Akademie unterstützen, ein umfassendes und spannendes Programm für das neue Fortbildungsjahr 2026 vorlegen zu können. Mit Blick in das Vorwort aus dem letzten Jahr müssen wir feststellen, dass die anstehende Krankenhausstrukturreform die Gesundheitspolitik weiterhin fest im Griff hat. Aber trotz der Verabschiedung eines Krankenhausversorgungsverbesserungsgesetzes (KHVVG) durch den Bundesrat, einem Regierungswechsel mit einer neuen Gesundheitsministerin und einem Krankenhausreformanpassungsgesetz (KHAG) zur Reform der Reform, ist der Sachstand für die Krankenhäuser – Nordrhein-Westfalen einmal ausgenommen – im Wesentlichen weiterhin unverändert unsicher, was am Ende denn nun kommen wird. Das Thema „Fort- und Weiterbildung“ wird auf der großen bundespolitischen Bühne nach wie vor nur am Rande abgehandelt.
01.12.2025 Aus- & Weiterbildung
Förderung der Motivation in die Chirurgie zu gehen
Es ist falsch anzunehmen, dass die junge Generation, die sog. Generation Z, keine Motivation oder Lust hat, etwas zu lernen, zu arbeiten oder in eine Führungsposition aufsteigen zu wollen, wie es hin und wieder gerne unterstellt wird. Wir wissen, wie lang und steinig der Weg vom Abitur bis zum ersehnten Ziel, den erfolgreichen Abschluss mit der Approbation ist.
01.12.2025 Aus-, Weiter- & Fortbildung
BDC bei Operation Karriere 2025
Auch in diesem Jahr war der BDC wieder auf der "Operation Karriere" mit einem Stand vertreten, um Medizinstudierende für die Chirurgie zu begeistert. Sylvia Joachimi und Cindy Mangelsdorf aus der BDC|Akademie begleiteten den Event und beantworteten am BDC-Stand, gemeinsam mit Dr. Ralph Lorenz, BDC-Landesvertreter, Interessierten verschiedene Karrierefragen.
09.11.2025 Aus-, Weiter- & Fortbildung
Jetzt neu: Jahresprogramm der BDC|Akademie für 2026 online
Die BDC|Akademie bietet im Jahr 2026 unseren Mitgliedern und allen
Lesen Sie PASSION CHIRURGIE!
Die Monatsausgaben der Mitgliederzeitschrift können Sie als eMagazin online lesen.